
- •Биохимия
- •Химический состав живых организмов.
- •Химические вещества в живых организмах.
- •Неорганические вещества клетки
- •Функции воды
- •Неорганические соли
- •Роль солей в организме.
- •Органические вещества клетки.
- •Углеводы.
- •Химические свойства моносахаридов. Реакции по карбонильной группе
- •2. Восстановление.
- •Реакции по гидроксильным группам
- •Реакции брожения.
- •Олигосахариды. Полисахариды.
- •Строение дисахаридов.
- •Полисахариды.
- •Крахмал.
- •Амилаза и Амилопектин – две фракции крахмала.
- •Химические свойства полисахаридов:
- •Целлюлоза.
- •Химические свойства целлюлозы:
- •Липиды.
- •Простагландины.
- •Физические свойства липидов.
- •Функции жиров в организме:
- •Нуклеиновые кислоты
- •Биологически важные гетероциклические соединения
- •Кислотно-основные свойства гетероциклов
- •Строение мононуклеотидов
- •Название нуклеозидов и мононуклеотидов
- •Первичная структура днк
- •Вторичная структура днк
- •Структура рнк
- •Белки аминокислотный состав белков
- •Структуры белков первичная
- •Вторичная
- •Третичная
- •Свойства белков электрические
- •Денатурация белка
- •Функции белков в клетке
- •Физические и химические свойства
- •Химические свойства
- •Качественные реакции на белки
- •Биокатализ
- •2 Класс: Трансферазы
- •3 Класс (Гидролазы)
- •4 Класс: Лиазы
- •5 Класс: Изомеразы
- •6 Класс: Лигазы (синтетазы)
- •Номенклатура ферментов
- •Кофакторы
- •Водорастворимые
- •Жирорастворимые
- •I. Коферменты, входящие в состав оксиредуктаз (коферменты дегидрогеназ)
- •I.2.Флавиновые дегидрогеназы
- •I.4. Группа гемма
- •II. Коферменты переноса групп (трансферазы)
- •II.1. Аминотрансферазы.
- •Ацилтрансферазы
- •Основы кинетики ферментативных реакций Зависимость скорости ферментативной реакции от концентрации реагентов
- •Влияние температуры на скорость ферментативных реакций
- •Влияние рН на скорость ферментативной реакции
- •Ингибиторы ферментов
- •Динамическая биохимия
- •Катаболизм Специфические и общие пути катаболизма.
- •Катаболизм углеводов
- •Катаболизм липидов
- •Катаболизм белков
- •Катаболизм аминокислот.
- •Общий путь катаболизма.
- •Цпэ. Тканевое дыхание. Окислительное фосфорилирование.
- •Биосинтезы Биосинтез днк. Репликация.
- •Биосинтез рнк
- •Информационные рнк
- •Рибосомные рнк
- •Трансляция (биосинтез белка)
- •Биосинтез углеводов
- •Биосинтез гликогена
- •Биосинтез жиров
- •Биосинтез жирных кислот.
- •Биосинтез триацилглицеридов
- •Оглавление
I.4. Группа гемма
Эта группа является окислительно-восстановительным кофактором ферментов дыхательной цепи, фотосинтеза и др.
Гем представляет собой простетическую группу. Он представляет собой порфириновый цикл, состоящий из 4-х пирольных колец, связанных группами СН, который в свою очередь связан ковалентными связями с белком. Ион Fe3+ , входящий в порфириновый цикл, способен восстанавливаться до иона Fe2+ и тем самым осуществлять перенос заряда, который является одним из важнейших процессов в живых клетках Электроны, переходят от одного вещества к другому иногда непосредственно, а иногда по цепи специальных переносчиков заряда. Принцип переноса заряда как раз и заключается в том, что ионы переходных металлов (Fe+2, Cu+2) в составе гема способны существовать в различных степенях окисления и принимать или отдавать электрны.
II. Коферменты переноса групп (трансферазы)
II.1. Аминотрансферазы.
В метаболизме азотсодержащих соединений важную роль играют реакции переноса аминогрупп с остатков аминокислот на другие соединения (например, кетогруппы). Это реакции трансаминирования. Они катализируются ферментами, коферментом для которых служит пиридоксальфосфат (производная пиридоксина – витамина B6).
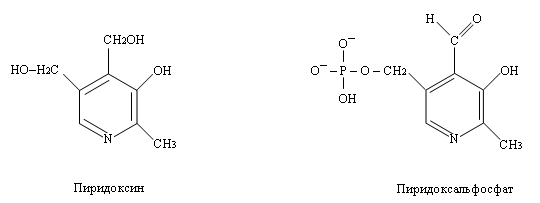
Пиридоксальфосфат ковалентно связан с ферментом за счёт взаимодействия альдегидной группы пиридоксальфосфата и аминогруппы аминокислоты лизина, входящей в состав белковой молекулы фермента (альдиминная связь).

Кроме этой связи пиридоксальфосфат связывается с белковой частью фермента за счёт ионных связей с участком фосфорного остатка и за счёт заряженного атома азота в пиридиновом кольце.
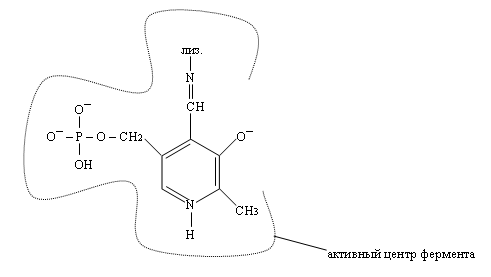
Соединение лизина и пиридоксальфосфата имеет плоское строение, обусловленное пиридиновым кольцом и дополнительной водородной связью между атомом N и атомом H гидроксильной группы.
В процессе реакции трансаминирования аминокислоты, конкурируя с лизином, способны разрывать связь остатка лизина с карбонильной группой передоксальфосфата, вытесняя его из комплекса с ферментом.
Кофермент в этом случае играет роль посредника, т.е. промежуточного акцептора аминогруппы. Весть процесс переноса аминогруппы (NH2) с α-аминокислоты на α-кетокислоту происходит в несколько стадий:
1) На первой аминогруппа субстрата (например, аланина), конкурируя с лизином, образует альдиминную связь с передоксальфосфатом.
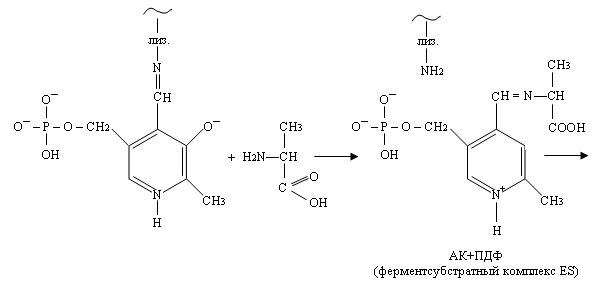
2) Внутримолекулярная перестройка. Под влиянием изомеразы двойная связь переходит от одного углерода к другому.

Образуется кетоиминная группировка – промежуточное соединение, у которого двойная связь находится у того атома углерода, который будет связан с кислородом на следующей стадии.
3) Стадия гидролиза. При этом образуется аминогруппа на коферменте и кетогруппа на бывшей аминокислоте.
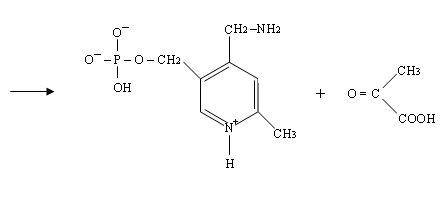
4) Четвёртая стадия происходит при наличии второго субстрата, которым является кетокислота, например, 2-оксоглутаровая:
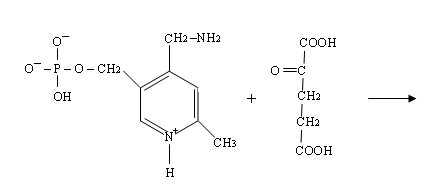
При этом происходит переход пиридоксальфосфата в исходную альдегидную группировку с лизином
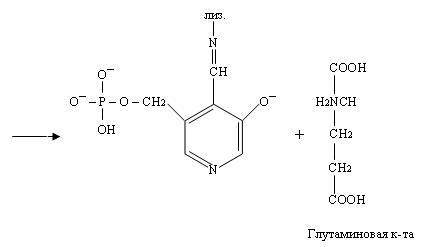
Как видно из уравнений, механизм реакции такой же, как при взаимодействии пиридина с аминокислотой, только конкурентами за кетогруппу кислоты становятся лизин и пиридоксальфосфат.
Осуществление рассмотренной последовательности реакций становится возможным благодаря возникающим конкурентным отношениям. По конкурирующим способностям за карбонильной группой пиридоксальфосфата аминокислоты располагаются в следующий ряд:
глутамат < остаток лизина в полипептиде < остаток аминокислоты
Суммарно весь этот процесс можно изобразить следующим образом:
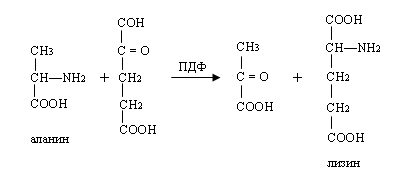
ПДФ в комплексе с декарбоксилазой может катализировать декарбоксилированные глутаминовые кислоты (образуется γ-аминомасляная кислота), гистодина, триптофана и др. аминокислоты.
