
- •Лабораторне заняття №1
- •Завдання для самопідготовки
- •Література
- •Лабораторне заняття № 2
- •Хід заняття
- •Теоретичні питання теми:
- •Завдання для самопідготовки
- •Контрольна робота
- •Література:
- •Ф.Ф.Боєчко, в.М.Найдан, в.М.Захарик, н.М.Захарченко. Органічна хімія. К.: Вища школа, 1986.С.33-38.
- •Лабораторне заняття № 3
- •Хід заняття
- •Теоретичні питання теми:
- •Методика виконання дослідів
- •1) Одержання метану та вивчення його властивостей: відношення до бромної води та водного розчину перманганату калію, горіння / 4 / № 7 (а).
- •Хід роботи.
- •2) Властивості рідких насичених вуглеводнів
- •III. Висновок заняття
- •Домашнє завдання
- •Література:
- •Ф.Ф.Боєчко, в.М.Найдан, в.М.Захарик, н.М.Захарченко. Органічна хімія. К.: Вища школа, 1986.С.10-14, 31-45.
- •Лабораторне заняття № 4
- •Теоретичні питання теми:
- •Лабораторне заняття № 5 Тема: Одержання і хімічні властивості етилену та ацетилену
- •Методика виконання лабораторних дослідів
- •Добування етилену / 4 / № 9 (а), с. 22.
- •Добування етилену.
- •Бромування етилену / 4 / № 9 (б), с. 24.
- •Окиснення етилену / 4 / № 9 (в), с. 24.
- •Горіння етилену / 4 / № 9 (г), с. 24.
- •Добування ацетилену / 4 / № 15 (а), с. 31.
- •Бромування ацетилену / 4 / № 15 (б), с. 32.
- •Реакція ацетилену з kMnO4 / 4 / № 15 (в), с. 32.
- •Горіння ацетилену / 4 / № 15 (г), с. 33
- •Добування ацетиленіду срібла / 4 / № 16 (б), с. 34
- •Висновок заняття
- •Домашне завдання
- •Література:
- •А.А.Петров, х.В.Бальян, а.Г. Трощенко. Органическая химия. –м.: Высшая школа, 1981. С. 69 – 85, 88 – 95
- •Лабораторне заняття № 6
- •Теоретичні питання теми:
- •Контрольна робота
- •Література:
- •Лабораторне заняття № 7
- •Контрольна робота
- •Теоретичні питання теми:
- •Висновок заняття
- •Домашнє завдання
- •Лабораторне заняття № 8
- •Висновок заняття
- •Домашнє завдання
- •Лабораторне заняття № 9
- •Методика виконання лабораторних дослідів
- •Розчинність і нейтральність спиртів / 4 / № 26 (а,б), с. 42.
- •Одержання і властивості етилату натрію / 4 / № 29, с. 44.
- •Хід роботи
- •Добування диетилового ефіру / 4 / № 34 (а), с. 50.
- •Окиснення етилового спирту / 4 / № 45 (б), с. 63
- •Взаємодія спиртів різної атомності з купрум (іі) гідроксидом / 4 / № 30, с. 45
- •Одержання етилового ефіру борної кислоти / 4 / № 33 (б), с. 49
- •Висновок заняття
- •Домашнє завдання
- •Лабораторне заняття № 10
- •Висновок заняття
- •Домашнє завдання
- •Лабораторне заняття № 11
- •Лабораторні досліди
- •Добування мурашиного альдегіду окисненням метилового спирту / 4 / №44, с. 62
- •Добування оцтового альдегіду окисненням етилового спирту / 4/ № 45, с.63
- •Реакція альдегідів з Сu(он)2 в лужному середовищі / 4 / № 51, с. 69
- •Реакція альдегідів з Фелінговою рідиною
- •Реакція “срібного дзеркала” / 4 / № 50, с. 67
- •Реакція альдегідів з фуксинсірчистою кислотою / 4 / № 43 (а), с. 60
- •Висновок заняття
- •Домашнє завдання
- •Лабораторне заняття № 12
- •Висновок заняття
- •Домашнє завдання
- •Література:
- •А.А.Петров, х.В.Бальян, а.Г. Трощенко. Органическая химия. –м.: Высшая школа, 1981. С. 151–169 Лабораторне заняття № 13
- •Теоретичні питання теми:
- •Контрольна робота
- •Методика виконання лабораторних дослідів
- •Порівняння сили карбонових і мінеральних кислот
- •Взаємодія мурашиної кислоти з аміачним розчином гідроксиду срібла (реакція “срібного дзеркала”)
- •Окиснення мурашиної кислоти перманганатом калію
- •Добування оцтової кислоти з її солей
- •Взаємодія оцтової кислоти з карбонатом натрію
- •Відношення оцтової кислоти до дії окислювачів
- •Гідроліз натрієвих солей вищих карбонових кислот
- •Виділення жирних кислот з мила.
- •Лабораторне заняття № 14
- •Висновок заняття
- •Домашнє завдання
- •Література:
- •А.А.Петров, х.В.Бальян, а.Г. Трощенко. Органическая химия. –м.: Высшая школа, 1981. С. 176–188
- •Лабораторне заняття № 15
- •Теоретичні питання теми:
- •Методика виконання лабораторних дослідів
- •Порівняння основних властивостей сечовини і аміаку
- •Утворення солей сечовини
- •Гідроліз сечовини
- •Утворення із сечовини біурету
- •Контрольна робота
- •Література:
- •Лабораторне заняття № 16
- •Теоретичні питання теми:
- •Контрольна робота
- •Література:
- •Лабораторне заняття № 17
- •I. Теоретичні питання теми:
- •Методика виконання лабораторних дослідів
- •Утворення кислих і середніх солей щавлевої кислоти
- •Розклад щавлевої кислоти при нагріванні з н2so4 (конц.)
- •Окиснення щавлевої кислоти
- •II . Контрольна робота
- •III. Література:
- •Лабораторне заняття № 18
- •Теоретичні питання теми:
- •Література:
- •Лабораторне заняття № 19
- •Теоретичні питання теми:
- •Література:
- •Лабораторне заняття № 20
- •Методика і техніка експерименту, які розкривають хімічні властивості ароматичних вуглеводнів
- •Реакція бензену з Br2, kМnO4
- •Реакція толуену з Br2, kМnO4
- •Бромування бензену на світлі
- •Нітрування бензену
- •Відношення стирену до бромної води і розчину перманганату калію
- •Висновок заняття
- •IV. Контрольна робота
- •V. Література:
- •Лабораторне заняття № 21–22
- •Теоретичні питання теми:
- •Лабораторне заняття № 23
- •Лабораторні досліди. Методика і техніка експерименту, які роз-кривають хімічні властивості фенолів:
- •2. Реакція фенолу з FeCl3
- •3. Бромування фенолу
- •4. Окиснення фенолу
- •5. Відновні властивості гідрохінону
- •Висновок заняття
- •Домашнє завдання
- •Контрольна робота
- •Лабораторне заняття №24
- •Теоретичні питання теми:
- •Висновок заняття
- •Домашнє завдання
- •IV. Контрольна робота
- •Лабораторне заняття № 25.
- •Теоретичні питання теми:
- •1. Доведення основних властивостей аніліну
- •3. Ацилування аніліну
- •4. Бромування аніліну
- •5. Окиснення аніліну
- •Висновок заняття
- •Домашнє завдання
- •V. Контрольна робота
- •VI. Література:
- •Лабораторне заняття № 26
- •Теоретичні питання теми:
- •Висновок заняття
- •Домашнє завдання
- •IV Контрольна робота
- •Лабораторне заняття № 27
- •Теоретичні питання теми:
- •II. Висновок заняття
- •III. Домашнє завдання
- •IV. Контрольна робота
- •Лабораторне заняття № 28-29
- •Теоретичні питання теми:
- •Висновок заняття
- •Домашнє завдання
- •Контрольна робота
- •Лабораторне заняття № 30
- •I Теоретичні питання теми:
- •II Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 31
- •I Теоретичні питання теми:
- •II Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 32
- •I Теоретичні питання теми:
- •II. Методика виконання хімічного експерименту, що сприяє закріпленню властивостей білків.
- •1).Висолювання білків
- •2)Денатурація білка
- •III. Висновок заняття.
- •Лабораторне заняття № 33
- •II Висновок заняття
- •Лабораторне заняття № 34
- •Методика виконання лабораторних дослідів
- •1.Реакція рідких жирів з бромом і йодом
- •2.Омилення жирів.
- •III. Висновок заняття
- •IV. Контрольна робота
- •Лабораторне заняття № 35
- •I Теоретичні питання теми:
- •II. Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 36
- •I Теоретичні питання теми:
- •Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 37
- •I Теоретичні питання теми:
- •II. Висновок заняття
- •Контрольна робота
- •Лабораторне заняття № 38
- •I Теоретичні питання теми:
- •II. Методика виконання хімічного експерименту, що сприяє закріпленню знань про хімічні властивості глюкози і фруктози.
- •III. Висновок заняття
- •IV. Контрольна робота
- •Лабораторне заняття № 39
- •I Теоретичні питання теми:
- •II. Висновок заняття.
- •III. Контрольна робота.
- •Лабораторне заняття № 40
- •I Теоретичні питання теми:
- •II. Методика виконання хімічного експерименту, що сприяє закріпленню знань про хімічні властивості цукрози і мальтози.
- •III. Висновок заняття.
- •IV. Контрольна робота.
- •Лабораторне заняття № 41
- •I Теоретичні питання теми:
- •II. Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 42
- •I Теоретичні питання теми:
- •Методика проведення хімічного експерименту, який сприяє закріпленню знань поданій темі.
- •1.Реакція крохмалю з йодом
- •2.Кислотний гідроліз крохмалю
- •3.Перетворення целюлози в амілоїд
- •4. Кислотний гідроліз целюлози
- •III. Висновок заняття.
- •IV. Контрольна робота.
- •I Теоретичні питання теми:
- •II. Висновок заняття
- •III. Контрольна робота
- •Лабораторне заняття № 44
- •I Теоретичні питання теми:
- •II. Висновок заняття.
- •III. Контрольна робота.
Добування диетилового ефіру / 4 / № 34 (а), с. 50.
Реактиви: етиловий спирт (96%); кислота (концентрована); бромна вода (насичений розчин); перманганат калію (1%-й розчин); натрій (металічний).
Обладнання: прилад для добування діетилового ефіру.
У суху пробірку вносять 1мл етилового спирту і краплями, постійно перемішуючи, добавляють 1мл концентрованої сульфатної кислоти. В одержану суміш вкидають кип’ятильні камінці і обережно нагрівають її до початку кипіння. Після цього в гарячу суміш по стінці пробірки добавляють 10 крапель етилового спирту.
Діетиловий ефір, який утворюється при цьому, виявляють за запахом.
Підпалюють діетиловий ефір поблизу отвору газовідвідної трубки і спостерігають, пари ефіру горять світлим полум’ям.
Н 3С–СН2–ОН
+ НОSО3Н Н3С–СН2–О–SО3Н
+ Н2О
3С–СН2–ОН
+ НОSО3Н Н3С–СН2–О–SО3Н
+ Н2О
Етилсульфатна кислота
Н 3С–СН2–О–SО3Н + Н3С–СН2–ОН Н3С–СН2–О–СН2–СН3 + Н2SО4
Диетиловий ефір
Окиснення етилового спирту / 4 / № 45 (б), с. 63
Реактиви: етиловий спирт (96%); фуксинсірчиста кислота (розчин); біхромат калію; сірчана кислота (10%-ний розчин).
Обладнання: прилад для добування оцтового альдегіду(мідна спіраль).
Окиснення етилового спирту біхроматом калію.
У пробірку вносять 0,5г біхромату калію і 2мл 10%-ного розчину сульфатної кислоти. Постійно перемішуючи реакційну суміш, поступово краплями добавляють у неї 2мл етилового спирту. Спостерігають, як розігрівається суміш і змінюється її забарвлення.
Одержаний водний розчин оцтового альдегіду досліджують на наявність альдегіду. Для цього до 1мл фуксинсірчистої кислоти добавляють 1мл одержаного водного розчину оцтового альдегіду. Спостерігають, як розчин фуксинсірчистої кислоти забарвлюється у рожево-фіолетовий колір. Отже, у пробірці-приймачі у водному розчині міститься оцтовий альдегід. Одержаний водний розчин оцтового альдегіду залишають для проведення реакції срібного дзеркала і реакції з купрум (ІІ) гідроксидом.
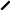 O
O
3 Н3С–СН2–ОН+ К2Сr2O7+ 4 H2SO4 3H3C–C + K2SO4 + Cr2(SO4)3 +
H + 7H2O
Взаємодія спиртів різної атомності з купрум (іі) гідроксидом / 4 / № 30, с. 45
Реактиви: етиловий спирт (96%); етиленгліколь; гліцерин; (5%-й розчин); гідроксид натрію (5%-й розчин).
Дослід проводять одночасно в трьох пробірках, у кожну з яких вносять по 1мл 5%-ного розчину купрум (ІІ) сульфат і 1мл 5%-ного розчину натрію гідроксиду. У пробірках утворюється осад купрум (ІІ) гідроксиду. Після цього в першу пробірку добавляють 1мл 96%-ного етилового спирту, у другу – 1мл етиленгліколю, у третю – 1мл гліцерину. Реакційні суміші в пробірках перемішують. Спостерігають, як етиленгліколь і гліцерин розчиняють купрум (ІІ) гідроксид і розчини в другій і третій пробірках забарвлюються в темно-синій колір за рахунок утворення розчинних у воді комплексних сполук гліколяту і гліцерату купруму (ІІ). Етиловий спирт не розчиняє купру му (ІІ) гідроксид. Отже, кислотні властивості дво- і триатомних спиртів виражені значно сильніше, ніж одноатомних.
Н

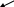
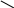 СН2–ОН СН2–О
:О–СН2
СН2–ОН СН2–О
:О–СН2
2
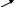 + Сu(ОН)2
Сu + 2Н2О
+ Сu(ОН)2
Сu + 2Н2О
СН2–ОН СН2–О: О–СН2
Н
Гліколят купруму (ІІ)
Н
│
С
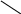 Н2–ОН
СН2–О
:О–СН2
Н2–ОН
СН2–О
:О–СН2
│ │ │
С
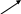 Н–ОН
+ Сu(ОН)2 СН–ОН Сu
НО–СН + 2Н2О
Н–ОН
+ Сu(ОН)2 СН–ОН Сu
НО–СН + 2Н2О
│ │ │
СН2–ОН СН2–О: О–СН2
│
Н
Гліцерат купруму (ІІ)
Реакція з купрум (ІІ) гідроксидом є якісною на багатоатомні спирти. Поясніть, чому кислотні властивості дво- і триатомних спиртів сильніші, ніж одноатомних
