
- •Молекулярна фізика і термодинаміка
- •1 Молекулярно-кінетичний і термодинамічний підходи (методи) при вивченні речовини
- •2 Ідеальний газ. Рівняння Менделєєва-Клапейрона. Ізопроцеси в газах
- •Розв’язок:
- •3 Основне рівняння мкт
- •4 Ступінь вільності молекул. Закон рівномірного розподілу енергії за ступенями вільності. Енергія складної молекули
- •5 Теплоємність. Види теплоємності
- •6 Перший закон (начало) термодинаміки. Вічний двигун першого роду
- •7 Елементарна теорія теплоємності ідеального газу
- •8 Робота при ізопроцесах
- •9 Розподіл молекул Максвела
- •10 Розподіл молекул в потенціальному полі. Розподіл Больцмана
- •11 Види кінетичних явищ. Явища дифузії, в’язкості (внутрішнє тертя), теплопровідності
- •12 Оборотні і необоротні процеси. Цикли. Теплові двигуни. Ккд теплових машин
- •13 Цикл Карно та його ккд. Холодильні машини
- •Розв’язок:
- •14 Другий закон термодинаміки та його статистичний зміст
- •15 Ентропія та вільна енергія як однозначні функції стану системи
- •Розв’язок:
- •Загальна зміна ентропії
- •16 Реальні гази. Рівняння Ван-дер-Ваальса
- •17 Зрідження газів та застосування зрідженних газів
- •17.1 Метод Пікте
- •17.2 Турбодетандерний метод
- •17.3 Метод зрідження газів, що базується на ефекті Джоуля-Томсона
- •Розв’язок:
- •18 Фази. Фазові перетворення
- •18.1 Означення фази. Агрегатні стани речовини. Рівновага фаз
- •18.2 Рівняння Клапейрона-Клаузіуса
- •18.3 Поверхневий натяг. Формула Лапласа. Надплинність
- •Розв’язок:
- •18.4 Дальній та ближній порядок
- •18.5 Типи кристалічних граток. Моно- і полікристали
- •18.6 Теплове розширення твердих тіл
- •18.7 Теплоємність твердих тіл. Закон Дюлонга і Пті
- •Програмні питання
Розв’язок:
1) Запишемо І закон термодинаміки:
![]() ,
,
Q=0, А=0 (для даного випадку адіабатичного розширення в пустоту).
2) Внутрішня енергія реального (Ван-дер-Ваальсівського) газу складається із кінетичної і потенціальної енергії його молекул і визначається у вигляді:
![]() .
.
3) Звідси отримуємо:
![]() .
.
4)
![]() .
.
5)
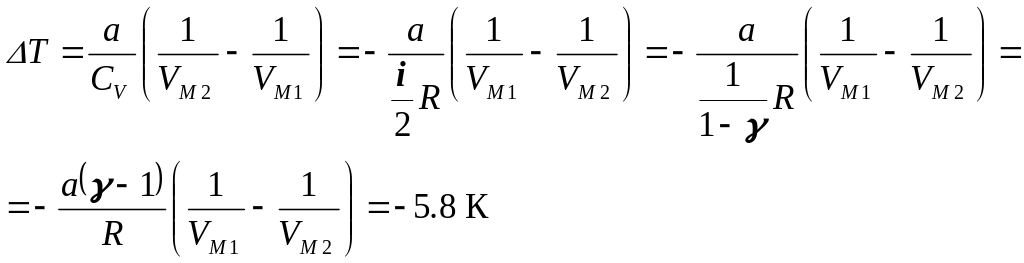
Таким чином, при розширенні моля азоту від 1,0 л до 10,0 л його температура понижується на 5,8 К.
18 Фази. Фазові перетворення
18.1 Означення фази. Агрегатні стани речовини. Рівновага фаз
Фаза – однорідна складова системи, відокремлена від інших границею розділу.
Приклади фаз: рідка, тверда, газоподібна. Так для речовини, що описується хімічною формулою Н2О, можливі фази: вода, лід, пара.
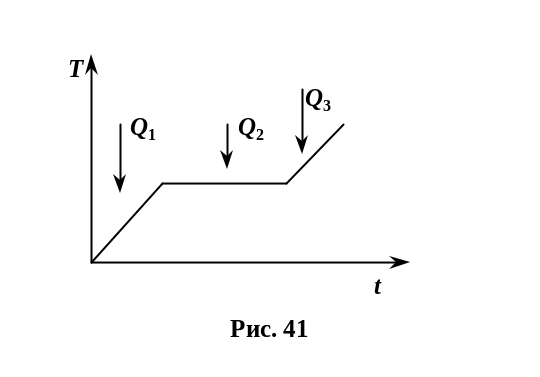

Рівновага 2-х фаз може мати місце лише в певному інтервалі температур. При чому кожному значенню Т відповідає цілком визначене значення Р, для якого можлива рівновага. Таким чином, рівновага двох фаз зображується на діаграмі Р(Т) у вигляді лінії (див. рис. 40). Ця залежність представляє собою фазову діаграму. При відсутності зовнішніх впливів (в тому числі підвода зовнішньої теплоти) дві фази при сталій температурі співіснують безмежно довго.
Три фази можуть співіснувати тільки при одній певній температурі і тиску в рівновазі. На діаграмі Р(Т) цьому стану відповідає точка, яка називається потрійною.
Чотири фази не можуть одночасно співіснувати в рівновазі, - обов’язково буде відбуватися розпад.
Перехід речовини з одної фази в іншу, що супроводжується виділенням або поглинанням теплоти, називається фазовим переходом першого роду.
Приклади: плавлення, кристалізація, випаровування.
При протіканні фазового переходу першого роду, незважаючи на підведення теплоти (Q2 на рис. 41), температура речовини залишається сталою в часі, поки він не закінчиться.
Фазові переходи другого роду відбуваються без виділення або поглинання теплоти; при цьому змінюється кристалічна гратка або якийсь параметр (наприклад, теплоємність, електро-, або теплопровідність). Процес вібувається скачком.
18.2 Рівняння Клапейрона-Клаузіуса
Фазові переходи (ФП) відбуваються в системі при підведенні певної кількості теплоти. При описі ФП пов’язують між собою p, T, V і кількість підведеної (поглинутої) теплоти.
Рівняння
Клапейрона-Клаузіуса визначає нахил
кривої фазової рівноваги р(Т).
Воно пов’язує
![]() ,
кількість підведеної теплоти Q12,
температуру фазового переходу T
і об’єм при рідкому V2
і твердому V1
агрегатних станах.
,
кількість підведеної теплоти Q12,
температуру фазового переходу T
і об’єм при рідкому V2
і твердому V1
агрегатних станах.
Для виведення формули, що зв’язує кількісно нахил кривої р(Т) фазової рівноваги з теплотою переходу та зміною об’єму при переході, припустимо, що з деякою кількістю речовини здійснюється “вузький” цикл Карно. Ізотермічними при цьому є процеси переходу речовини із фази 2 в фазу 1 при певному тиску р і зворотній перехід із фази 1 в фазу 2 при тиску p+dp. Тоді оскільки:

![]() ,
,
де dT - різниця температур на обох ізотермах.
З іншого боку:
![]() ,
,
де Q12 - теплота переходу із фази1 в фазу 2.
Значить:
![]() ,
,
або
![]() .
.
Звернемо увагу на те, що похідна обернено пропорційна різниці об’ємів. Поскільки зміна об’єму при випаровуванні є великою, а при плавленні малою, то криві плавлення ідуть більш круто. Так, для пониження температури кипіння води, достатньо зменшити тиск приблизно на 103 Па, а щоб змінити точку плавлення льоду треба збільшити тиск на 1,3107 Па.
