- •Розділ 1. Основи кристалографії
- •1.1. Будова речовини
- •1.2. Трансляційна симетрія кристалів. Кристалічна ґратка
- •1.3. Класифікація кристалічних структур
- •1.4. Кристалографічні позначення
- •1.5. Обернена ґратка
- •1.6. Дифракція хвиль та частинок у кристалі
- •1.7. Класифікація кристалів за типами зв’язку
- •1.8. Некристалічні тверді тіла та рідкі кристали
- •1.9. Дефекти у кристалах
- •1.9.1. Точкові дефекти
- •1.9.2. Лінійні дефекти
- •1.9.3. Поверхневі та об’ємні дефекти
1.9. Дефекти у кристалах
Утворення кристалічної фази речовини відбувається, як правило при охолодженні розплаву або парогазової фази, шляхом кристалізації з розчину. Формування “сусідів” і утворення зв’язків між ними відбувається випадковим чином. Тому, на відміну від ідеальних кристалів, що характеризуються правильним, строго впорядкованим розміщенням атомів, у реальних ця умова, строго кажучи, не виконується. Невиконання цієї умови приводить до спотворення ідеального порядку у розміщенні атомів і трактується як дефект. Залежно від вимірності області спотворення, розрізняють точкові, лінійні, дво- та тривимірні дефекти. Розглянемо основні їх характеристики.
1.9.1. Точкові дефекти
Під цією назвою об’єднується клас нульвимірних дефектів, пов’язаних з порушенням кристалічної ґратки внаслідок наявності зайвого та/або відсутності атома у вузлі. До точкових дефектів кристалічної ґратки відносяться вакансії, міжвузлові атоми та домішки.
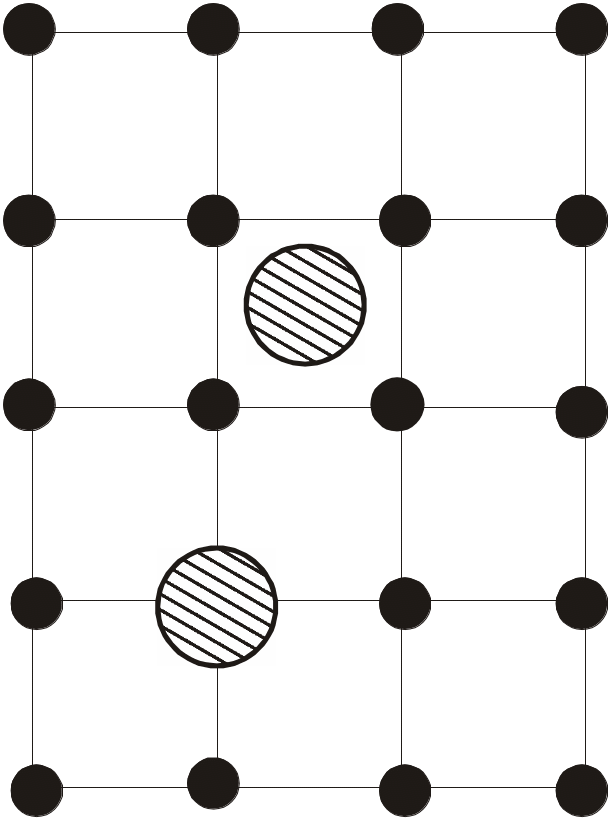
Домішки. Найбільш очевидним порушенням порядку у кристалі є наявність у ньому “чужих”, не властивих даній речовині атомів – домішок. Їх наявність пояснюється тим, що повністю очистити кристал від чужорідних атомів неможливо: навіть найбільш “чисті” кристали мають достатньо велику кількість домішок (1011 – 1012 см-3), тоді як “своїх” атомів приходиться 1022 – 1023 на 1 см3.
|
Рис. 1.14. Позиції заміщення (нижня) та впровадження (верхня) домішко-вого атома (заштри-хований) |
Домішкам належить вирішальна роль у багатьох властивостях кристала. Зокрема, вони є ефективними центрами розсіювання електронів, що обумовлює залишковий електричний опір при охолодженні металів до температур близько 0К. У напівпровідниках домішки відповідальні за появу додаткової, домішкової електропровідності.
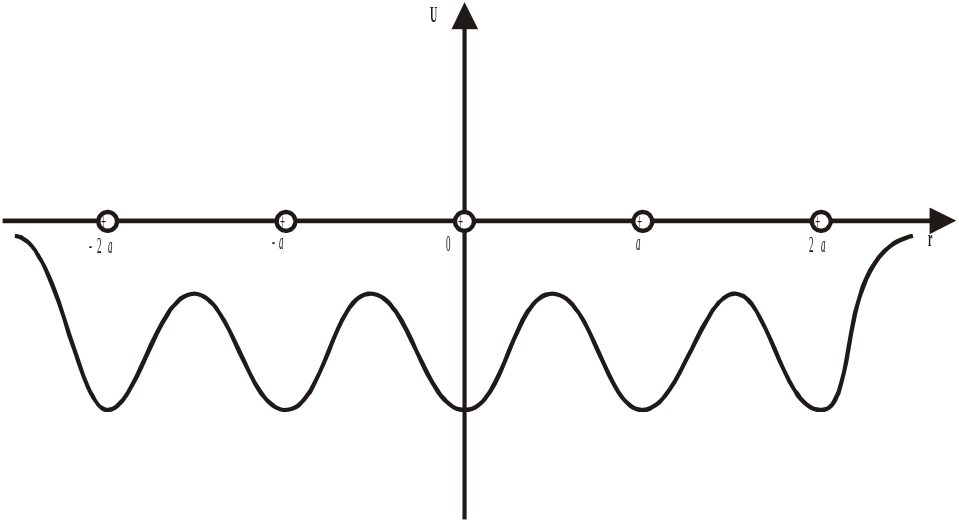
Дефекти за Френкелем. Потенціальна енергія взаємодії атомів у кристалічній ґратці
|
Рис. 1.15. Схематичне зображення графіка енергії взаємодії між атомами лінійного кристалу довжиною 4а |
ти вузли кристалічної ґратки. Радянський фізик Френкель вперше висловив припущення про те, що при відмінних від нуля температурах знайдеться певна кількість атомів, що володіють енергіями, достатніми для подолання
а) б) |
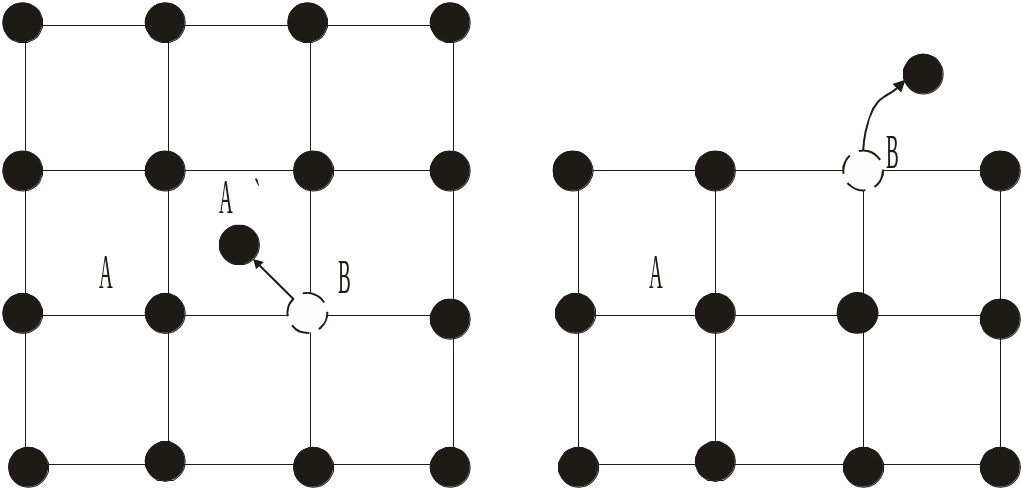
Рис. 1.16. Дефекти за Френкелем (а) та Шотткі (б) |
зайнятого атомом вузла (вакансії) і атома у міжвузлі (дислокованого атома) (рис. 1.16 а). Пара – вакансія і дислокований вузол називається дефектом за Френкелем.
Дефекти за Шотткі. Американський фізик Шотткі зауважив, що поряд з внутрішнім випаровуванням можливе випаровування атомів з поверхні кристала. При цьому у поверхневому шарі кристала утворюється вакансія (рис. 1.16 б). Шляхом заміщення атомами з глибших шарів вакансія втягується у кристал. Таким чином утворення вакансії не супроводжується одночасним утворенням дислокованих атомів. Вакансії такого типу називають дефектами за Шотткі.
Зростання температури супроводжується збільшенням кількості атомів, що мають енергію, достатню для подолання потенціального бар’єра (тобто розриву зв’язку з сусідніми атомами) і утворення дефекту. Відповідно до закону Больцмана, кількість таких атомів пропорційна exp(−U/kBT), де U – енергія утворення дефекту, kB – стала Больцмана. Як показують розрахунки, рівноважна кількість дефектів у кристалі, що містить N вузлів і N1 міжвузлових положень, визначається співвідношенням
![]() (1.17)
(1.17)
у випадку дефектів за Френкелем та
![]() (1.18)
(1.18)
у випадку дефектів за Шотткі; тут Uф і Uш – енергії утворення відповідного дефекту.
При утворенні дефекту за Френкелем атому, що переходить з вузла у міжвузля, необхідно не тільки розірвати зв'язок з сусідніми атомами, але і розсунути їх, впроваджуючись між ними. Це вимагає витрат значної енергії і може відбуватись практично тільки у кристалах, що складаються з атомів двох сортів, які відрізняються своїми розмірами, наприклад у іонних кристалах, твердих розчинах впровадження і т.п. У кристалах з щільною упаковкою однотипних атомів, наприклад у металах, дефекти за Френкелем практично не виникають; тут основними є дефекти за Шотткі.
Поряд з одиночними вакансіями (моновакансія), у кристалах за певних умов можуть виникати їх скопичення по дві (бівакансія) або й по три (тривакансія).
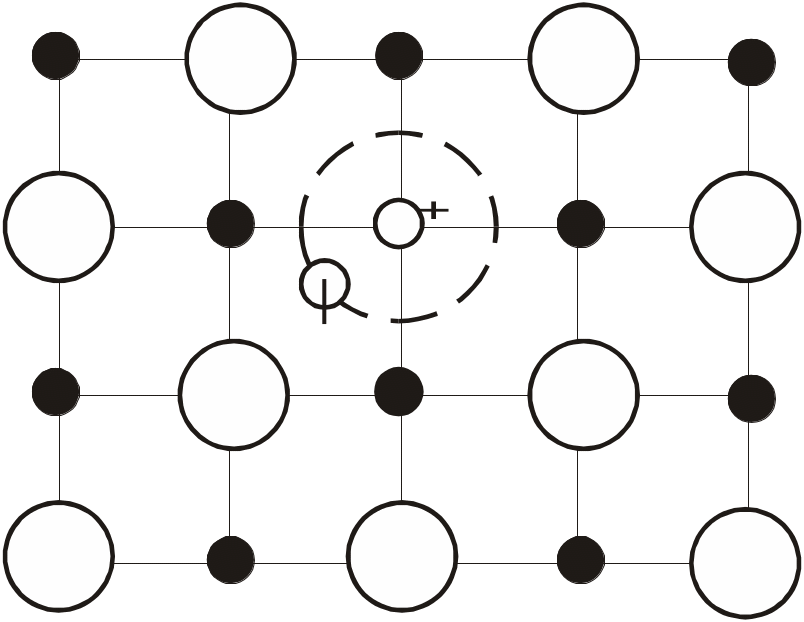
Центри забарвлення. Якщо прозорий кристал галоїдної сполуки, наприклад NaCl, нагрівати у парах Na, то він набуває характерного жовтого забарвлення. Кристали KCl, при нагріванні їх у парах K, стають червоними. Забарвлення обумовлене появою у цих кристалах особливих точкових дефектів – центрів забарвлення, які поглинають світло у видимій області спектра.
|
Рис. 1.17. Схематичне зображення F-центру у кристалі NaCl (чорний кружечок – атом Na, великий білий – Cl) УВАГА! Чіткіше намалювати плюс і мінус (не риска!) |
За наявності надлишку атомів галоїду (наприклад Cl) у кристалі утворюються катіонні вакансії, які можуть зв’язувати позитивний заряд, утворюючі також центри забарвлення, що називаються V-центрами.