
- •Розділ 1. Основи кристалографії
- •1.1. Будова речовини
- •1.2. Трансляційна симетрія кристалів. Кристалічна ґратка
- •1.3. Класифікація кристалічних структур
- •1.4. Кристалографічні позначення
- •1.5. Обернена ґратка
- •1.6. Дифракція хвиль та частинок у кристалі
- •1.7. Класифікація кристалів за типами зв’язку
- •1.8. Некристалічні тверді тіла та рідкі кристали
- •1.9. Дефекти у кристалах
- •1.9.1. Точкові дефекти
- •1.9.2. Лінійні дефекти
- •1.9.3. Поверхневі та об’ємні дефекти
1.7. Класифікація кристалів за типами зв’язку
Універсальність характеру взаємодії між структурними елементами кристалів (молекулами, атомами, іонами або їх групами) полягає у тому, що залежно від зміни відстані між ними вона проявляється у вигляді протягування або відштовхування. Саме такий характер мають сили пружності. Тому взаємодія, яка приводить до утворення зв’язків між структурними елементами кристалів, називається квазіпружною. Проте, попри згадану універсальність характеру сил зв’язку, очевидно існують відмінності їх утворення у різних кристалах. Саме цим пояснюються відмінності будови та фізичних властивостей різних речовин. Тому для розуміння природи фізичних явищ, що спостерігаються у твердих тілах, розглянемо коротко існуючі типи зв’язку у кристалах та їх класифікацію за цією ознакою.
Атомні (ковалентні) кристали. Один з найпоширеніших типів зв’язку у кристалічних твердих тілах – ковалентний, – має природу, однакову з причиною утворення молекул типу Н2, N2 і т.п. Послідовне пояснення такої взаємодії можливе на мові квантової механіки, а суть її розглянемо на найпростішому прикладі утворення молекули водню.
Як відомо з атомної фізики, водень має найпростішу будову серед усіх хімічних елементів. У рамках планетарної моделі його уявляють утворенням з пари елементарних частинок – протона (ядра атома) і електрона, який обертається по замкненій орбіті навколо ядра. Сила кулонівської взаємодії між цими різнойменно зарядженими частинками має характер сили притягання, а відцентрова сила, що діє на електрон внаслідок його руху по орбіті, – відштовхування. У стаціонарному стані атома радіус орбіти і швидкість руху співвідносяться так, що вказані сили урівноважують одна одну. Оскільки маса електрона мала (me = 9,1∙10-31 кг) порівняно з масою ядра (mp = 1,672∙10-27 кг), то для появи відцентрової сили, здатної урівноважити силу притягання, швидкість його руху повинна бути високою – понад 109 м/c. При малих (~1Å) розмірах орбіти це – надзвичайно високі швидкості, достатні для істотного прояву квантових властивостей частинки. Це означає, те, що по-перше, одночасне визначення положення електрона на орбіті та швидкості його руху можливе тільки з певною ймовірністю (принцип невизначеності Гайзенберга) та, по-друге, існує дискретна множина дозволених значень енергії та моменту кількості руху електрона по орбіті. Це приводить до необхідності існування множини дозволених стаціонарних станів атома, знаходячись у довільному з яких він характеризується певним розподілом ймовірностей знаходження електрона у точках простору. У випадку стаціонарного (з одним із дозволених значень енергії) стану це – рівномірний розподіл по замкненій поверхні, тобто у довільний момент часу ймовірність знаходження електрона у будь-якій точці поверхні (її називають електронною хмаринкою) однакова.
Пара атомів водню в основному стані з енергією Е0, віддалених на відстань, при якій сили взаємодії між електронами і ядрами одного і другого неістотні, може вважатись системою ізольованих атомів, сумарна енергія якої 2Е0. Розподіл густини ймовірності електронних станів такої системи має вигляд пари однакових замкнених поверхонь, кожна з яких охоплює одне з ядер (рис. 1.11 а). При наближенні атомів на відстані, сумірні розміру атома, сили притягання між електроном одного і ядром іншого атома зростають. Зростають також і сили відштовхування між ядрами та між електронами цих атомів. В результаті змінюється розподіл ймовірностей знаходження електронів у просторі – щільність розподілу (електронна густина) зростає у області підвищеної концентрації позитивного заряду – між ядрами (рис. 1.11 б). Вздовж прямої, що сполучає ядра, виникає сила притягання кожного з них до цієї області. Отже, між сусідніми ядрами атомів однакової валентності утворюється зв’язок (його називають ковалентним) внаслідок притягання кожним з них пари електронів – “свого” і “чужого”. При цьому енергія системи зменшується порівняно з 2Е0 на величину енергії дисоціації. Як результат, утворюється стійка структура – молекула водню Н2, навколо кожного з ядер якої рухається пара електронів (рис. 1.11 в).
|
Рис. 1.11. Зміна розподілу густини заряду електронної системи пари атомів водню при їх зближенні УВАГА! Бажано чіткіший рисунок і нумерація (зверху вниз): a, б, в |
Молекула водню не єдиний приклад реалізації ковалентного зв’язку. За цією ж схемою – колективізація електронів для заповнення зовнішньої оболонки, – зв’язані атомні залишки атомів у молекулах кисню О2, азоту N2 та інших. Ковалентний зв’язок встановлюється також між атомами вуглецю, германію або кремнію (елементи IV групи) при їх кристалізації. Зовнішня оболонка кожного з цих елементів, здатна вмістити вісім електронів, заповнена тільки наполовину. Зв’язок встановлюється шляхом колективізації валентних електронів атома з електронами чотирьох сусідніх атомів – по два на кожний із зв’язків (рис. 1.12). Характерною рисою ковалентного зв’язку є його сильна просторова спрямованість – кожний атом взаємодіє з сусідніми так, що зв’язки між ними утворюють тетраедричні кути. Будь-який атом у ґратці цього типу оточений чотирма найближчими сусідами, розміщеними у вершинах тетраедра (рис. 1.8). Аналогічно утворюються бінарні сполуки шляхом колективізації валентних електронів елементів II і VI, III і V груп, наприклад ZnS, CdS, CdTe, GaAs, GaP та інші, що кристалізуються у структуру цинкової обманки (рис. 1.8).
|
Рис. 1.12. Схематичне зображення ковалентних зв’язків у кристалі германію УВАГА! Бажано зменшити рисунок забезпечивши його чіткість |
![]() ,
,
де
![]() –
спіновий момент і-го
електрона (і
= 1,2), J(R)
– так званий обмінний
інтеграл – залежна від
відстані між ядрами R
функція, яка характеризує
силу взаємодії даних атомів (при цьому
J <
0, з чого випливає, що обмінна взаємодія
обумовлює притягання за умови
–
спіновий момент і-го
електрона (і
= 1,2), J(R)
– так званий обмінний
інтеграл – залежна від
відстані між ядрами R
функція, яка характеризує
силу взаємодії даних атомів (при цьому
J <
0, з чого випливає, що обмінна взаємодія
обумовлює притягання за умови
![]() ).
).
Впорядковане розташування атомів у вузлах ґратки відповідає мінімуму енергії їх взаємодії. Довільне порушення рівноважного (впорядкованого) розміщення атомів збільшує внутрішню енергію кристалу. Величина приросту внутрішньої енергії внаслідок розриву одного зв’язку між атомами (енергія зв’язку) у ковалентних кристалах велика – близько 10 еВ. Наприклад, для алмазу вона становить величину 7,3 еВ. Тому ковалентним кристалам властиві високі температури плавлення, висока твердість, проте на відміну від інших кристалів вони крихкі. Питомий опір їх непостійний, чутливий до наявності домішок та зміни температури – малий (як у металах) при високих температурах. Оптичні властивості характеризуються великим показником заломлення і великою діелектричною проникністю. Ці кристали прозорі для довгохвильового випромінювання і непрозорі для більш коротких хвиль. Перехід від області прозорості до області сильного поглинання різкий, здійснюється на характерній для даного кристала довжині хвилі λ0 (видимого або інфрачервоного діапазону).
Іонні кристали. Хімічні елементи восьмої групи таблиці Менделєєва – інертні гази мають таку назву оскільки атоми цього типу не взаємодіють з іншими так, щоби між ними утворився стійкий зв’язок. Тому за звичайних умов відповідні речовини (аргон, криптон і т. д.) існують у газоподібному стані. Подібну властивість має і гелій. Атоми усіх цих речовин мають одну спільну, тільки їм властиву рису – повністю заповнені електронні оболонки. Енергії збудження та іонізації названих атомів найбільші серед усіх інших хімічних елементів. Це означає, що атоми з повністю заповненими оболонками володіють найбільш стійкою структурою, змінити стан руху електронів в них дуже важко.
Атоми лужних металів, електронна структура яких близька до структури елементів восьмої групи (один електрон понад повністю заповнені внутрішні оболонки), навпаки характеризуються найменшою серед усіх інших елементів енергіями збудження та іонізації. Це означає, що валентний електрон, екранований від ядра електронами заповнених внутрішніх оболонок, легко змінює стан свого руху – переходить з орбіти на орбіту або відривається від атомного залишку під дією зовнішніх чинників. Атомний залишок іонізованого лужного елемента має структуру електронної оболонки сусіднього з ним елемента восьмої групи.
Так само й елементи сьомої групи (галоїди) легко змінюють свою електронну структуру, захоплюючи ззовні один електрон. При цьому утворюється негативно заряджений іон, з повністю заповненими електронними оболонками – переходить у стійкий стан, характерний атомам інертних газів.
При наближені атомів лужних металів до атомів елементів галоїдної групи на відстані, сумірні їх розмірам, електрони і ядра кожного з них починають взаємодіяти з електронами і ядрами сусіднього атома. Між ними виникає взаємодія, яка полягає в тому, що атоми перезаряджаються – електрон зовнішньої оболонки атома металу захоплюється атомом галоїду. В результаті вони стають різнойменно зарядженими іонами і притягуються згідно із законом Кулона.
У твердих тілах, що складаються з атомів такого типу (NaCl, КCl і т.п.) аніони і катіони не можна вважати жорсткими кульками: дослідні дані стверджують, що відстань R між іонами у кристалі менша, ніж сума радіусів атомів. Це означає, що електронні оболонки іонів у таких кристалах перекриваються, а зв'язок між ними виникає внаслідок електростатичної кулонівської взаємодії, потенціал якої
![]() (1.10)
(1.10)
(тут αМ – стала Маделунга, – константа, значення якої залежить від типу кристалічної ґратки).
Потенціал результуючої взаємодії визначається сумою цих двох функцій і має чіткий мінімум, що відповідає рівноважній відстані між атомами R0 (рис 1.1 б). Це означає, що між атомами встановлюється зв'язок, наявність якого забезпечує утворення кристалічної ґратки. Зв’язок такого типу називається іонним або гетерополярним, а кристали з зв’язком такого типу – іонними.
Енергія іонного зв’язку – величина порядку 10 еВ. Електронна конфігурація іонів практично збігається структурою атомів інертного газу, отже розподіл заряду поблизу кожного з них сферично-симетричний. Відповідно для іонних кристалів характерні щільно упаковані ґратки, з яких найбільш типовими є кубічні типу NaCl. Тверді тіла з іонним зв’язком характеризуються значною міцністю і твердістю, мають високі температури плавлення (у NaCl Тпл = 800 °C) та великі теплоти сублімації. Вони володіють електропровідністю іонного типу, високим питомим опором, типовим для добрих ізоляторів, великою діелектричною проникністю, невеликими показниками заломлення. Більшість з них прозорі у видимій області.
Молекулярні кристали. Найбільш загальним типом зв’язку, що виникає між довільними атомами чи молекулами є так званий молекулярний або зв'язок Ван-дер-Ваальса (запропонований Ван-дер-Ваальсом для пояснення взаємодії молекул реального газу). У майже чистому вигляді такий зв'язок проявляється між молекулами з ковалентними хімічними зв’язками (O2, H2, N2, CH4 і т. п.), а також між атомами інертних газів. Енергія зв’язку цього типу мала, значення її складає величину близько 0,1 еВ. Тому кристали з таким типом зв’язку (їх називають молекулярними) є малостійкими, летючими і мають низькі температури плавлення. Усі вони – діелектрики; більшість з них прозорі для електромагнітного випромінювання аж до далекої ультрафіолетової області спектра. Заповнені електронні оболонки атомів (насичені зв’язки молекул) сприяють утворенню щільно упакованої структури, наприклад, ГЦК у випадку кристалів інертних газів.
Зв'язок Ван-дер-Ваальса встановлюється внаслідок однієї з трьох можливих взаємодій: орієнтаційної, індукційної або дисперсійної.
Орієнтаційна
взаємодія виникає
між полярними молекулами, які володіють
постійним електричним дипольним моментом
![]() ,
такими наприклад, як Н2О
. Між ними виникає електростатична
взаємодія, яка проявляється у появі сил
притягання і приводить до впорядкованого
розташування диполів – систем, що
володіють ненульовим дипольним моментом,
– (рис. 1.13), при якому енергія системи
молекул мінімальна. Потенціал орієнтаційної
взаємодії притягання, як функція відстані
R між
ядрами
,
такими наприклад, як Н2О
. Між ними виникає електростатична
взаємодія, яка проявляється у появі сил
притягання і приводить до впорядкованого
розташування диполів – систем, що
володіють ненульовим дипольним моментом,
– (рис. 1.13), при якому енергія системи
молекул мінімальна. Потенціал орієнтаційної
взаємодії притягання, як функція відстані
R між
ядрами
|
Рис. 1.13. Ілюстрація впорядкування полярних молекул УВАГА! Має бути чітко показано позитивний (+) і негативний (–) полюси! Бажано зменшити! |
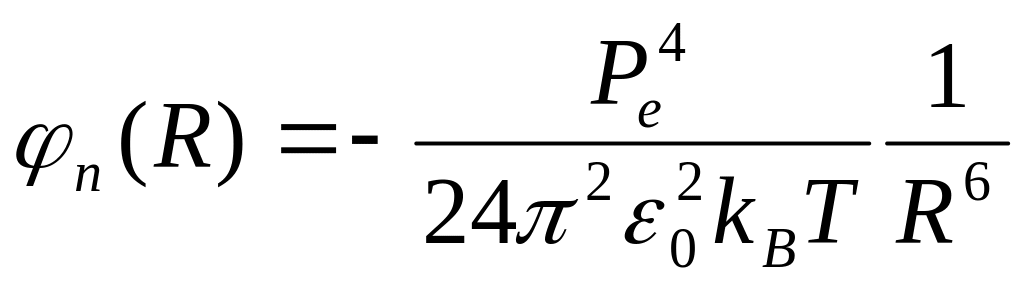 ,
(1.11)
,
(1.11)
виявляється залежним від температури кристала Т – її зростання приводить до збільшення інтенсивності теплового руху і, як наслідок, зникнення впорядкованого розміщення диполів.
Індукційна взаємодія виникає між молекулою-диполем та неполярною молекулою, здатною легко поляризуватися (набувати індукованого дипольного моменту у зовнішньому електричному полі). У результаті наближення таких молекул на малі відстані між ними, як показав Дебай, виникає взаємодія притягання, потенціал якої
 ,
(1.12)
,
(1.12)
де α - ступінь поляризації молекули.
Дисперсійна взаємодія виникає між атомами або неполярними молекулами внаслідок взаємної поляризації їх електронних оболонок. Це пояснюється тим, що, хоч у кожного атома постійний дипольний момент відсутній, вони можуть набувати миттєвого флуктуаційного дипольного моменту, який визначається миттєвим положенням електронів на орбітах. Він може індукувати появу миттєвого дипольного моменту у сусіднього атома, що призведе до їх притягання. Таку взаємодію розглянуто вперше Лондоном з квантово-механічної точки зору. Згідно висновків квантової теорії, потенціал взаємодії притягання описується формулою
![]() ,
(1.13)
,
(1.13)
де I - енергія збудження, значення якої залежить від типу атомів, що взаємодіють.
Як видно, потенціали (1.11 - 13) можна подати у вигляді φ(R) = C/R6, де С – відповідна стала.
Крім сил притягання існують і сили відштовхування між атомами або молекулами внаслідок взаємного відштовхування зовнішніх електронних оболонок. Потенціал такої взаємодії – стрімко спадна функція відстані між ядрами; для іонних кристалів вона описується потенціалом Борна – Майєра
![]() ,
(1.14)
,
(1.14)
у молекулярних – степеневої функцією
![]() (1.15)
(1.15)
де А і b – емпіричні константи, n ≈ 12.
Повний потенціал, що описує наявність сил притягання і відштовхування, є сумою φп(R) та φв(R). Для молекулярних кристалів його подають у вигляді потенціалу Леннарда – Джонса
![]() ,
(1.16)
,
(1.16)
де φ0 та σ – константи, значення яких визначається властивостями кристалу.
Знаючи аналітичний вигляд потенціалу взаємодії атомів (молекул) у кристалі, можна розрахувати його механічні характеристики такі наприклад, як стисливість та коефіцієнт теплового розширення.
Метали. Більше половини елементів таблиці Мендєлєєва належить до класу металів. Об’єднуючою рисою цих елементів є те, що зовнішня оболонка кожного з них заповнена менше, ніж наполовину і екранована від ядра електронами внутрішніх оболонок завдяки чому валентні електрони відносно слабко зв’язані з атомним залишком. Тому, подібно до лужних елементів, вони легко утворюють зв’язки іонного типу з іншими атомами, здатними прийняти валентний електрон до своєї оболонки. Відмінність полягає у тому, що зовнішня оболонка металів може містити більшу, ніж у лужних, кількість електронів.
При наближенні на малі відстані атомів металу, їх валентні електрони взаємно відштовхуються, у результаті чого вони можуть залишити свої орбіти і рухатись у полі усіх, а не одного, ядер – колективізуються. Оскільки ядра екрановані внутрішніми електронними оболонками, то вплив кожного з них на колективізовані електрони слабкий. Внаслідок цього вони набувають здатності майже вільно рухатись у полі, створеному усіма (однаковими) позитивно зарядженими іонами – атомними залишками. Обмежуюча дія поля полягає у тому, що колективізовані електрони не можуть подолати сили притягання до усієї сукупності атомних залишків і тому можуть рухатись тільки між ними. Це приводить до того, що електрони рівномірно заповнюють зайнятий атомами простір і створюють рівномірно розподілене сумарне поле негативного заряду. Кожний з атомних залишків знаходяться під дією двох чинників – відштовхується рештою позитивно зарядженими іонами і притягується усією сукупністю колективізованих електронів. У результаті атомні залишки атомів металу розташовуються у точках простору, де результуюча сил відштовхування і притягання дорівнює нулю. Оскільки усі вони однакові, то і точки їх знаходження повинні бути еквівалентні. Це можливе за умови, що атомні залишки – позитивно заряджені іони розміщуються у вузлах кристалічної ґратки. Для виходу з положення рівноваги кожному з них потрібно подолати опір з боку сукупності усіх електронів та решти іонів ґратки. Це означає, що атомні залишки знаходяться у зв’язаному стані, а зв’язок між ними здійснюється через систему колективізованих електронів. Зв’язок такого типу називається металевим.
Відсутність просторової спрямованості металевого зв’язку пояснюється висока пластичність металів, що дозволяє зміщення одних частин кристалічної ґратки відносно інших без руйнування кристалу. Це дозволяє надавати їм необхідної форми шляхом кування. Наявність великої кількості (~ 1023 см-3) вільних носіїв заряду – електронів обумовлює їх здатність добре проводити електричний струм і тепло. Висока електропровідність забезпечує великі значення коефіцієнтів поглинання та відбивання світла. Енергія зв’язку у металах становить величину від 1 до 5 еВ, що обумовлює низькі значення температур плавлення і кипіння (Na плавиться при 100 °С). Найбільші температури плавлення та кипіння у так званих тугоплавких металів –кристалів, утворених з елементів перехідних груп (вольфрам, молібден та ін.). Для елементів перехідних груп характерна наявність просторово протяжних d-оболонок, які, взаємодіючи з d-оболонками сусідніх атомів, утворюють ковалентні зв’язки додатково до металевого. Це сильно збільшує енергію зв’язку таких кристалів.



