
- •1. Предмет коллоидной химии. Почему поверхностные явления и дисперсные системы изучают в рамках одной дисциплины -коллоидной химии? Значение коллоидной химии для технологии.
- •2. Признаки объектов коллоидной химии: гетерогенность и дисперсность.
- •3. Классификация дисперсных систем по размерам частиц дисперсной фазы.
- •6. Классификация дисперсных систем по взаимодействию частиц дисперсной фазы.
- •7. Классификация поверхностных явлений.
- •9. Поверхностное натяжение, его определения и размерности.
- •10. Метод избыточных величин Гиббса. Вывод фундаментального уравнения Гиббса для свободной энергии системы с плоской границей раздела фаз.
- •11. Вывод фундаментального уравнения Гиббса для свободной энергии плоского поверхностного слоя, его анализ.
- •12. Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •13. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ.
- •14. Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •15. Сталагмометрический и тензиометрический методы исследования поверхностного натяжения.
- •16. Переход от изотермы поверхностного натяжения к изотерме адсорбции графическим методом, расчет величины Гмах с помощью уравнения Ленгмюра.
- •17. Влияние на адсорбцию на границе раствор-газ строения и размера молекул пав. Правило Траубе, его аналитическое выражение и физическое обоснование.
- •1 8. Уравнение Шишковского, связь с его помощью уравнений Ленгмюра и Гиббса.
- •20. Строение адсорбционных пленок на жидкой поверхности. Диаграммы строения поверхностных пленок.
- •21. Вывод уравнения состояния двухмерного газа. Уравнение Фрумкина для реального двухмерного газа.
- •22. Адсорбция на границе твердое тело-газ. Теория мономолекулярной адсорбции Ленгмюра. Вывод и анализ уравнения изотермы мономолекулярной адсорбции Ленгмюра.
- •23. Линейная форма уравнения Ленгмюра. Нахождение констант уравнения Ленгмюра графическим методом. Определение удельной поверхности адсорбента.
- •24. Адсорбция как обратимый экзотермический процесс. Интегральная и дифференци-альная теплота адсорбции.
- •25. Сравнительная характеристика физической адсорбции и хемосорбции.
- •26. Кривые потенциальной энергии для физической адсорбции и хемосорбции.
- •27. Природа адсорбционных сил. Уравнение Леннарда-Джонса.
- •28. Теория полимолекулярной адсорбции бэт, предпосылки теории. Уравнение изотермы адсорбции бэт, его анализ.
- •29. Линейная форма уравнения бэт. Нахождение констант уравнения бэт графическим методом. Определение удельной поверхности адсорбента.
- •30. Кинетика адсорбции. Динамическое уравнение адсорбции. Уравнение Френкеля. Кинетические кривые адсорбции при разных температурах.
- •31. Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •32. Когезия и адгезия. Характер разрушения адгезионного соединения. Условие адгезионного разрушения. Уравнение Дюпре для работы адгезии.
- •33. Условие растекания жидкостей. Коэффициент растекания по Гаркинсу. Эффект Марангони.
- •34. Связь адгезии и смачивания. Вывод уравнения Дюпре-Юнга, его анализ.
- •35. Межфазное натяжение на границе между взаимно насыщенными жидкостями. Правило Антонова.
- •36. Адсорбция на границе раздела твердое тело-раствор. Обращение правила Траубе при адсорбции из водных и углеводородных растворов. Правило уравнивания полярностей Ребиндера.
- •37. Ионная адсорбция. Влияние радиуса и валентности иона на величину адсорбции.
- •38. Классификация пав по химическому строению.
- •39. Коллоидные поверхностно-активные вещества. Мицеллообразование, строение мицелл в водной и углеводородной среде.
- •40. Две модели мицеллообразования.
- •41. Термодинамика образования прямых и обратных мицелл.
- •42. Критическая концентрация мицеллообразования (ккм). Методы определения ккм в полярных и неполярных средах. Влияние различных факторов на величину ккм в полярных и неполярных средах.
- •43. Солюбилизация в растворах мицеллообразующих пав. Механизмы солюбилизации в мицеллах пав. Влияние различных факторов на солюбилизацию.
- •44. Влияние температуры на растворимость ионогенных пав. Диаграммы состояния системы. Точка Крафта.
- •45. Влияние температуры на растворимость неионогенных пав. Точка помутнения и точка высаливания.
- •46. Полиморфные превращения мицелл коллоидных пав. Лиотропные жидкие кристаллы.
- •47. Количественные характеристики свойств пав, Числа глб. Расчет чисел глб по методу Дэвиса.
- •48. Методы диспергирования. Уравнение Ребиндера для работы измельчения.
- •49. Адсорбционное понижение прочности(эффект Ребиндера). Прочность как поверхностное свойство материалов.
- •50. Конденсационное образование лиофобных дисперсных систем. Термодинамические основы гомогенного зародышеобразования. Уравнение для работы образования критического зародыша.
- •51. Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов.
- •52. Гетерогенная конденсация.
- •53. Причины построения мицелл ионностабилизованных золей. Привести примеры.
- •54. Пептизация как физико-химический метод получения коллоидных систем. Механизмы пептизации. Правило осадков Оствальда.
- •55. Получение лиофильных коллоидных систем путем самопроизвольного диспергирования. Вывод уравнения Ребиндера-Щукина.
- •56. Броуновское движение, его причины и общенаучное значение.
- •57. Соотношение между средне квадратичным сдвигом и коэффициентом диффузии. Вывод уравнения Эйншнеина-Смолуховского.
- •58. Понятие о диффузии. Первый и второй законы Фика. Физический смысл коэффициента диффузии, его размерность.
- •59. Диффузионно-седиментационное равновесие. Вывод гипсометрического закона.
- •61. Интегральные и дифференциальные кривые распределения частиц полидисперсных систем по размерам.
- •62. Седиментация в центробежном поле. Определение массы частиц методом скоростного ультрацентрифугирования.
- •67. Виды рэлеевского рассеяния света и его условия. Физическая сущность рассеяния света.
- •68. Индикатрисы рассеяния поляризованного и неполяризованного света большими и малыми частями.
- •69. Уравнение Рэлея, условия его применения анализ.
- •70.Оптические методы исследования дисперсных систем. Нефелометрия. Схема нефелометра. Определение размера коллоидных частиц методом нефелометрии.
- •71. Определение размера коллоидных частиц методом турбодиметрии.
- •72. Микроскопия. Предел разрешения светового и электронного микроскопов. Формирование изображения в световом и электронном микроскопе.
- •73. Принцип темнопольной микроскопии. Щелевой ультрамикроскоп, конденсор темного поля. Определение численной концентрации и размера коллоидных частиц.
- •74. Поглощение света дисперсными системами. Уравнение Бугера-Ламберта-Бера для истинных растворов. Чему равны оптическая плотность, мутность и светопропускание растворов?
- •75. Фиктивная абсорбция света в коллоидных системах.
- •76. Причины и механизмы возникновения заряда на поверхности частиц.
- •77. Связь электрического потенциала с поверхностным натяжением. Вывод уравнения Липмана, его анализ.
- •78. Электрокинетические явления, их классификация по причинно-следственной связи и по объектам исследования.
- •7 9. Строение двойного электрического слоя(дэс). Количественная модель Гуи-Чепмена.
- •80. Модель Штерна(внутренняя часть дэс).
- •1) Изоэлектрическая точка возникает при полной помперсации заряда поверхности
- •82. Действие неиндеферентного электролита на дэс.
- •83. Влияние разбавления, температуры и неиндеферентного электролита на дэс.
- •84. Вывод формулы Гельмгольца-Смолуховского для определения величины электрокинетического потенциала по данным электроосмоса или электрофореза.
- •85. Агрегативная и седиментационная устойчивость коллоидных систем. Стабилизаторы, и их роль в придании коллоидной системе временной агрегативной устойчивости.
- •86. Факторы устойчивости коллоидных систем.
- •88. Зависимость скорости коагуляции от концентрации электролита, быстрая и медленная коагуляция.
- •89. Кривые потенциальной энергии для систем с различной степенью агрегативной устойчивости.
- •90. Кинетика коагуляции по Смолуховскому. Вывод уравнения для концентрации частиц через время коагуляции τ. Константы скорости быстрой и медленной коагуляции.
- •91. Правила коагуляции электролитами с точки зрения строения дэс.
- •92. Концентрационная и нейтрализационная коагуляция.
- •93. Расклинивающее давление, его компоненты.
- •94. Идеальные модели реологии. Модели Гука, Ньютона, Сен-Венана-Кулона.
- •95. Принципы моделирования реологических свойств. Модель упругого тела Максвелла, Вывод уравнения, являющегося его математической моделью.
- •96. Модель вязкопластического тела Бингама. Пластическая вязкость.
- •97. Причина неподчинения дисперсных систем закону Ньютона. Кривые течения реальных дисперсных систем. Уравнение Оствальда – Вейля.
- •98. Вязкость жидкообразных агрегативно устойчивых дисперсных систем. Уравнение Эйнштейна. Причины неподчинения коллоидных систем уравнению Эйнштейна.
- •99. Зависимость вязкости дисперсных систем от напряжения сдвига.
- •100. Механизмы гибкости полимерной цепи: поворотно-изомерных и персистентный.
- •101. Размеры и форма макромолекул в растворе. Свойства гауссова клубка.
- •102. Термодинамическое сродство полимера к растворителю. Количественные критерии его характеризующие.
- •103. Набухание как первая стадия растворения полимеров. Причины органического набухания полимеров.
- •104. Термодинамика набухания и растворения.
- •106. Межмолекулярные и внутримолекулярные взаимодействия в растворах полимеров. Температура Флори(θ).
- •108. Термодинамическая равновесность растворов полимеров. Фазовая диаграмма раствора полимера.
28. Теория полимолекулярной адсорбции бэт, предпосылки теории. Уравнение изотермы адсорбции бэт, его анализ.
БЭТ(Брунауэр, Эммет, Теллер).
А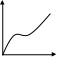 Предпосылки: 1)на поверхности
адсорбента имеется определенное число
активных
Предпосылки: 1)на поверхности
адсорбента имеется определенное число
активных
центров 2)пренебрегаем взаимодействием между соседними молекулами в
адсорбционном слое 3)каждая молекула1-ого слоя представляет собой возможный
центр для адсорбции и образования 2-ого слоя 4)предполагается что все молекулы
2-ого и всех последующих слоев имеют такую же Σ статистических состояний, как в
Р/Рs в жидком и отличаются от состояния 1-ого слоя.
Авторы рассматривали адсорбцию как серию квазистатических реакций образования единичных комплекс. Молекула газа+активный центр→единичный комплекс;
молекула газа+ единичный комплекс→двойной комплекс и тд. Q1>Q последующих слоев.
![]() ;
с=КРS- const
полимолекулярной адсорбции. КL-
const объемной конденсации.
Уравнение БЭТ:
;
с=КРS- const
полимолекулярной адсорбции. КL-
const объемной конденсации.
Уравнение БЭТ:![]() PS-давление
насыщенного пара, P/PS-относительное
давление пара.
PS-давление
насыщенного пара, P/PS-относительное
давление пара.
![]()
29. Линейная форма уравнения бэт. Нахождение констант уравнения бэт графическим методом. Определение удельной поверхности адсорбента.
переворачиваем и умножаем обе стороны
у-ния на величину P/PS.
![]() /(1-Р/РS)
/(1-Р/РS)
![]()

P/PS/(A(1-P/PS) tgα=C-1/АмахС решая систему уравнений определяем
Амах и С.
Α Sуд=АмахS0Na
P/PS
30. Кинетика адсорбции. Динамическое уравнение адсорбции. Уравнение Френкеля. Кинетические кривые адсорбции при разных температурах.
Динамическое уравнение: А=nτ, n-число контактов молекул, τ-время установления адсорбционного равновесия, зависит от температуры и количества выделившегося тепла. Френкель: τ= τ0еQa/RT, τ0-const равная периоду колебаний атомов в решетке адсорбента
τ0=10-13с. скорость адсорбции определяется скоростью диффузии адсорбтива к адсорбенту
Кинетические кривые при разных температурах.
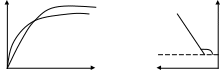 А Т1
ln(Aр-А
τ) dA/d
τ=K(Ap-Aτ)
1порядок
А Т1
ln(Aр-А
τ) dA/d
τ=K(Ap-Aτ)
1порядок
Т2 -ln(Ap-Aτ)=Kτ+const
Τ=0 Aτ=0 constинт=-lnAp
T1<T2 K=tg(180-α) ln(Ap-Aτ)=Rτ+lnAp
α
τ τ
