
- •Донецьк 2004
- •Лабораторна робота 1.
- •Завдання.
- •Характеристика будови мікроскопа.
- •Спроможна здібність мікроскопа.
- •Техніка мікроскопії об’єктів.
- •Контрольні питання.
- •Лабораторна робота 2 .
- •Морфологія бактерій. Приготування бактеріальних
- •Препаратів і методи фарбування бактерій.
- •Завдання.
- •Методика приготування препарату.
- •Просте забарвлення мікроорганізмів.
- •Складне забарвлення препарату за методом Грама.
- •Контрольні питання.
- •Контрольні питання.
- •Види дезінфікуючих речовин:
- •Контрольні питання.
- •Лабораторна робота 5. Морфологія актиноміцетів, пліснявих грибів, дріжджів. Завдання:
- •Приготування препарату.
- •Контрольні питання.
- •Вплив фітонцидів.
- •Вплив антибіотиків.
- •Етап і.
- •Етап іі.
- •Контрольні питання.
- •Хід роботи.
- •Мікробіологічне дослідження повітря.
- •Посів мікрофлори повітря методом осідання Коха.
- •Підрахунок мікрофлори повітря.
- •60 Колоній виросло на площі 78,6 см2,
- •76 Мікроорганізмів знаходиться в 10 л,
- •Посів мікрофлори повітря прибором Кротова.
- •Методи кількісного обліку мікроорганізмів.
- •Методика обліку мікроорганізмів в чашках Петрі за допомогою камери Вольфюгеля.
- •Контрольні запитання
- •Лабораторна робота 8. Вивчення елективних культур. Завдання.
- •Виділення елективної культури молочнокислих бактерій.
- •Виділення елективної культури маслянокислих бактерій.
- •Виділення елективної культури оцтовокислих бактерій.
- •Виділення елективної культури протею.
- •Виділення елективної культури картопляної палички.
- •Виділення елективної культури сінної палички.
- •Контрольні запитання.
- •Посів мікрофлори м'яса, ковбас, круп, борошна, цукру, солі, хліба, цукерок та інших плотних харчових продуктів.
- •Контрольні запитання.
- •Література
- •Підписано до друку Формат 60х841/16
Просте забарвлення мікроорганізмів.
Просте забарвлення організмів складається з трьох етапів: приготування мазка та його висушування, фіксація мазка, фарбування.
Приготування мазка. Беруть невелику краплю досліджуваної рідини та мікробіологічною петлею розподіляють її рівномірно тонким шаром по всій поверхні предметного скла. Мазок висушується при кімнатній температурі або на невеликій відстані від полум’я пальника.
Фіксація. Після висушування препарату переходять до його фіксації. Фіксацією вбивають мікробів, що забезпечує їх краще прилипання до скла та зберігання препарату. Фіксація дозволяє зробити мазок сприятливим до забарвлення (мертва протоплазма краще забарвлюється, ніж жива).
Для фіксації мазка застосовується висока температура. При проведенні цієї операції підготовлений препарат (предметне скло) охоплюють великим та вказівним пальцями і 3 – 4 рази проводять над полум’ям пальника. Цей засіб використовується, коли потрібно вивчити будову бактеріальної клітини. Крім цього, користують хімічні фактори: етиловий спирт, формалін, осмієву кислоту.
Забарвлення препарату. Фіксуючий препарат пінцетом Корне обробляють розчином фарби (водяним розчином). Фарбування триває 2 хвилини, потім фарбу змивають струменем води. В мікробіологічній практиці користуються як основними, так і кислими барвниками. До основних барвників (ядерних) відносять: нейтральот, фуксин, генціан-віолет, метиленова синь, малахітова зелень. До кислих – кислий фуксин, елитрозин, конго. Після приготування зафарбованого препарату його розглядають і вивчають під великим збільшенням з використанням масляної імерсії.
Складне забарвлення препарату за методом Грама.
Цей метод забарвлення використовується як діагностичний при визначенні виду бактерій. Він надає змогу виявити грампозитивні (які фарбуються по Граму) та грамнегативні бактерії (які не сприймають забарвлення по Граму).
Для забарвлення по Граму беруть молоді 1 – 2 добові культури або зубний наліт. Мазок готується на предметному склі.
Забарвлення складається з таких етапів:
Приготування мазка, його сушка та фіксація;
Забарвлення генціан-віолетом (тривалість забарвлення 2 хвилини);
Обробка розчином Люголя (тривалість обробки 2 хвилини);
Обробка 95 %-ним розчином спирту (тривалість обробки 0,5 хвилин), промивка водою;
Додаткове забарвлення фуксином (тривалість забарвлення 2 хвилини), промивка водою, сушка, мікроскопія.
До грампозитивних відносять – коки, стрептококи, стафілококи, сінна та картопляна палички та інші.
До грамнегативних - протей, спірили, спірохети, шлункова паличка та інші.
На рисунку 2 представлені форми мікроорганізмів, які можна роздивитися під час вивчення їх під мікроскопом.
На рисунках 3,4 зображені капсули бактерій та розташування джгутиків – органів руху.
Контрольні питання.
Які мікробіологічні препарати дозволяють вивчати мікроорганізми у живому виді?
З яких етапів складається процес приготування фіксованого препарату?
Які Ви знаєте засоби забарвлення мікроорганізмів?
В чому полягає суттєвість забарвлення мікроорганізмів по Граму та його послідовність?
Які Вам відомі форми клітин бактерій?
Які угрупування характерні для кулястих мікроорганізмів, як вони називаються за цими ознаками?
Які бактерії утворюють спори? Яке значення мають бактеріальні спори та які властивості їм притаманні?
Рис.2.
Форми
бактерій
Кулясті:
Паличковидні:
Звиті:
1-мікрококі
6-палички без спор
8- вібріони
2-стрептококі
7-палички зі спорами
9-спирілли,
3-діплококі
і тетракокі 10-спірохети
4-стафілококі
5-сарцини

В
А
Б
Р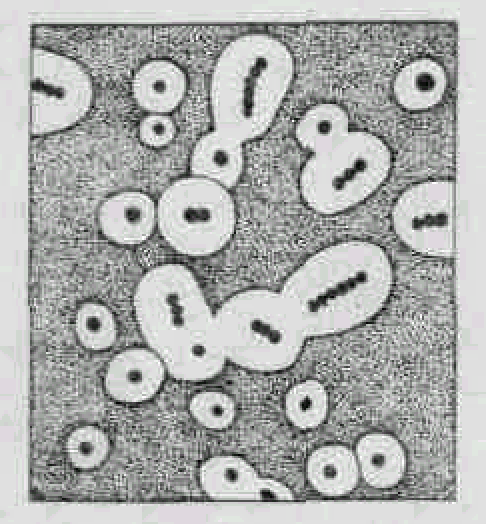 ис.3.
Капсули бактерій Рис.4. Розташування
жгутиків:
ис.3.
Капсули бактерій Рис.4. Розташування
жгутиків:
А – монотрихи;
Б – лофотрихи;
В – перитрихи
Лабораторна робота 3.
Потреби мікроорганізмів в поживних речовинах
Поживні середовища для вирощування мікроорганізмів.
Завдання
Ознайомитись з класифікацією поживних середовищ.
Ознайомитись з технікою приготування основних поживних середовищ (м’ясо-пептонний бульйон - МПБ, м’ясо-пептонний агар - МПА, сусло агар СА)
Мікроорганізмам, як і усім іншим організмам, потрібен набір різноманітних хімічних елементів. Деякі елементи (С, Н, Р, 0, 8, Са, Мg, К, Ре) потрібні у відносно великих кількостях, тому їх відносять до макроелементів, інших (Zn, Мn, Со, No, В, Си, I) - достатньо наявності слідів, тому їх називають мікроелементами. Крім цього, мікроорганізмам потрібні деякі готові органічні сполучення, які називають факторами зростання.
Виходячи з поживних потреб мікроорганізмів для їх вирощування в лабораторних умовах створюють живильні (культурні) середовища, що містять набір органічних та мінеральних речовин, які забезпечують зріст та розвиток мікроорганізмів. Живильні середовища мають виключне значення у мікробіології. Правильний підбір складу середовища забезпечує можливість виділення мікроорганізмів з місць їх оселі, отримання чистих культур, вивчення їх біохімічних особливостей, сприяє швидкій та правильній діагностиці інфекційних хвороб, дає можливість отримувати біомасу корисних для народного господарства мікроорганізмів.
По походженню та складу живильні середовища можна поділити на натуральні (природні), синтетичні та напівсинтетичні.
Натуральні середовища бувають рослинного та тваринного походження. Вони утримують у своєму складі всі інгредієнти, які необхідні для зросту та розвитку мікроорганізмів. Склад цих середовищ точно не визначено. Такими середовищами є відвари злаків, трав, овочеві та фруктові соки, картопля, морква, молоко, тваринні тканини, кров, сироватка, сеча, відвари м'яса, морська та озерна вода і мінеральні джерела, яйця птахів, їх зародки та інші. Прикладом натуральних середовищ, що найбільш часто використають є м'ясо-пептонний бульйон (МПБ).
Для його приготування готують м'ясний відвар. 3 цією метою свіже м'ясо (яловичину, телятину або конину) звільняють від кісток, жиру, сухожиль, рублять та пропускають крізь м'ясорубку 500г такого фаршу, кладуть до каструлі, заливають 1л водопровідної води та залишають у прохолодному місці на 24 години або у термостаті при температурі 30С на 6 годин, а при 37С - на 2 години для екстрагування різноманітних необхідних для поживи мікроорганізмів речовин. Потім м'ясо віджимають крізь марлю й отриманий настій кип'ятять на протязі 30 хвилин, для згортання білка, який відділяють фільтруванням. Після того, як настій остигне, його фільтрують крізь складковий паперовий фільтр, попередньо змочений водою (або крізь фільтрувальне полотно, яке накладають на скляну лійку). Вологий паперовий фільтр не дуже міцний, тому рідину на нього наливають обережно по стінці. Відфільтрований настій стерилізують. Стерильна м'ясна вода є основою для приготування м'ясо-пептонного бульйону. Для цього до 1л м'ясної води додають 10г пептону та 5г NаСl. Після 10-15 хвилин кип'ятіння його охолоджують, установлюють необхідне значення рН, фільтрують та стерилізують. Пептони додають замість згорнутого м'ясного білка. Вони є продуктом неповного руйнування білка, їх отримують кислотним або ферментативним гідролізом м'яса або молочного казеїну. Перевагою цих джерел амінокислот є те, що вони легше засвоюються та при стерилізації не згортаються, тому стерильний бульйон залишається прозорим. Ріст мікроорганізмів у таких середовищах легше визначається при з'явленні помутніння.
Для вирощування мікроорганізмів, як поживне середовище, широко використовується також незхмільне пивне сусло. Цей субстрат, також, як і м'ясна вода, вміщує велику кількість корисних речовин (амінокислот, нуклеїнових кислот, вітамінів, мінеральних солей). Для приготування сусла використовують пророщене ячмінне насіння (солод), в якому активізуються протеолітичні та амінолітичні ферменти.
Дріжджове середовище використовується для культивування багатьох гетеротрофів. Готується воно з свіжих або пресованих дріжджів. Ґрунтова витяжка застосовується для виділення та культивування мікроорганізмів ґрунту.
Синтетичні середовища готують з певних хімічно чистих з'єднань вказаних концентрацій. У таких середовищах вивчають обмін речовин мікроорганізмів, тому що в них можна врахувати кількість та якість речовин, які поступають у клітки, зміни цих з'єднаній під впливом мікроорганізмів, виявити метаболіти, які виділяються мікробними клітками у процесі життєдіяльності. Перевага синтетичних середовищ полягає у їх здібності до відтворення. У залежності від потреби мікроорганізмів синтетичні середовища можуть бути дуже складного або дуже простого складу. Прикладом синтетичного середовища є середовище Чапека для вирощування пліснявих грибів.
Напівсинтетичні середовища мають складний склад. Компонентами цих середовищ (вуглеводи, фосфати, нітрати та інші) є натуральні продукти: м'ясний відвар, дріжджовий екстракт, пивне сусло. Такі середовища використовують для вирощування мікроорганізмів у лабораторних умовах та промисловості.
Середовища для одного й того ж мікроорганізму можуть бути різними у залежності від завдань дослідження.
По призначенню середовища бувають:
Стандартні або середовища загального призначення. У таких середовищах вирощують або накопичують біомасу багатьох мікроорганізмів - це МПА, МПБ, МПЖ та інші.
Спеціальні середовища або середовища спеціального призначення. Ці середовища призначені для виявлення тих або інших біохімічних особливостей мікроорганізмів або для одержування їхніх культур, які володіють особливими властивостями.
Крім спеціальних середовищ виділяють елективні (виборчі) та диференціально-діагностичні середовища.
Елективні середовища (від лат. Еlektys - обираю) підбираються таким чином, щоб забезпечити найбільш сприятливі умови для вирощування певних мікроорганізмів. До них можуть бути додані речовини, які вибірково подавляють розвиток супутньої мікрофлори. При посіві на такі середовища досліджуваних матеріалів, які утримують суміш різних мікроорганізмів. Перш за все буде проявлятися зріст того виду, для якого це середовище буде вибірковим. Ці середовища використовують для виділення мікроорганізмів з місць їх природного мешкання або для одержання накопичувальних культур. Прикладом може бути середовище Ешбі для азотфіксуючих бактерій.
Диференційно-діагностичні середовища використовують для визначення видової належності дослідних мікроорганізмів, враховуючи особливості обміну його речовин. Склад цих середовищ дозволяє чітко виявити найбільш характерні властивості мікроорганізмів. До них відносяться середовища з молоком, кров’ю, желатином, на яких вивчаються протеолітичні та гемолітичні властивості мікроорганізмів. Наявність желатінази та інших протеолітичних ферментів визначають по розрідженню желатина, згорнутого яєчного або сироваткового білку. Прикладом таких середовищ є середовище Ендо, яке використовується для виділення та визначення бактерій кишкової палички. Вона відрізняється від інших представників мікрофлори кишок тим, що утворює колонії червоного кольору з металевим блиском.
Середовища класифікуються за консистенцією. Використовуються рідинні, сипкі сухі та плотні середовища.
Рідинні середовища використовують для накопичування біомаси або метаболітів мікроорганізмів. Це сприяє оновленню культур, які тривало зберігаються, підтримки та оберіганню тих культур, які погано зростають на плотних середовищах. На рідинних середовищах легше проявляються фізіолого-біохімічні особливості мікроорганізмів.
Сипкі сухі середовища використовуються в основному промисловою мікробіологією. Це розварене пшоно, висівки, кварцовий пісок, просочений поживним розчином.
Плотні середовища необхідні для виділення та опису культурних властивостей чистих культур мікроорганізмів, тому що на них можливо отримати ізольований зріст окремих клітин, для зберігання культур, визначення ряду їх властивостей (наприклад, антагоністичних відносин між мікроорганізмів).
Плотні поживні середовища готують з рідинних з додаванням до них агар-агару, геля, желатину.
Агар-агар є найкращою желеутворюючою речовиною (малайське желе), виробляється з водоростей. Це складний полісахарид, який утворює гель з температурою плавлення 36-100 0С та температурою застигання біля 40 0С. Тому, на середовищах з агаром можливо культивувати мікроорганізми при будь-якій температурі. Крім того, агар-агар, як поживний субстрат, використовується лише не багатьма мікроорганізмами. Плотні живильні середовища отримують додаванням до рідинних 1-2% агар-агару. Таким чином з МПБ готують МПА. Для отримання більш плотного середовища іноді додають 3% агар-агару.
Желатин - це речовина білкової природи, яку отримують з кісток та хрящів тварин при їх виварюванні. Желатин додають до середовищ у кількості 10-12%. Як ущільнювач він використовується обмежено. Це пов'язано з тим, що він розріджується під дією протеолітичних ферментів. Крім того, утворений желатином гель плавиться при температурі 23-25 0С та застигає при 20 0С, а більшість мікроорганізмів розвиваються при 30-37 0С. При такій температурі середовище знаходиться в розплавленому стані. Тому желатин використовується головним чином для виявлення протеолітичної активності мікроорганізмів, для отримання гігантських глибинних колоній дріжджів, при їх ідентифікації.
Промисловим засобом виготовляються деякі середовища у вигляді сухих порошків. Перевага таких середовищ полягає в їх стандартності, стабільності, простоті приготування й зручності при транспортуванні. Сухі живильні середовища представляють собою гігроскопічні порошки, які зберігаються у спеціальних флаконах. В лабораторії з порошків готують середовища згідно з рецептурою, вказаною на етикетці. Частіше за все використовують сухі середовища Ендо, сухий поживний агар, рибний поживний агар та інші.
Живильні середовища одразу після приготування стерилізують.
