
- •1. Строение атома. Строение электронной оболочки атома. Связь строения и химических свойств атома.
- •2. Химическая связь. Строение молекулы.
- •3.Периодический закон д.И. Менделеева. Физический смысл констант в таблице д.И. Менделеева.
- •4. Основы термодинамики. Понятие внутренней энергии, энтальпии. 1 закон термодинамики. Закон Гесса. Следствие из закона Гесса.
- •5. Функции состояния системы: энтропия, энергия Гиббса. Определение направления протекания реакции.
- •6. Кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной среде.
- •7. Зависимость скорости реакции от температуры. Катализ. Виды катализа.
- •8. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •9.Растворы. Процесс растворения. Концентрация раствора. Классификация растворов.
- •10. Свойства растворов неэлектролитов. 1 и 2 закон Рауля. Осмотическое давление.
- •12. Ионное произведение воды, pH растворов.
- •13. Ионообменные процессы. Равновесие в водных растворах электролитов.
- •14. Гидролиз солей. Классификация солей по реализации процесса гидролиза. Гидролиз солей по катиону.
- •15. Гидролиз солей по аниону. Степень гидролиза. Влияние условий на степень гидролиза.
- •16. Поверхностные явления. Дисперсные системы. Классификация дисперсных систем.
- •17. Поверхностные явления. Сорбция.
- •18. Дисперсные системы. Коллоидные системы. Классификация.
- •19.Методы получения коллоидных систем. Пептизация. Устойчивость коллоидных систем. Коагуляция.
- •20. Строение мицеллы, образованной в результате реакции обмена
- •21. Овр. Степень окисления элемента. Составление уравнений овр.
- •22. Важнейшие окислители и восстановители. Роль соединения в овр, исходя из степени окисления элемента.
- •23. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Зависимость химической активности металла от значения потенциала. Взаимодействие металлов с солями и кислотами.
- •24. Уравнение Нернста. Гальванические элементы. Эдс гальванического элемента.
- •25. Коррозия металлов. Основные виды и типы коррозии металлов, их характеристика.
- •26. Методы защиты металлов от коррозии.
- •27. Электролиз расплава. Электролиз раствора соли с нерастворимым анодом. Катодные процессы. Порядок восстановления ионов из водных растворов солей.
- •28. Электролиз с активным анодом. Анодные процессы.
- •29. Качественный и количественный анализ вещества. Качественне реакции на катионы и анионы.
- •30. Физико-химические методы анализа (ма): электрохимические, спектральные (оптические), хроматографические, радиометрические, масс-спектрические.
- •31. Общая характеристика металлов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений. S-элементы, их общие характеристики.
- •32. Кальций и магний. Природные соединения. Соединения кальция и магния применяемые в строительстве.
- •33. Природные воды, их состав и классификация.
- •34. Жесткость воды. Классификация жесткости. Способы устранения.
- •36. Общая характеристика неметаллов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений на примере углерода и кремния.
- •37. Полимеры. Классификация полимеров. Особенности свойств полимеров в отличие от низкомолекулярных соединений.
- •38. Методы получения полимеров (реакция полимеризации и поликонденсации)
- •39. Понятие о физических состояниях полимеров. Переход полимера из одного физического состояния в другое.
- •40. Химические реакции в полимерах. Реакции отверждения. Деструкция полимеров.
8. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
Химическое
равновесие
– состояние хим
с-мы,
в к-ом обратимо
протекает одна
или несколько х р, причём скорости
в
каждой паре равны м/у собой. Для системы,
находящейся в хим равновесии, концентрации
реагентов,
t-ра
и
др параметры с-мы не изменяются со
временем.
Во всех обратимых р-ях
скорость прям р-ции уменьшается, скорость
обратной р-ции возрастает до тех пор,
пока обе скорости не станут равными и
не установится состояние равновесия.
Kр=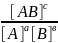 – константа химического равновесия
Смещение
химического равновесия:
при изменении условий (t,
р, C)
скорость прям и обратной р-ции изменяется
не одинаково, с-ма выходит из состояния
равновесия. Ч/з некоторое время скорости
опять выравниваются и достигается новое
состояние равновесия. Переход из одного
равновесия в другое, называется смещением
равновесия,
а скорость, к-ая больше в переходный
момент, определяет направление смещения
равновесия.
Принцип
Ле Шателье (регулирует
направление смещения равновесия): Если
на систему находящуюся в равновесии
подействовав извне (изменение р, t,
С), то усиливается тот процесс, к-ый
противодействует оказанному
взаимодействию:
1.При увеличении С
исх в-в равновесие смещается в сторону
прямого процесса (процесса, расходующего
исх в-во и уменьшающего его С и
наоборот).
2.При повышении t-ры
равновесие смещается в сторону процесса,
уменьшающего t-ру,
т.е. в сторону эндотермической р-ции и
наоборот.
3.При повышении р равновесие
смещается в сторону процесса, идущего
с уменьшением числа молей газообразного
вещества, т.е. процесса, уменьшающего р
и наоборот.
– константа химического равновесия
Смещение
химического равновесия:
при изменении условий (t,
р, C)
скорость прям и обратной р-ции изменяется
не одинаково, с-ма выходит из состояния
равновесия. Ч/з некоторое время скорости
опять выравниваются и достигается новое
состояние равновесия. Переход из одного
равновесия в другое, называется смещением
равновесия,
а скорость, к-ая больше в переходный
момент, определяет направление смещения
равновесия.
Принцип
Ле Шателье (регулирует
направление смещения равновесия): Если
на систему находящуюся в равновесии
подействовав извне (изменение р, t,
С), то усиливается тот процесс, к-ый
противодействует оказанному
взаимодействию:
1.При увеличении С
исх в-в равновесие смещается в сторону
прямого процесса (процесса, расходующего
исх в-во и уменьшающего его С и
наоборот).
2.При повышении t-ры
равновесие смещается в сторону процесса,
уменьшающего t-ру,
т.е. в сторону эндотермической р-ции и
наоборот.
3.При повышении р равновесие
смещается в сторону процесса, идущего
с уменьшением числа молей газообразного
вещества, т.е. процесса, уменьшающего р
и наоборот.
9.Растворы. Процесс растворения. Концентрация раствора. Классификация растворов.
Растворами называются гомогенные с-мы, содержащие не менее 2х веществ. Могут существовать р-ры твердых, жидких и газообразных в-в в жидких растворителях, а также однородные смеси (р-ы) твердых, жидких и газообразных веществ. Как правило, в-во, взятое в избытке и в том же агрегатном состоянии, что и сам р-р, принято считать растворителем, а компонент, взятый в недостатке – растворенным веществом. Концентрация – это содержание растворимого в-ва в ед-це массы или объёма р-ра или р-ля. Растворимость – содержание растворенного в-ва в насыщенном р-ре. Обычно растворимость выражается массой растворенного в-ва, приходящегося на 100г воды. Растворенность зависит от природы в-в (р-ля, раст. в-ва) t-ры и давления (для газов). Концентрации: 1)безразмерная-процентная (массовая, молярность, объём) 2) размерная (нормальность) Классификация р-в: - Электролиты -Неэлектролиты (все органические в-ва кроме спиртов, кислот и их солей) -Твердые -Жидкие -Газовые -Ненасыщенные –Насыщенные.
10. Свойства растворов неэлектролитов. 1 и 2 закон Рауля. Осмотическое давление.
Свойства растворов неэлектролитов: -давление насыщенного пара растворителя над разбавленным раствором (1 з. Рауля) -t кипения и t замерзания р-ра (2 з. Рауля) -осмотическое давление 1 з-н Рауля: от-ое понижение давления насыщ пара р-ля над р-ом равно молярной доле р. в-ва: хв=(р0-р)/р0 – мольная доля. 2 з-н Рауля: повышение t-ры кип и понижение -tры зам р-ра прямо пропорциональны концентрации р-ра: ∆Tк=ЭТCm; ∆Тз.=КТСм. ∆Тк=∆Тк р-ра-∆Тк р-ля; ∆Тз=∆Тз р-ра-∆Тз р-ля. К – криоскопическая const (зависит от природы р-ля); См –конц-ция; Е- эбуллиоскопическая const. Осмотическое давление (π) – это давление, необходимое для перехода из менее концентрир р-ра в более концентрир р-р в-ва. Для р-ров неэл-в невысоких конц-ций зав-ти осмотич давления от конц-ции и t-ры р-ра выражается ур-ем Вант-Гоффа: π=CвRT
11. Теория электролитической диссоциации. Свойства растворов электролитов. Диссоциация солей, кислот и оснований
Теория электролитической диссоциации (ТЭД) 1. Все в-ва делятся на электролиты и неэлектролиты. Электролиты – в-ва, к-ые в р-х или расплавах распадаются на ионы (кислоты, основания, соли). Явление распада в-ва на ионы – электролитическая диссоциация. 2. Ионы бывают 2-х типов: полож заряженные (катионы) и отриц заряженные (анионы). Ионы – это заряженные частицы (несущие заряд). При подачи напряжения к р-ру электролита катион двигается в сторону катода (отриц заряж электрода), анионы – к аноду (полож заряж электроду). 3. Процесс диссоциации обратимый: обратный процесс – ассоциация. Поэтому в р-ре возможно одновременное существование, как молекул, так и ионов. Свойства электролитов определяются х-ром ион-ионных и ион-молекулярных взаимодействий, а также изменением св-в и структуры р-ля под влиянием растворенных частиц электролитов. В зависимости от концентрации электролитов выделяют область разбавленных растворов, к-ые по своей структуре близки к структуре чистого растворителя. Разбавленные р-ры слабых электролитов по своим свойствам близки к идеальным р-рам. Разбавленные р-ры сильных электролитов заметно отклоняются от св-в идеальных р-ов, что обусловлено электростатическим межионным взаимодействием. Диссоциация кислот: образуется иона водорода, обеспечивающий водному р-ру кислую среду. Пример: НClН++Сl-. Если в молекуле несколько атомов водорода, то процесс протекает постадийно. Диссоциация оснований: образуется гидроксид ион, обеспечивающий водному р-ру основную (щелочную) среду. Пример: NaOHNa++OH-. Диссоциация солей: образуется катион металла и анион кислотного остатка. Пример: KNO3K++NO3-.
