
- •1. Строение атома. Строение электронной оболочки атома. Связь строения и химических свойств атома.
- •2. Химическая связь. Строение молекулы.
- •3.Периодический закон д.И. Менделеева. Физический смысл констант в таблице д.И. Менделеева.
- •4. Основы термодинамики. Понятие внутренней энергии, энтальпии. 1 закон термодинамики. Закон Гесса. Следствие из закона Гесса.
- •5. Функции состояния системы: энтропия, энергия Гиббса. Определение направления протекания реакции.
- •6. Кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной среде.
- •7. Зависимость скорости реакции от температуры. Катализ. Виды катализа.
- •8. Химическое равновесие. Константа химического равновесия. Смещение химического равновесия. Принцип Ле Шателье.
- •9.Растворы. Процесс растворения. Концентрация раствора. Классификация растворов.
- •10. Свойства растворов неэлектролитов. 1 и 2 закон Рауля. Осмотическое давление.
- •12. Ионное произведение воды, pH растворов.
- •13. Ионообменные процессы. Равновесие в водных растворах электролитов.
- •14. Гидролиз солей. Классификация солей по реализации процесса гидролиза. Гидролиз солей по катиону.
- •15. Гидролиз солей по аниону. Степень гидролиза. Влияние условий на степень гидролиза.
- •16. Поверхностные явления. Дисперсные системы. Классификация дисперсных систем.
- •17. Поверхностные явления. Сорбция.
- •18. Дисперсные системы. Коллоидные системы. Классификация.
- •19.Методы получения коллоидных систем. Пептизация. Устойчивость коллоидных систем. Коагуляция.
- •20. Строение мицеллы, образованной в результате реакции обмена
- •21. Овр. Степень окисления элемента. Составление уравнений овр.
- •22. Важнейшие окислители и восстановители. Роль соединения в овр, исходя из степени окисления элемента.
- •23. Стандартные электродные потенциалы. Электрохимический ряд напряжений металлов. Зависимость химической активности металла от значения потенциала. Взаимодействие металлов с солями и кислотами.
- •24. Уравнение Нернста. Гальванические элементы. Эдс гальванического элемента.
- •25. Коррозия металлов. Основные виды и типы коррозии металлов, их характеристика.
- •26. Методы защиты металлов от коррозии.
- •27. Электролиз расплава. Электролиз раствора соли с нерастворимым анодом. Катодные процессы. Порядок восстановления ионов из водных растворов солей.
- •28. Электролиз с активным анодом. Анодные процессы.
- •29. Качественный и количественный анализ вещества. Качественне реакции на катионы и анионы.
- •30. Физико-химические методы анализа (ма): электрохимические, спектральные (оптические), хроматографические, радиометрические, масс-спектрические.
- •31. Общая характеристика металлов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений. S-элементы, их общие характеристики.
- •32. Кальций и магний. Природные соединения. Соединения кальция и магния применяемые в строительстве.
- •33. Природные воды, их состав и классификация.
- •34. Жесткость воды. Классификация жесткости. Способы устранения.
- •36. Общая характеристика неметаллов. Положение в периодической таблице д. И. Менделеева. Химические свойства металлов и их соединений на примере углерода и кремния.
- •37. Полимеры. Классификация полимеров. Особенности свойств полимеров в отличие от низкомолекулярных соединений.
- •38. Методы получения полимеров (реакция полимеризации и поликонденсации)
- •39. Понятие о физических состояниях полимеров. Переход полимера из одного физического состояния в другое.
- •40. Химические реакции в полимерах. Реакции отверждения. Деструкция полимеров.
4. Основы термодинамики. Понятие внутренней энергии, энтальпии. 1 закон термодинамики. Закон Гесса. Следствие из закона Гесса.
Термодинамика – наука о взаимопревращениях энергии в ходе х р. Процессы: Экзотермический – энергия выделяется в окр среду (∆H<0, Q>0) и Эндотермический – энергия поглощается извне (∆H>0, Q<0).
Энергосодержание
с-мы описывается тепловым
эффект Q
или энтальпией Н.
Энтальпия
(Н) – функция
состояния с-мы, приращение к-ой равно
теплоте, полученной с-ой в изобарном
процессе (∆р=const).
Q=H2–H1=–∆H
 ; ∆H=∆U+p∆V,
U
- внутренняя энергия.
Внутренняя
энергия (U)
– параметр, не зависящий от пути перехода
системы из одного состояния в другое,
а зависящие только от начального и
конечного состояния системы.
1
з-н термодинамики:
теплота,
переданная с-ме, расходуется на возрастание
внутр энергии и на совершение работы Q
= ∆U+A.
Закон
Гесса: Q
и H
в ходе процесса не зависят от пути
протекания р-ции, а зависит от нач и кон
состояния с-мы.
Следствие
из закона Гесса:
Изменение энтальпии р-ции равно сумме
стандарт энтальпий обр-ия продуктов
р-ции за вычетом суммы стандартных
энтальпий обр-ия исх в-в: ΔH=ΣΔHобр
(продуктов)–ΣΔHобр(исх)
; ∆H=∆U+p∆V,
U
- внутренняя энергия.
Внутренняя
энергия (U)
– параметр, не зависящий от пути перехода
системы из одного состояния в другое,
а зависящие только от начального и
конечного состояния системы.
1
з-н термодинамики:
теплота,
переданная с-ме, расходуется на возрастание
внутр энергии и на совершение работы Q
= ∆U+A.
Закон
Гесса: Q
и H
в ходе процесса не зависят от пути
протекания р-ции, а зависит от нач и кон
состояния с-мы.
Следствие
из закона Гесса:
Изменение энтальпии р-ции равно сумме
стандарт энтальпий обр-ия продуктов
р-ции за вычетом суммы стандартных
энтальпий обр-ия исх в-в: ΔH=ΣΔHобр
(продуктов)–ΣΔHобр(исх)
5. Функции состояния системы: энтропия, энергия Гиббса. Определение направления протекания реакции.
Энтропия (S) – ф-ия состояния с-мы, отражающая вероятность расположения частиц в пространстве на микроуровне (или мера беспорядка системы). Если в х р увеличивается к-во в-ва, то S возрастает. При переходе из одного агрегатного состояния в другое: тв→ж→г – энтропия возрастает и наоборот. ΔS=ΣΔSобр (продуктов)–ΣΔSобр(исх) Энергия Гиббса (G) – ф-ия состояния с-мы, дающая инф-ю о возможности протекания процесса. Х пр регулируется энтальпийным и энтропийным факторами. С-ме выгодно выделять энергию ∆H<0 и повышать беспорядок ∆S>0. Объединяет эти 2 фактора G: ΔG=ΔH–TΔS. Направление реакции: ΔG<0 реакция протекает в пр напр; ΔG=0 с-ма нах-ся в состоянии равновесия; ΔG>0 р-ция не протекает в пр напр.
6. Кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс в гомогенной и гетерогенной среде.
Кинетика
–
наука
о скоростях и механизмах х р-ций.
Гомогенная
р –
если реагенты нах-ся в одной
фазе.
Гетерогенная
р –
если реагенты нах-ся в разных фазах.
Скорость
х р – изменение
концентрации
одного из
реагентов за ед-цу времени при неизменном
объеме.
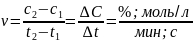 Зависимость
скорости р-ции от концентрации реагентов:
чем выше концентрация реагирующих в-в,
тем скорость больше.
Закон
действующих масс:
скорость х р прямо пропорциональна
пр-ию концентрации реагентов в степенях,
равных коэф-ам: аА(г)+вВ(г)=cАВ
=> v=k
Зависимость
скорости р-ции от концентрации реагентов:
чем выше концентрация реагирующих в-в,
тем скорость больше.
Закон
действующих масс:
скорость х р прямо пропорциональна
пр-ию концентрации реагентов в степенях,
равных коэф-ам: аА(г)+вВ(г)=cАВ
=> v=k ;
k
– const
скорости.
В математ выр-ии не учитывают
конц реагентов, находящихся в твердом
состоянии, т.к. они реагируют лишь на
поверхности. Для газовых с-м концентрацию
можно заменить на парциальное давление
газа: v=k’p02
;
k
– const
скорости.
В математ выр-ии не учитывают
конц реагентов, находящихся в твердом
состоянии, т.к. они реагируют лишь на
поверхности. Для газовых с-м концентрацию
можно заменить на парциальное давление
газа: v=k’p02
7. Зависимость скорости реакции от температуры. Катализ. Виды катализа.
Зав-ть
скорости р-ции от t-ры:
чем выше t-ра,
тем скорость выше. Эту зав-ть дает правило
Вант – Гоффа: при повышении t-ры
на каждые 10оС
скорость р-ции увеличивается в 2-4 раза:
 Катализ
– явление изменения скорости х р в
присутствии в-в – катализаторов. Они,
изменяя скорость
х р, сами не расходуются и не входят в
состав конечн продуктов.
Виды
катализаторов:
положительные (ускоряют процесс);
отрицательные (замедляют процесс).
Виды
катализа:
-гетерогенный
(неоднородный) – катализатор и реагирующие
в-ва нах-ся в разных фазах, протекает
процесс на поверхности раздела фаз;
Катализ
– явление изменения скорости х р в
присутствии в-в – катализаторов. Они,
изменяя скорость
х р, сами не расходуются и не входят в
состав конечн продуктов.
Виды
катализаторов:
положительные (ускоряют процесс);
отрицательные (замедляют процесс).
Виды
катализа:
-гетерогенный
(неоднородный) – катализатор и реагирующие
в-ва нах-ся в разных фазах, протекает
процесс на поверхности раздела фаз;
-гомогенный (однородный) – катализатор и реагирующие в-ва нах-ся в одной фазе, протекает процесс во всём объеме.
