
- •1. Вуглеводи та ліпіди:
- •1.1. Йодометричний метод визначення глюкози.
- •1.2. Йодометричний метод визначення лактози.
- •1.3. Визначення крохмалю поляриметричним методом за Еверсом.
- •1.4. Визначення йодного числа.
- •1.5. Визначення кислотного числа.
- •2. Властивості амінокислот, методи їх кількісного визначення.
- •2.1. Визначення амінокислот методом тонкошарової хроматографії (тшх)/
- •2.2. Визначення азоту амінних груп методом формольного титрування
- •3. Властивості білків, методи їх кількісного визначення.
- •3.1. Ізоелектрична точка білків.
- •3.2. Кількісне визначення білка на основі біуретової реакції.
- •3.3. Осадження білків.
- •4. Якісне та кількісне визначення вітамінів.
- •4.1. Кількісне визначення каротинів.
- •4.2. Якісне визначення вітаміну д2 (ергокальциферолу).
- •4.3. Якісне визначення рибофлавіну.
- •4.4. Кількісне визначення вітаміну с у рослинній сировині.
- •4.5. Визначення вітаміну с в молоці.
- •5. Ферменти: специфічність та активність дії.
- •5.1. Визначення специфічності дії ферментів
- •5.2. Визначення залежності дії ферментів від температури і рН середовища
- •5.3. Вплив активаторів та інгібіторів на активність амілази.
- •5.4. Якісне визначення β-фруктофуранозидази.
- •5.5. Визначення амілолітичної активності.
- •5.6. Визначення протеолітичної активності.
- •5.7. Визначення активності каталази (за о.М.Бахом та о.І.Опаріним).
4. Якісне та кількісне визначення вітамінів.
4.1. Кількісне визначення каротинів.
До чисельних природних кольорових речовин, які надають жовтого, оранжевого та червоного забарвлення рослинним продуктам, відносяться пігменти – каротини. Всі ці речовини мають біологічну активність вітаміну А.
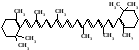
Біологічна активність цих сполук обумовлена тим, що вони у тварин під дією ферментів розкладаються з утворенням вітаміну А. До найважливіших провітамінів А належать природні каротиноїдні вуглеводні: α- β-, й- γ- каротини. А-вітамінна активність обумовлена наявністю в їх структурі кільця β–іонону, зв'язаного з аліфатичним ланцюгом, який складається з системи спряжених подвійних зв'язків ізопреноїдного характеру.
Апаратура: фотоелектроколориметр, вакуумний насос.
Лабораторний посуд: порцелянові ступки, адсорбційна колонка, мірні циліндри, мірні колби, скляні палички, пробірки, піпетки.
Матеріали та реактиви: 1. бензин; 2. сульфат натрію безводний; 3. вуглекислий магній; 4. оксалат натрію; 5. біхромат калію; 6. тальк; 7. дистильована вода.
Принцип методу полягає в екстрагуванні каротину бензином з рослинної сировини, попередньо ретельно розтертої з безводним сульфатом натрію. Отриманий розчин доводять до визначеного об'єму бензином і колориметрують.
Хід роботи. 0,5 г подрібненої моркви, червоного перцю або зеленого листя розтирають у ступці з 2 г безводного сульфату натрію та 0,5 г вуглекислого магній. Після розтирання суміш протягом 5–10 хв. підсушують. Порошок переносять у адсорбційну колонку. Для цього використовують скляний фільтр № 3 діаметром 25 мм, в який насипають 10 г добре розтертої суміші оксалату натрію і тальку (1:1) та ущільнюють її. Підсушену наважку висипають у колонку, ущільнюють її паличкою та закривають зверху ватним тампоном. Ступку обполіскують 5 мл бензину, який теж виливають у колонку. Після цього вмикають насос і відсмоктують із швидкістю 50–60 крапель за 1 хв. Колонку промивають порціями бензину по 3 мл до повного вимивання нижньої оранжевої смуги каротину, яка знаходяться попереду. За нею йде жовта смуга ксантофілів, а вище – синя смуга хлорофілу. Розчин каротину переносять до мірного циліндра й доводять бензином до потрібного об'єму (10 чи 15 мл). Інтенсивність забарвлення отриманого розчину каротину визначають на ФЕК при 450 або 440 нм (синій світлофільтр).
Далі по калібрувальній кривій за отриманими значеннями оптичної густини знаходять відповідні їм значення концентрації каротину у сировині за формулою:
![]()
де Х – вміст каротину, мг/100 г речовини; 0,1 – коефіцієнт перерахунку мікрограмів у міліграми на 100 г речовини; А – об'єм досліджуваного розчину каротину, мл; Н – наважка досліджуваної речовини, г; С – концентрація стандартного розчину каротину (по кривій), мкг/мл.
Побудова калібрувальної кривої. Для побудови калібрувальної кривої можна використати стандартні розчини кристалічного каротину або хімічно чистих азобензолу чи біхромату калію.
0,36 г біхромату калію розчиняють у 100 мл дистильованої води (основний розчин): 1 мл цього розчину відповідає 20,8 мг каротину. З основного розчину готують шкалу стандартних розчинів (табл. 4.1). Загальний об'єм кожного стандарту складає 50 мл.
Готові стандартні розчини колориметрують на ФЕК.
Таблиця 4.1
|
Номер розчину |
Основний розчин, мл |
Вода, мл |
Вміст каротину, мкг/мл |
|
1 |
1 |
49 |
0,416 |
|
2 |
2 |
48 |
0,832 |
|
3 |
3 |
47 |
1,248 |
|
4 |
4 |
46 |
1,664 |
|
5 |
5 |
45 |
2,080 |
|
6 |
10 |
40 |
4,160 |
|
7 |
25 |
25 |
10,400 |
Для побудови калібрувальної кривої на міліметровому папері проводять координатні осі. На осі абсцис відкладають концентрації стандартних розчинів біхромату калію (мкг у 1 мл), на осі ординат – відповідні їм значення оптичної густини, отримані на ФЕК. Із знайдених точок проводять перпендикуляри до Їх перетин: Отримані точки перетину з’єднують між собою. Ця лінія і буде калібрувальною кривою.
