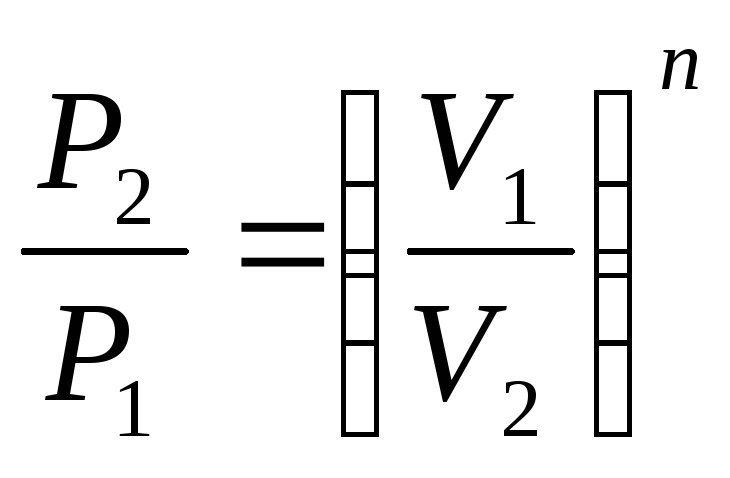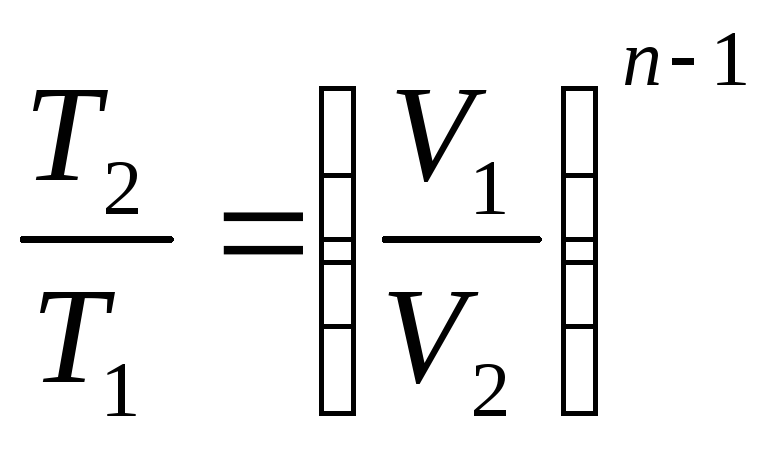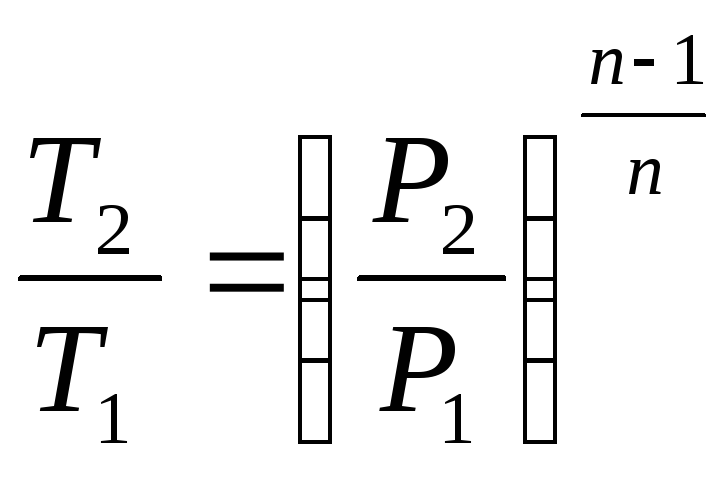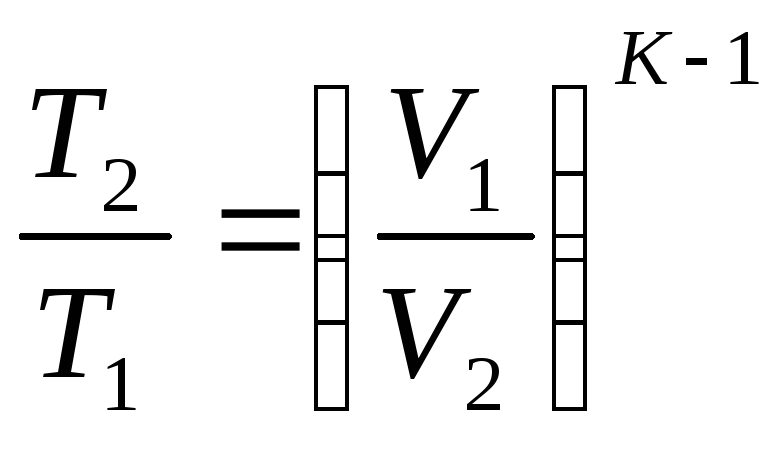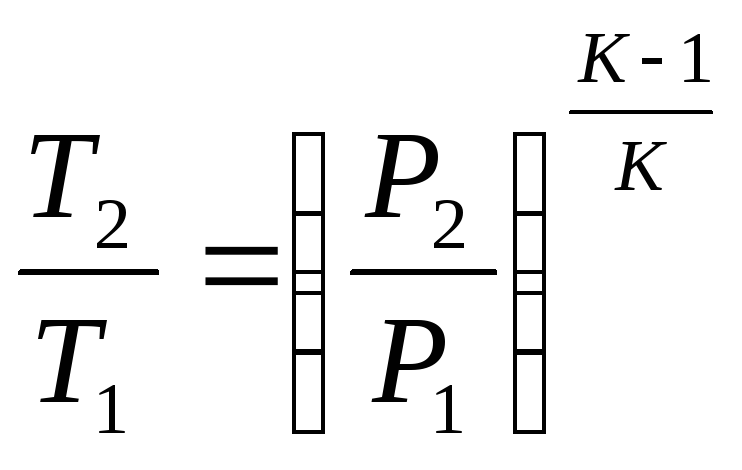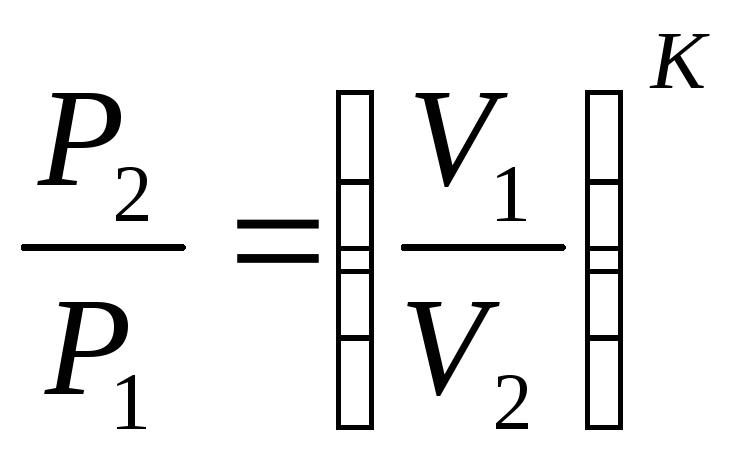- •Г.В. Бахмат, е.Н. Кабес
- •1.1.2. Первый закон термодинамики
- •1.1.3. Второй закон термодинамики
- •1.1.4. Термодинамические процессы
- •1.1.5. Термодинамика потока
- •1.1.6. Термодинамический анализ процессов в компрессорах
- •1.1.7. Циклы двигателей внутреннего сгорания и газотурбинных установок
- •1.1.8.Циклы паросиловых установок
- •1.1.9. Циклы холодильных машин, теплового насоса (обратные термодинамические циклы)
- •1.2. Теория теплообмена
- •1.2.1. Основные понятия и определения
- •1.2.2. Теплопроводность
- •1.2.3. Конвективный теплообмен
- •1.2.4. Теплообмен излучением
- •1.2.5. Теплопередача. Основы расчета теплообменных аппаратов
- •2. Контрольные задания
- •2.1. Методические указания
- •2.2. Техническая термодинамика
- •2.3. Теория теплообмена
- •Приложение 1 Средние изобарные мольные теплоемкости
- •Приложение 2 Физические параметры сухого воздуха при давлении 101,3 кПа
- •3. Конспект лекций
- •3.1. Термодинамика
- •3.1.1. Содержание и метод термодинамики
- •3.1.2. Основные понятия термодинамики
- •3.1.3. Газовые смеси
- •3.1.4. Законы идеальных газов
- •3.1.5. Первое начало термодинамики
- •3.1.5.1. Первое начало термодинамики как математическое выражение закона сохранения энергии
- •3.1.5.2. Первое начало термодинамики простого тела
- •3.1.6. Понятие теплоёмкости
- •3.1.7. Первое начало термодинамики для идеальных газов
- •3.1.7.1. Закон Майера
- •8314 Дж/(кмольк).
- •3.1.7.2. Принцип существования энтропии идеального газа
- •3.1.8. Термодинамические процессы
- •3.1.8.1. Классификация термодинамических процессов
- •3.1.8.2. Работа в термодинамических процессах
- •3.1.9. Круговые процессы (циклы)
- •3.1.9.1. Тепловые машины, понятие термического к.П.Д.,
- •3.1.9.2. Цикл Карно
- •3.1.10. Второе начало термодинамики
- •3.1.11. Термодинамические циклы двигателей внутреннего сгорания
- •3.1.11.1. Циклы поршневых двигателей внутреннего сгорания
- •3.1.11.2. Циклы газотурбинных установок
- •3.1.12. Типовые задачи к разделам курса «термодинамика»
- •3.1.12.1. Параметры, уравнение состояния идеального газа
- •3.1.12.2. Газовые смеси
- •3.1.12.3. Первое начало термодинамики
- •3.1.12.4. Процессы изменения состояния вещества
- •3.1.12.5. Термодинамические циклы
- •4.1.Теплопередача
- •4.1.1. Теплопередача, её предмет и метод, формы передачи теплоты
- •4.2. Теплопроводность
- •4.2.1. Температурное поле
- •4.2.2. Температурный градиент
- •4.2.3. Тепловой поток. Закон Фурье
- •4.2.4. Коэффициент теплопроводности
- •4.2.5. Дифференциальные уравнения теплопроводности
- •4.2.6. Условия однозначности для процессов теплопроводности
- •4.2.7. Отдельные задачи теплопроводности при стационарном режиме
- •4.3. Конвективный теплообмен
- •4.3.1. Основные понятия и определения
- •4.3.2. Теория размерностей
- •Размерности и показатели степени при конвективном теплообмене
- •4.3.3. Теория подобия
- •4.3.4. Критериальные уравнения
- •4.3.5. Некоторые случаи теплообмена
- •4.3.6. Расчетные зависимости конвективного теплообмена
- •4.3.7. Теплообмен при естественной конвекции
- •4.3.8. Теплоотдача при вынужденном движении жидкости в трубах и каналах
- •4.3.9. Теплоотдача при поперечном обтекании труб
- •4.4. Тепловое излучение
- •4.4.1. Основные понятия и определения
- •4.4.2. Виды лучистых потоков
- •4.4.3. Законы теплового излучения
- •4.4.4. Особенности излучения паров и реальных газов
- •4.5. Теплопередача
- •4.5.1. Теплопередача между двумя теплоносителями через разделяющую их стенку
- •4.5.2. Оптимизация (регулирование) процесса теплопередачи
- •4.5.3. Теплопередача при переменных температурах (расчет теплообменных аппаратов)
- •5. Лабораторные работы
- •5.1. Введение
- •5.2. Порядок проведения лабораторных работ
- •5.3 . Основные обозначения
- •5.4 Лабораторная работа №1
- •5.4.1. Цель работы
- •5.4.2. Задание
- •5.4.3. Экспериментальная установка
- •4.4.4. Порядок проведения опытов и обработка результатов эксперимента
- •5.4.5. Содержание отчета
- •5.4.6. Вопросы для самостоятельной проверки
- •5.4.7. Защита лабораторной работы №1
- •5.5.4. Схема экспериментальной установки
- •5.5.5. Порядок проведения опытов и обработка результатов
- •5.6.2. Краткое теоретическое введение
- •5.6.3. Экспериментальная установка
- •5.6.4. Порядок проведения опытов и обработка результатов.
- •5.7. Лабораторная работа №4
- •5.7.1. Цель работы
- •5.7.2. Задание
- •5.7.3. Порядок выполнения работы
- •5.8.Приложения
- •6. Контрольные вопросы (тесты) к лабораторным работам
- •6.1. Теплопроводность
- •6.2. Конвективный теплообмен
- •6.3. Теплообмен излучением
- •Литература
- •Содержание Введение 3
- •Теплотехника Учебно-методический комплекс
- •Заказ № Уч. – изд. Л. 9,4
- •«Тюменский государственный нефтегазовый университет»
- •625000, Тюмень, ул. Володарского, 38
- •625000, Тюмень, ул. Володарского, 38
3.1.8. Термодинамические процессы
3.1.8.1. Классификация термодинамических процессов
Термодинамическим процессом принято называть любое изменение системы в результате изменения одного или ряда определяющих ее параметров.
Уравнение процесса может быть задано условием о постоянном значении в этом процессе какой-либо функции состояния (например, U=idem, h=idem, P=idem, t=idem и т. п.) или условием о равенстве нулю какого-либо эффекта в этом термодинамическом процессе (например, q=0; работа l=0 и т. п.). С помощью уравнений термодинамики можно изучать разнообразные процессы, при этом интерес представляет изображение процесса изменения состояния в Р- координатах (рис. 3.11).
Простейшими процессами в термодинамике являются: изохорный (=idem), изобарный (Р=idem), изопотенциальный (Р=idem). Обобщающим выражением этих процессов является уравнение политропы с постоянным показателем:
Рn=C=idem; (3.48)
P1/n=
![]() =C1=idem,
=C1=idem,
где n — показатель политропы, для данного процесса величина постоянная, но может иметь любые численные значения от до +;
С, С1 постоянные, характеризующие прохождение процесса через какую-либо точку диаграммы: начальную, конечную или промежуточную.
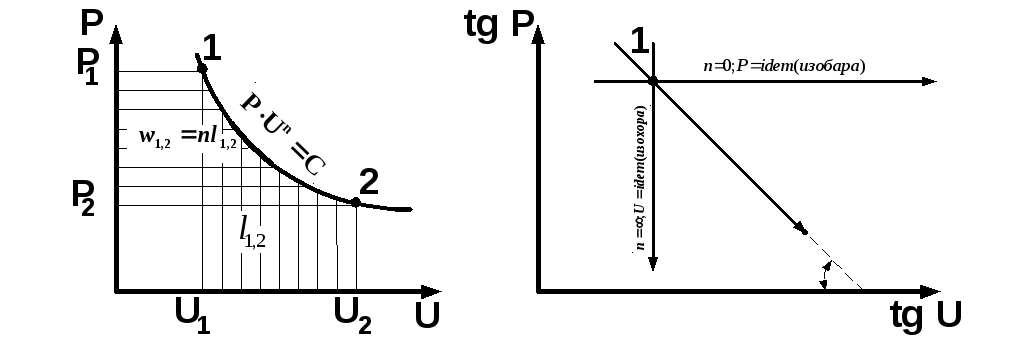
Рис. 3.11. Показатель политропы в P- и lg P-lg координатах
Политропный процесс — это, в принципе, любой процесс, где одно-временно могут изменяться все параметры рабочего тела (P, , T), осуществляться подвод и отвод теплоты и т. п. Все остальные термодинамические процессы являются частными случаями политропного:
так, при n=0 P=idem (изобарный),
n= V=idem (изохорный),
n=1 P=idem (изопотенциальный),
n=k Pk=idem (адиабатный).
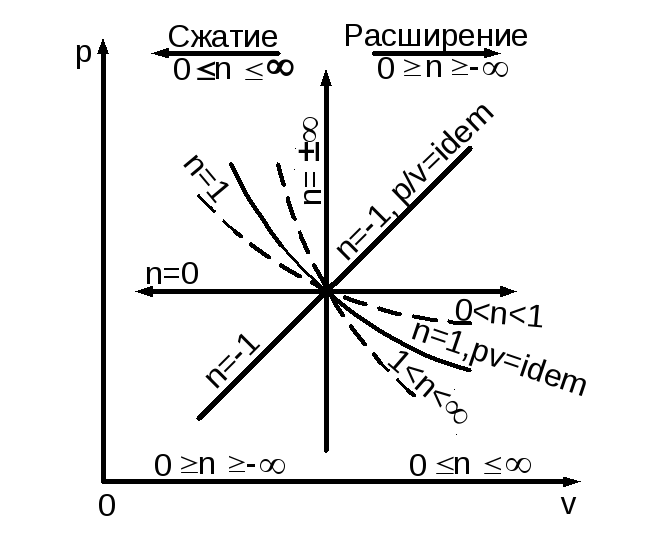 Рис.
3.12. Изображение политропных процессов
в Р- координатах
Рис.
3.12. Изображение политропных процессов
в Р- координатах
Физический смысл показателя политропы n определяется при дифференцировании исходного уравнения политропы с постоянным показателем:
ndP+nn-1Pd=0,
dP=nPd.
=nl n=/l;
в интегральной форме n=/l. (3.49)
Показатель политропы равен отношению работ процесса — потен-циальной к термодинамической, а в логарифмических координатах n=tg. Процессы изменения состояния простых тел можно показать в зависимости от показателя политропы при n+ (рис. 1.12).
3.1.8.2. Работа в термодинамических процессах
Величина работы определяется, исходя из уравнения этого процесса (Р)=0 и уравнения политропы с постоянным показателем.
= dP l=Pd+dP=d(P);
l = Pd n=/l, тогда l(1n)=d(P);
![]() (3.50)
(3.50)
![]() (3.51)
(3.51)
где
![]() — характеристика расширения (сжатия)
— величина соотношения начального и
конечного значений потенциальной
функции.
— характеристика расширения (сжатия)
— величина соотношения начального и
конечного значений потенциальной
функции.
Сопоставляя уравнения процесса, потенциальной функции и уравнение состояния, имеем:
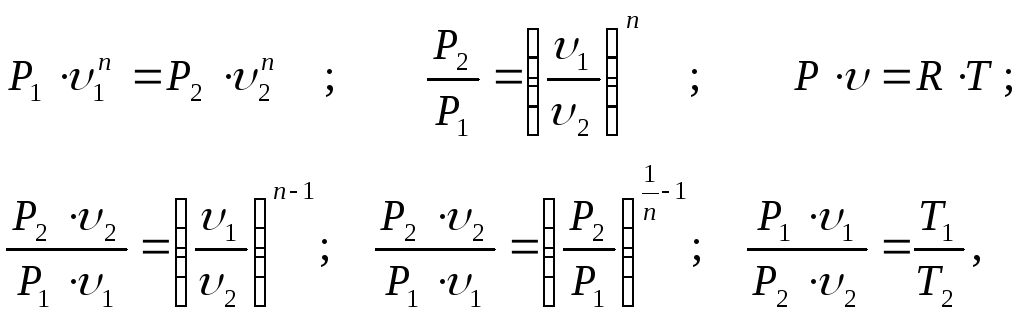
тогда получим:
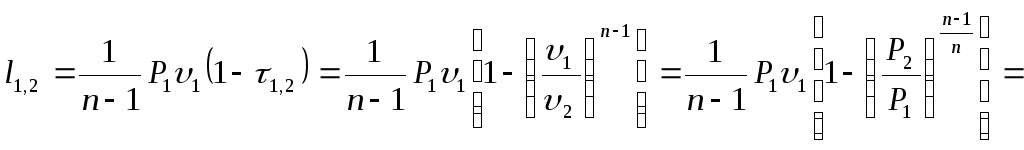
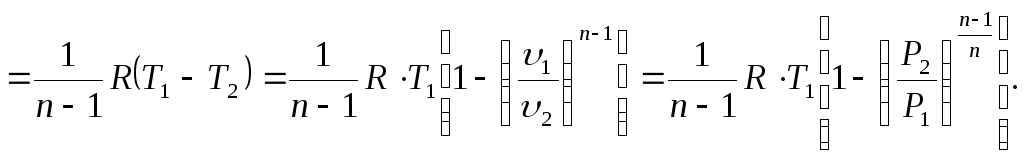 (3.52)
(3.52)
Потенциальная
работа
![]() .
.
Для изотермического процесса
Соотношения между парамет
зависимости термодинами
|
Наименование процесса |
Уравнение процесса |
Показатель политропы |
Связь между параметрами |
Термодинамическая работа |
|
Политропный |
PVn=idem |
|
|
|
|
Изобарный |
P=idem |
n = 0 |
|
|
|
Изохорный |
V=idem |
n = |
|
|
|
Изотермический |
PV=idem |
n = 1 |
|
|
|
Адиабатный |
PVк=idem |
n
= к= |
|
|
рами состояния, расчетные и проверочные Таблица 3.1.
ческих величин в процессах
|
Потенциальная работа |
Теплоем-кость процесса |
Количество тепла |
Изменение энтропии |
|
|
|
|
|
|
|
Срm |
|
|
|
|
Cvm |
q1,2=Сvm(T2-T1) |
|
|
|
|
|
|
|
|
0 |
|
|
![]() (3.53)
(3.53)
Соотношения между параметрами состояния, а также расчетные и проверочные зависимости термодинамических величин в процессах даны в табл. 3.1.