
- •Г.В. Бахмат, е.Н. Кабес
- •1.1.2. Первый закон термодинамики
- •1.1.3. Второй закон термодинамики
- •1.1.4. Термодинамические процессы
- •1.1.5. Термодинамика потока
- •1.1.6. Термодинамический анализ процессов в компрессорах
- •1.1.7. Циклы двигателей внутреннего сгорания и газотурбинных установок
- •1.1.8.Циклы паросиловых установок
- •1.1.9. Циклы холодильных машин, теплового насоса (обратные термодинамические циклы)
- •1.2. Теория теплообмена
- •1.2.1. Основные понятия и определения
- •1.2.2. Теплопроводность
- •1.2.3. Конвективный теплообмен
- •1.2.4. Теплообмен излучением
- •1.2.5. Теплопередача. Основы расчета теплообменных аппаратов
- •2. Контрольные задания
- •2.1. Методические указания
- •2.2. Техническая термодинамика
- •2.3. Теория теплообмена
- •Приложение 1 Средние изобарные мольные теплоемкости
- •Приложение 2 Физические параметры сухого воздуха при давлении 101,3 кПа
- •3. Конспект лекций
- •3.1. Термодинамика
- •3.1.1. Содержание и метод термодинамики
- •3.1.2. Основные понятия термодинамики
- •3.1.3. Газовые смеси
- •3.1.4. Законы идеальных газов
- •3.1.5. Первое начало термодинамики
- •3.1.5.1. Первое начало термодинамики как математическое выражение закона сохранения энергии
- •3.1.5.2. Первое начало термодинамики простого тела
- •3.1.6. Понятие теплоёмкости
- •3.1.7. Первое начало термодинамики для идеальных газов
- •3.1.7.1. Закон Майера
- •8314 Дж/(кмольк).
- •3.1.7.2. Принцип существования энтропии идеального газа
- •3.1.8. Термодинамические процессы
- •3.1.8.1. Классификация термодинамических процессов
- •3.1.8.2. Работа в термодинамических процессах
- •3.1.9. Круговые процессы (циклы)
- •3.1.9.1. Тепловые машины, понятие термического к.П.Д.,
- •3.1.9.2. Цикл Карно
- •3.1.10. Второе начало термодинамики
- •3.1.11. Термодинамические циклы двигателей внутреннего сгорания
- •3.1.11.1. Циклы поршневых двигателей внутреннего сгорания
- •3.1.11.2. Циклы газотурбинных установок
- •3.1.12. Типовые задачи к разделам курса «термодинамика»
- •3.1.12.1. Параметры, уравнение состояния идеального газа
- •3.1.12.2. Газовые смеси
- •3.1.12.3. Первое начало термодинамики
- •3.1.12.4. Процессы изменения состояния вещества
- •3.1.12.5. Термодинамические циклы
- •4.1.Теплопередача
- •4.1.1. Теплопередача, её предмет и метод, формы передачи теплоты
- •4.2. Теплопроводность
- •4.2.1. Температурное поле
- •4.2.2. Температурный градиент
- •4.2.3. Тепловой поток. Закон Фурье
- •4.2.4. Коэффициент теплопроводности
- •4.2.5. Дифференциальные уравнения теплопроводности
- •4.2.6. Условия однозначности для процессов теплопроводности
- •4.2.7. Отдельные задачи теплопроводности при стационарном режиме
- •4.3. Конвективный теплообмен
- •4.3.1. Основные понятия и определения
- •4.3.2. Теория размерностей
- •Размерности и показатели степени при конвективном теплообмене
- •4.3.3. Теория подобия
- •4.3.4. Критериальные уравнения
- •4.3.5. Некоторые случаи теплообмена
- •4.3.6. Расчетные зависимости конвективного теплообмена
- •4.3.7. Теплообмен при естественной конвекции
- •4.3.8. Теплоотдача при вынужденном движении жидкости в трубах и каналах
- •4.3.9. Теплоотдача при поперечном обтекании труб
- •4.4. Тепловое излучение
- •4.4.1. Основные понятия и определения
- •4.4.2. Виды лучистых потоков
- •4.4.3. Законы теплового излучения
- •4.4.4. Особенности излучения паров и реальных газов
- •4.5. Теплопередача
- •4.5.1. Теплопередача между двумя теплоносителями через разделяющую их стенку
- •4.5.2. Оптимизация (регулирование) процесса теплопередачи
- •4.5.3. Теплопередача при переменных температурах (расчет теплообменных аппаратов)
- •5. Лабораторные работы
- •5.1. Введение
- •5.2. Порядок проведения лабораторных работ
- •5.3 . Основные обозначения
- •5.4 Лабораторная работа №1
- •5.4.1. Цель работы
- •5.4.2. Задание
- •5.4.3. Экспериментальная установка
- •4.4.4. Порядок проведения опытов и обработка результатов эксперимента
- •5.4.5. Содержание отчета
- •5.4.6. Вопросы для самостоятельной проверки
- •5.4.7. Защита лабораторной работы №1
- •5.5.4. Схема экспериментальной установки
- •5.5.5. Порядок проведения опытов и обработка результатов
- •5.6.2. Краткое теоретическое введение
- •5.6.3. Экспериментальная установка
- •5.6.4. Порядок проведения опытов и обработка результатов.
- •5.7. Лабораторная работа №4
- •5.7.1. Цель работы
- •5.7.2. Задание
- •5.7.3. Порядок выполнения работы
- •5.8.Приложения
- •6. Контрольные вопросы (тесты) к лабораторным работам
- •6.1. Теплопроводность
- •6.2. Конвективный теплообмен
- •6.3. Теплообмен излучением
- •Литература
- •Содержание Введение 3
- •Теплотехника Учебно-методический комплекс
- •Заказ № Уч. – изд. Л. 9,4
- •«Тюменский государственный нефтегазовый университет»
- •625000, Тюмень, ул. Володарского, 38
- •625000, Тюмень, ул. Володарского, 38
3.1.12. Типовые задачи к разделам курса «термодинамика»
3.1.12.1. Параметры, уравнение состояния идеального газа
Задача 1. Ртутный вакууметр, присоединенный к сосуду с метаном СН4, показывает разряжение 0,056 МПа. Атмосферное давление по ртутному барометру составляет 768 мм рт. ст. (0,102 МПа). Определить абсолютное давление в сосуде и плотность метана, если температура в сосуде равна 20С. Показания вакуумметра и барометра приведены к температуре 0С.
Решение. Абсолютное давление в сосуде определяется по формуле Рабс=В0Рвак=0,1020,056=0,046 МПа. Плотность газа находим из уравнения состояния, предварительно определив газовую постоянную:
![]()
![]()
Задача 2. Баллон с кислородом емкостью 20 л находится под давлением 1,0 МПа при t=15С. После израсходования части кислорода давление понизилось до 0,76 МПа, а температура уменьшилась до 10С. Определить массу израсходованного кислорода.
Решение. Из уравнения состояния PV=GRT находим, что до расходования кислорода его масса в баллоне была равна:
![]()
![]()
После израсходования части кислорода масса его в баллоне будет равна:
![]()
следовательно, расход кислорода составит:
![]()
Задача 3. Определить удельный объем пропана (С3Н8) как идеального газа при следующих условиях: температура газа t=20С, манометрическое давление газа в баллоне 5,6 МПа, абсолютное давление газа в помещении равно 0,099 МПа.
Решение. Абсолютное давление газа в баллоне
Рабс=Рман+В0=5,6+0,099=5,699 МПа;
удельная газовая постоянная пропана
![]()
абсолютная температура газа
Т=273+20=293 К;
удельный объем пропана в рассматриваемых условиях
![]()
удельный молярный объем пропана при тех же условиях равен:
![]()
или, что то же самое:
![]()
3.1.12.2. Газовые смеси
Задача 1. По данным анализа установлен следующий объемный состав природного газа: СН4=96%; С2Н6=3%; С3Н8=0,3%; С4Н10=0,2%; СО2=0,1%; N2=0,4%. Определить среднюю молекулярную массу природного газа (m), плотность газа в нормальных условиях (), массовые концентрации компонентов (mi), их парциальные давления (Pi), средние теплоемкости (Сpm, Cvm) и показатель адиабаты.
Решение. Молекулярные массы составляющих смеси газов находим по данным физических характеристик компонентов газа из справочных таблиц:
![]() =16,04;
=16,04;
![]() =30,07;
=30,07;
![]() =44,09;
=44,09;
![]() =58,12;
=58,12;
![]() =44,01;
=44,01;
![]() =28,02.
=28,02.
Молекулярная масса природного газа определяется по уравнению

где i — молекулярная масса компонентов смеси;
ri — молярная (объемная) концентрация компонентов смеси;
mi — массовая концентрация компонентов смеси.
Так как в условии задачи дан объемный состав газа, то удобнее воспользоваться первым уравнением соотношения:
![]() =0,9616,04+0,0330,07+0,00344,09+0,00258,12+
=0,9616,04+0,0330,07+0,00344,09+0,00258,12+
+0,00144,01+0,00428,02=16,704 (кг/кмоль).
Плотность газа при нормальных условиях (0С и 0,1 МПа) можно определить из уравнения Клапейрона PV=RT или из закона Авогадро, утверждающего, что удельный молярный объем газа в нормальных условиях- величина постоянная и равна:
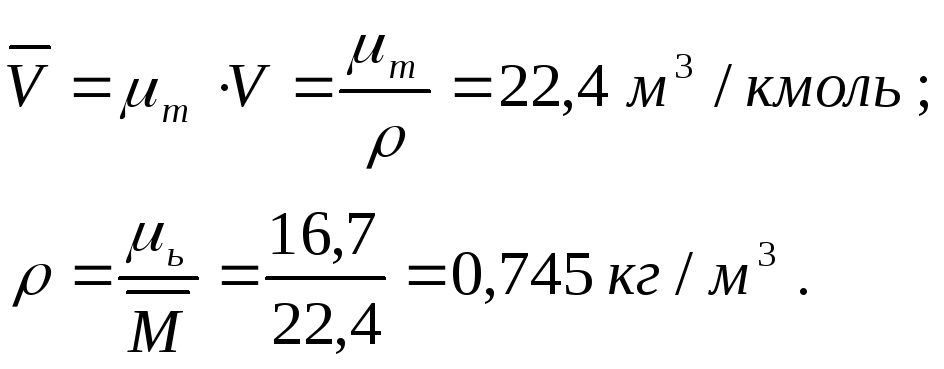
Из уравнения Клапейрона при t=0C и Р=0,1 МПа
![]()
где
![]()
Массовые и объемные концентрации газа связаны между собой соотношением
![]() отсюда
отсюда
![]()
cледовательно, массовые концентрации отдельных компонентов смеси равны:

Сумма массовых концентраций, как и молярных (объемных), равна единице:
![]()
Парциальные давления отдельных компонентов газа определяются по закону Дальтона из соотношения Pi=riP. Находим давление каждого компонента, входящего в смесь:
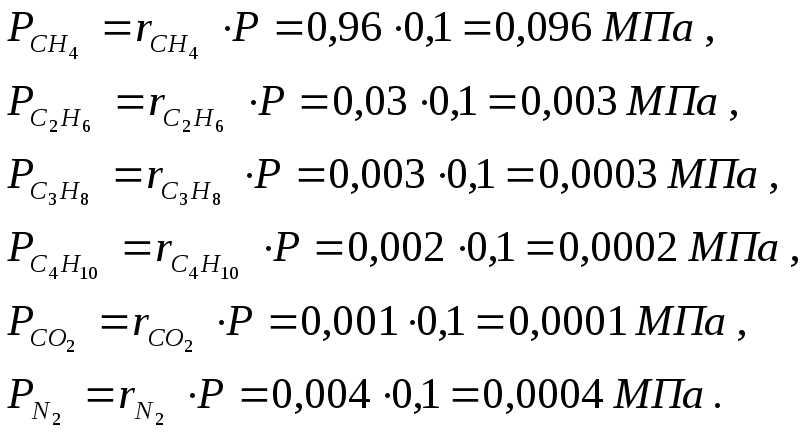
Сумма парциальных давлений равна давлению смеси:
![]()
Средняя теплоемкость смеси определяется по уравнениям:
массовая теплоемкость смеси:
![]()
молярная теплоемкость смеси:
![]()
где ![]() — массовая теплоемкость компонентов
смеси при данной температуре;
— массовая теплоемкость компонентов
смеси при данной температуре;
![]() — молярная теплоемкость компонентов
смеси при данной температуре.
— молярная теплоемкость компонентов
смеси при данной температуре.
При температуре 0С
и давлении 0,1 МПа можно принять, что
теплоемкость метана
![]() = 2,17 кДж/(кгК); этана
= 2,17 кДж/(кгК); этана
![]() = 1,65 кДж/(кгК); пропана
= 1,65 кДж/(кгК); пропана
![]() = 1,56 кДж/(кгК); бутана
= 1,56 кДж/(кгК); бутана
![]() = 1,58 кДж/(кгК);
углекислого газа
= 1,58 кДж/(кгК);
углекислого газа
![]() = 0,815 кДж/(кгК); азота
= 0,815 кДж/(кгК); азота
![]() = 1,039 кДж/(кгК).
Следовательно, массовая теплоемкость
смеси при постоянном давлении равна:
= 1,039 кДж/(кгК).
Следовательно, массовая теплоемкость
смеси при постоянном давлении равна:
![]() 0,952,17+0,0561,65+0,0081,56+0,0071,58+
0,952,17+0,0561,65+0,0081,56+0,0071,58+
+0,00270,815+0,00691,039=2,18 кДж/(кгК).
Молярная теплоемкость смеси газов при постоянном давлении
![]() кДж/(кмольК).
кДж/(кмольК).
Из уравнения Майера
![]() можно определить теплоемкость смеси
при постоянном объеме:
можно определить теплоемкость смеси
при постоянном объеме:
![]() кДж/(кгК);
кДж/(кгК);
![]() кДж/кгК.
кДж/кгК.
Показатель адиабаты природного газа указанного состава (как идеального газа)
![]()
Задача 2. До какого давления необходимо сжать смесь газов, состоящую по весу из СО2=12%, О2=8%, N2=80%, чтобы при температуре t=20С ее плотность была 1,6 кг/м3.
Решение. Находим молекулярную массу смеси через массовые концентрации компонентов смеси:
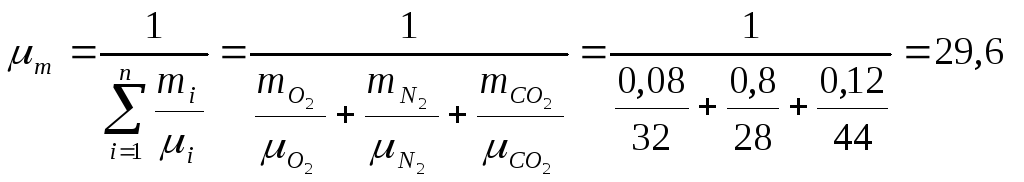 кг/кмоль.
кг/кмоль.
Давление смеси определим из уравнения
состояния
![]() :
:
![]() МПа.
МПа.
Задача 3. Определить весовой состав
газовой смеси, состоящей из углекислоты
СО2 и азота N2,
если известно, что парциальное давление
углекислого газа
![]() =1,1 ат, а давление смеси равно 3 ат.
=1,1 ат, а давление смеси равно 3 ат.
Решение. Определим парциальное давление азота:
![]() ат.
ат.
Объемная концентрация азота по закону Дальтона
![]()
Объемная концентрация углекислого газа
![]()
Молекулярная масса смеси
![]() кг/кмоль.
кг/кмоль.
Используя соотношение i/m=mi/ri, определим весовую концентрацию азота и углекислого газа:

Проверка:
![]()
