
- •1. Загальні поняття фізики
- •1.1.3. Фундаментальні типи взаємодії у природі
- •1.1.4. Фундаментальні закони збереження
- •1.1.5. Основні розділи фізики
- •2. Основи кінематики
- •2.1. Кінематика поступального і обертального руху
- •2.1.2.Пoняття мaтepiaльнoї тoчки тa aбcoлютнo твepдoгo тiлa
- •2.1.4. Система вiдлiку. Положення матеріальної тoчки у просторі
- •2.1.5.Швидкість поступального руху. Закон додавання швидкостей
- •2.1.7. Кінематика обертального руху
- •3. Динаміка матеріальної точки
- •3.1. Динаміка поступального руху
- •3.1.1. Класична механіка та межі її використання
- •3.1.2. Поняття сили, маси, імпульсу. Перший, другий, третій закони Ньютона
- •3.1.3. Принцип відносності Галілея
- •3.1.4. Закон збереження імпульсу
- •3.1.5. Реактивний рух
- •3.2. Енергія і робота
- •3.2.1. Енергія, робота, потужність
- •3.2.2. Енергія кінетична. Енергія потенціальна
- •3.2.3.Закон збереження енергії
- •3.2.4. Зіткнення двох тіл
- •3.2.5.Рух тіла відносно неінерціальної системи відліку. Сили інерції. Відцентрова сила. Сила Коріоліса
- •4. Обертальний рух твердого тіла
- •4.1. Момент сили. Момент імпульсу
- •4.1.1. Тверде тіло як система матеріальних точок
- •4.1.2.А. Момент сили і пари сил відносно точки
- •4.1.2.Б. Момент сили відносно осі
- •4.1.2.В. Момент імпульсу матеріальної точки
- •4.1.3. Закон збереження моменту імпульсу
- •4.1.4. Основне рівняння динаміки обертального руху
- •4.2. Момент інерції. Гіроскоп
- •4.2.1. Вільні осі. Головні осі інерції
- •4.2.2. Моменти інерції різних тіл
- •4.2.3. Кінетична енергія обертального руху
- •4.2.4. Гіроскоп. Гіроскопічний ефект. Процесія гіроскопа
- •4.3. Всесвітнє тяжіння
- •4.3.1. Закон всесвітнього тяжіння. Вільне падіння тіл
- •4.3.2. Гравітаційне поле і його характеристики
- •4.3.3. Маса гравітаційна і маса інертна
- •4.3.4. Перша та друга космічні швидкості
- •5. Релятивістська механіка
- •5.1. Елементи релятивістської механіки
- •5.1.1. Зв’язок і відхилення від законів Ньютона
- •5.1.2. Постулати Ейнштейна
- •5.1.3. Перетворення Лоренца
- •5.1.4. Висновки з перетворень Лоренца
- •5.1.5.Основи релятивістської динаміки: імпульс, маса, зв’язок маси і енергії, частинка з нульовою масою
- •6. Коливальний рух
- •6.1. Вільні незгасаючі гармонічні коливання
- •6.1.1. Загальні відомості про коливання
- •6.1.2. Вільні незгасаючі гармонічні коливання
- •6.1.3. Енергія коливального руху
- •6.2. Складання коливань
- •6.2.1. Векторна діаграма. Складання коливань одного напрямку
- •6.2.2. Складання взаємно-перпендикулярних коливань
- •6.3. Згасаючі та вимушені коливання
- •6.3.1. Згасаючі коливання. Добротність
- •6.3.2. Вимушені коливання
- •6.3.3. Резонанс
- •1. Основні значення і поняття. Основи мкт газів і термодинаміки
- •1.1.2. Макроскопічні параметри і їх мікроскопічна трактовка
- •1.1.3. Закони ідеальних газів
- •1.1.4. Рівняння стану ідеального газу
- •1.1.5. Основне рівняння мкт газів
- •1.1.6. Температура. Поняття температури
- •1.2. Перший закон термодинаміки
- •1.2.1. Внутрішня енергія термодинамічної системи
- •1.2.2. Теплота. Робота. Теплоємність
- •1.2.2. Перший закон термодинаміки
- •1.2.4. Ізопроцеси в ідеальних газах
- •1.2.4.А. Ізотермічний
- •1.2.4.Б. Ізобарний
- •1.2.4.В. Ізохорний
- •1.2.4.Г. Адіабатичний
- •1.3. Другий закон термодинаміки
- •1.3.1. Кругові процеси
- •1.3.2. Цикли Карно
- •1.3.2.А. Прямий обернений цикл Карно
- •1.3.2.Б. Обернений рівновісний цикл Карно
- •1.3.2.В. Необернений цикл Карно
- •1.3.3. Нерівність Клаузіуса
- •1.3.4. Ентропія та її властивості
- •1.3.5. Другий закон термодинаміки
- •1.4. Термодинамічний потенціал. Теорема Нернста
- •1.4.1. Внутрішня енергія
- •1.4.2. Енергія Гальм-Гольца
- •1.4.3. Ентальпія
- •1.4.4. Потенціал Гіббса
- •1.4.4. Теорема Нернста. Третій закон термодинаміки
- •2.1. Кристали та їх властивості
- •2.1.1. Будова кристалу
- •2.1.2. Класи і типи кристалів
- •2.1.3. Дефекти в кристалах
- •2.1.4. Теплоємність кристалів
- •2.2. Рідини та їх властивості
- •2.2.1. Будова рідини
- •2.2.2. Поверхневий натяг
- •2.2.3. Явища на межі рідини і твердого тіла
- •2.2.4. Капілярні явища
- •2.3. Фазові переходи
- •2.3.1. Фаза, фазові переходи
- •2.3.2. Випаровування, плавлення, конденсація, кристалізація
- •2.3.3. Рівняння Клайперона-Клаузіуса
- •2.3.4. Потрійна точка. Діаграма стану
- •2.4. Розподіл молекул газу за енергіями
- •2.4.1. Закон розподілу Больцмана
- •2.4.2. Закон розподілу Максвела
- •2.4.3. Закон розподілу Максвела-Больцмана
- •Частина 1. Електростатика і магнетизм Розділ 1. Електростатичне поле у вакуумі
- •§1. Постійний електричний струм
- •§2. Опис векторного поля
- •§ 3. Обчислення напруженості поля на підставі теореми Гауса
- •Розділ 2. Діелектрик в зовнішньому електричному полі
- •§4. Діелектрик в зовнішньому електричному полі
- •Розділ 3. Провідник в зовнішньому електростатичному полі
- •§5. Провідник в зовнішньому електростатичному полі
- •Розділ 4. Енергія електростатичного поля
- •§6. Енергія електростатичного поля
- •Розділ 5. Постійний електричний струм
- •§7. Постійний електричний струм та його характеристики.
- •§8. Класична електронна теорія електропровідності металів
- •Розділ 6. Контактна і об’ємна різниця потенціалів
- •§9. Робота виходу електрона
- •Розділ 7.Електричний струм у рідинах
- •§10. Електричний струм у рідинах
- •Розділ 8. Електричний струм у газах
- •§11. Електричний струм у газах
- •Частина 2. Електромагнетизм Розділ 1. Магнітне поле у вакуумі
- •§1. Магнітне поле і його характеристики
- •§ 2. Закон повного струму
- •§ 3. Контур зі струмом в зовнішньому магнітному полі
- •Розділ 2. Магнітне поле в речовині
- •§ 4. Магнітне поле в магнетиках
- •§ 5. Класифікація магнетиків
- •Розділ 3. Електромагнітна індукція
- •§ 6. Електромагнітна індукція
- •Розділ 4. Електричні коливання
- •§ 7. Електричні коливання
- •Розділ 5. Система рівнянь Максвела
- •§ 8. Електромагнітне поле
1.2.2. Перший закон термодинаміки
(закон збереження енергії для систем, в яких основну роль грають теплові процеси)
Якщо
термодинамічній системі надати зовні
деяку кількість теплоти
![]() і виконати на цією системою роботу
і виконати на цією системою роботу![]() зовнішніми силами, то внутрішня енергія
цієї системи зміниться на величину
зовнішніми силами, то внутрішня енергія
цієї системи зміниться на величину![]() ,
яка чисельно дорівнює:
,
яка чисельно дорівнює:
![]() . (11)
. (11)
Робота
![]() зовнішніх сил над системою дорівнює по
величині і протилежна за знаком деякій
роботі
зовнішніх сил над системою дорівнює по
величині і протилежна за знаком деякій
роботі![]() ,
яка здійснюється системою проти зовнішніх
сил, тобто:
,
яка здійснюється системою проти зовнішніх
сил, тобто:
![]() .
.
З урахуванням цього, рівняння (11) запишемо:
![]() . (12)
. (12)
Для нескінченно малої зміни стану системи можна записати:
![]() . (13)
. (13)
Дане рівняння – математичний запис першого початку термодинаміки.
За першим законом термодинаміки: теплота, надана системі витрачається на зміну внутрішньої енергії системи і на здійснення системою роботи проти зовнішніх сил.
Для визначення кругових процесів, коли система набуває ряд змін і повертається у початковий стан (положення):
![]() ,
,
тому перший закон термодинаміки:
![]() .
.
Це твердження (перший закон термодинаміки) було сформоване Гальм-Гольцем у 1747 році.
Якщо система здійснює круговий процес, то повна кількість теплоти, яка надається системі, дорівнює здійсненій в ній роботі. З рівняння (13) випливає, що у випадку кругових процесів:
![]()
Перший початок термодинаміки стверджує: неможливий процес, єдиним результатом якого було б виконання роботи без яких-небудь змін в інших тілах. Іншими словами, неможливий вічний двигун першого роду.
Усі формулювання першого закону термодинаміки виражають закон збереження енергії. У випадку теплового процесу для однорідних тіл, здатних виконувати роботу при зміні об’єму, запишемо:
![]() . (14)
. (14)
Якщо враховувати рівняння (10), запишемо:
![]() . (15)
. (15)
1.2.4. Ізопроцеси в ідеальних газах
1.2.4.А. Ізотермічний
Ізотермічний
процес здійснюється при сталій температурі
системи (Т=const),
при m=const,
n=const.
При
![]() ,
рівняння Менделєєва-Клайперона запишемо:
,
рівняння Менделєєва-Клайперона запишемо:
pV=const. (16)


Рис. 3
Ізотермічні процеси відбуваються досить повільно. При цьому поняття температури не втрачає сенсу. Стискаємість ідеального газу при T=const характеризується ізотермічним коефіцієнтом стискаємості χ, який визначається як відносна зміна об’єму, що зумовлює зміну тиску на одиницю:
![]() ,
(17)
,
(17)
де V – початковий об’єм;
![]() - зміна
об’єму, яка зумовлює зміну тиску на
- зміна
об’єму, яка зумовлює зміну тиску на
![]() .
.
Знайдемо коефіцієнт χ для ідеального газу. Продиференціювавши (16) при T=const, дістанемо:
![]() ,
,
звідси:
![]() (18)
(18)
![]() ,
,
тобто
при
![]() ,
тоді
,
тоді![]() ,
,![]() .
.
Для реалізації ізотермічного процесу треба забезпечити ідеальний тепловий контакт між газом і термостатом (тілом, що має сталу температуру).
Оскільки
![]() ,
то перший закон термодинаміки для
ізотермічного процесу:
,
то перший закон термодинаміки для
ізотермічного процесу:
![]() . (19)
. (19)
Роботу
![]() визначають:
визначають:
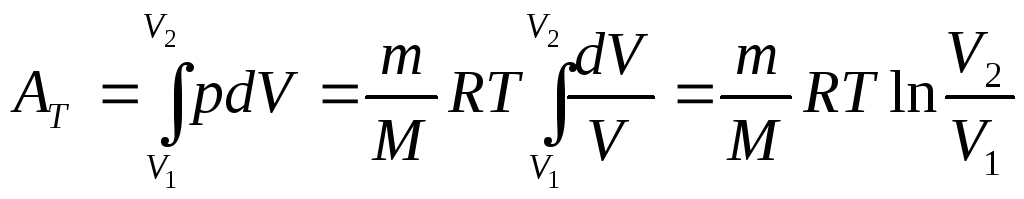 . (20)
. (20)
З урахуванням (20), рівняння (19) перепишемо так:
![]() . (21)
. (21)
1.2.4.Б. Ізобарний
Ізобарний процес відбувається в системі при сталому тиску (P=const).



Рис. 4
Такий процес можна здійснити, коли газ, наприклад, міститься в циліндрі з рухомим поршнем. Зміна температури газу в такому циліндрі зумовлює переміщення поршня, тобто зміну об’єму. Тиск при цьому залишається сталим:
![]() . (22)
. (22)
Це рівняння ізобарного процесу, виражає закон Гей-Люссака:
![]() ,
,
![]() -
коефіцієнт об’ємного розширення газу,
-
коефіцієнт об’ємного розширення газу,![]() =
0,003661
=
0,003661![]() .
.
Аналогічно, коефіцієнт χ:
![]() .
.
Розглянемо
графік p(V):
газ, поміщений в циліндр із вільно-рухомим
поршнем, під час нагрівання![]() або під час охолодження
або під час охолодження![]() здійснює
ізобарний процес.
здійснює
ізобарний процес.
Елементарна робота:
![]() (23)
(23)
є повним диференціалом деякої функції. Оскільки p=const, то робота є однозначною функцією параметрів початкового і кінцевого станів системи (параметр V). Звідси:
 . (24)
. (24)
Диференціюючи рівняння Менделєєва-Клайперона при сталому тиску, одержимо:
![]() ,
,
тоді:
![]() .
.
Кількість
теплоти, якою газ обмінюється в ізобарному
процесі при незалежності
![]() від
температури:
від
температури:
![]() . (25)
. (25)
Кількість
теплоти
![]() йде
не тільки на збереження внутрішньої
енергії, а й на виконання роботи щодо
розширення газу:
йде
не тільки на збереження внутрішньої
енергії, а й на виконання роботи щодо
розширення газу:
![]() (26)
(26)
