
- •1. Загальні поняття фізики
- •1.1.3. Фундаментальні типи взаємодії у природі
- •1.1.4. Фундаментальні закони збереження
- •1.1.5. Основні розділи фізики
- •2. Основи кінематики
- •2.1. Кінематика поступального і обертального руху
- •2.1.2.Пoняття мaтepiaльнoї тoчки тa aбcoлютнo твepдoгo тiлa
- •2.1.4. Система вiдлiку. Положення матеріальної тoчки у просторі
- •2.1.5.Швидкість поступального руху. Закон додавання швидкостей
- •2.1.7. Кінематика обертального руху
- •3. Динаміка матеріальної точки
- •3.1. Динаміка поступального руху
- •3.1.1. Класична механіка та межі її використання
- •3.1.2. Поняття сили, маси, імпульсу. Перший, другий, третій закони Ньютона
- •3.1.3. Принцип відносності Галілея
- •3.1.4. Закон збереження імпульсу
- •3.1.5. Реактивний рух
- •3.2. Енергія і робота
- •3.2.1. Енергія, робота, потужність
- •3.2.2. Енергія кінетична. Енергія потенціальна
- •3.2.3.Закон збереження енергії
- •3.2.4. Зіткнення двох тіл
- •3.2.5.Рух тіла відносно неінерціальної системи відліку. Сили інерції. Відцентрова сила. Сила Коріоліса
- •4. Обертальний рух твердого тіла
- •4.1. Момент сили. Момент імпульсу
- •4.1.1. Тверде тіло як система матеріальних точок
- •4.1.2.А. Момент сили і пари сил відносно точки
- •4.1.2.Б. Момент сили відносно осі
- •4.1.2.В. Момент імпульсу матеріальної точки
- •4.1.3. Закон збереження моменту імпульсу
- •4.1.4. Основне рівняння динаміки обертального руху
- •4.2. Момент інерції. Гіроскоп
- •4.2.1. Вільні осі. Головні осі інерції
- •4.2.2. Моменти інерції різних тіл
- •4.2.3. Кінетична енергія обертального руху
- •4.2.4. Гіроскоп. Гіроскопічний ефект. Процесія гіроскопа
- •4.3. Всесвітнє тяжіння
- •4.3.1. Закон всесвітнього тяжіння. Вільне падіння тіл
- •4.3.2. Гравітаційне поле і його характеристики
- •4.3.3. Маса гравітаційна і маса інертна
- •4.3.4. Перша та друга космічні швидкості
- •5. Релятивістська механіка
- •5.1. Елементи релятивістської механіки
- •5.1.1. Зв’язок і відхилення від законів Ньютона
- •5.1.2. Постулати Ейнштейна
- •5.1.3. Перетворення Лоренца
- •5.1.4. Висновки з перетворень Лоренца
- •5.1.5.Основи релятивістської динаміки: імпульс, маса, зв’язок маси і енергії, частинка з нульовою масою
- •6. Коливальний рух
- •6.1. Вільні незгасаючі гармонічні коливання
- •6.1.1. Загальні відомості про коливання
- •6.1.2. Вільні незгасаючі гармонічні коливання
- •6.1.3. Енергія коливального руху
- •6.2. Складання коливань
- •6.2.1. Векторна діаграма. Складання коливань одного напрямку
- •6.2.2. Складання взаємно-перпендикулярних коливань
- •6.3. Згасаючі та вимушені коливання
- •6.3.1. Згасаючі коливання. Добротність
- •6.3.2. Вимушені коливання
- •6.3.3. Резонанс
- •1. Основні значення і поняття. Основи мкт газів і термодинаміки
- •1.1.2. Макроскопічні параметри і їх мікроскопічна трактовка
- •1.1.3. Закони ідеальних газів
- •1.1.4. Рівняння стану ідеального газу
- •1.1.5. Основне рівняння мкт газів
- •1.1.6. Температура. Поняття температури
- •1.2. Перший закон термодинаміки
- •1.2.1. Внутрішня енергія термодинамічної системи
- •1.2.2. Теплота. Робота. Теплоємність
- •1.2.2. Перший закон термодинаміки
- •1.2.4. Ізопроцеси в ідеальних газах
- •1.2.4.А. Ізотермічний
- •1.2.4.Б. Ізобарний
- •1.2.4.В. Ізохорний
- •1.2.4.Г. Адіабатичний
- •1.3. Другий закон термодинаміки
- •1.3.1. Кругові процеси
- •1.3.2. Цикли Карно
- •1.3.2.А. Прямий обернений цикл Карно
- •1.3.2.Б. Обернений рівновісний цикл Карно
- •1.3.2.В. Необернений цикл Карно
- •1.3.3. Нерівність Клаузіуса
- •1.3.4. Ентропія та її властивості
- •1.3.5. Другий закон термодинаміки
- •1.4. Термодинамічний потенціал. Теорема Нернста
- •1.4.1. Внутрішня енергія
- •1.4.2. Енергія Гальм-Гольца
- •1.4.3. Ентальпія
- •1.4.4. Потенціал Гіббса
- •1.4.4. Теорема Нернста. Третій закон термодинаміки
- •2.1. Кристали та їх властивості
- •2.1.1. Будова кристалу
- •2.1.2. Класи і типи кристалів
- •2.1.3. Дефекти в кристалах
- •2.1.4. Теплоємність кристалів
- •2.2. Рідини та їх властивості
- •2.2.1. Будова рідини
- •2.2.2. Поверхневий натяг
- •2.2.3. Явища на межі рідини і твердого тіла
- •2.2.4. Капілярні явища
- •2.3. Фазові переходи
- •2.3.1. Фаза, фазові переходи
- •2.3.2. Випаровування, плавлення, конденсація, кристалізація
- •2.3.3. Рівняння Клайперона-Клаузіуса
- •2.3.4. Потрійна точка. Діаграма стану
- •2.4. Розподіл молекул газу за енергіями
- •2.4.1. Закон розподілу Больцмана
- •2.4.2. Закон розподілу Максвела
- •2.4.3. Закон розподілу Максвела-Больцмана
- •Частина 1. Електростатика і магнетизм Розділ 1. Електростатичне поле у вакуумі
- •§1. Постійний електричний струм
- •§2. Опис векторного поля
- •§ 3. Обчислення напруженості поля на підставі теореми Гауса
- •Розділ 2. Діелектрик в зовнішньому електричному полі
- •§4. Діелектрик в зовнішньому електричному полі
- •Розділ 3. Провідник в зовнішньому електростатичному полі
- •§5. Провідник в зовнішньому електростатичному полі
- •Розділ 4. Енергія електростатичного поля
- •§6. Енергія електростатичного поля
- •Розділ 5. Постійний електричний струм
- •§7. Постійний електричний струм та його характеристики.
- •§8. Класична електронна теорія електропровідності металів
- •Розділ 6. Контактна і об’ємна різниця потенціалів
- •§9. Робота виходу електрона
- •Розділ 7.Електричний струм у рідинах
- •§10. Електричний струм у рідинах
- •Розділ 8. Електричний струм у газах
- •§11. Електричний струм у газах
- •Частина 2. Електромагнетизм Розділ 1. Магнітне поле у вакуумі
- •§1. Магнітне поле і його характеристики
- •§ 2. Закон повного струму
- •§ 3. Контур зі струмом в зовнішньому магнітному полі
- •Розділ 2. Магнітне поле в речовині
- •§ 4. Магнітне поле в магнетиках
- •§ 5. Класифікація магнетиків
- •Розділ 3. Електромагнітна індукція
- •§ 6. Електромагнітна індукція
- •Розділ 4. Електричні коливання
- •§ 7. Електричні коливання
- •Розділ 5. Система рівнянь Максвела
- •§ 8. Електромагнітне поле
1.1.3. Закони ідеальних газів
Характеристики ідеального газу:
концентрація молекул приблизно
 ;
;середня відстань між молекулами
 ;
;сумарний власний об’єм молекули, що знаходяться в
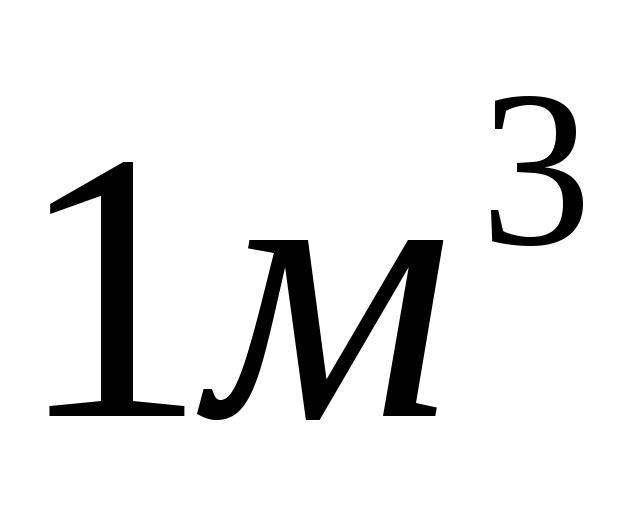 газу складає
газу складає (даним
об’ємом можна знехтувати).
(даним
об’ємом можна знехтувати).
На основі експериментів з такими газами було встановлено ряд закономірностей, які виконувались для ідеальних газів обов’язково, а для реальних газів можуть бути виконані лише при певних умовах (не дуже високих температурах і відносно низькому тиску, простій структурі, малих розмірах і низькій концентрації).
Закон Бойля-Маріотта (1662р.).
При постійній температурі об’єм даної маси газу обернено пропорційний його тиску:
![]() , (1)
, (1)
c – постійна величина, пропорційна кількості молів газу і його абсолютній температурі.
Закон Гей-Люссака (1802р.).
Об’єм даної маси газу при постійному тиску змінюється лінійно з температурою:
![]() , (2)
, (2)
![]() ,
,
![]() - об’єми газу при температуріT
і 0
- об’єми газу при температуріT
і 0![]() ;
;
![]() - термічний
коефіцієнт розширення при постійному
тиску.
- термічний
коефіцієнт розширення при постійному
тиску.
Для всіх газів при нормальних умовах:
![]() . (3)
. (3)
За абсолютною шкалою температур:
![]() . (4)
. (4)
Закон Шарля (1787р.).
Тиск даної маси газу при постійному об’ємі змінюється лінійно з температурою:
![]() , (5)
, (5)
![]() - тиски
газу при температурі Т і 0
- тиски
газу при температурі Т і 0![]() ;
;
![]() - термічний
коефіцієнт тиску при постійному об’ємі.
- термічний
коефіцієнт тиску при постійному об’ємі.
Для всіх
газів при нормальних умовах![]() .
.
За абсолютною шкалою температур:
![]() . (6)
. (6)
Закон Авогадро.
Гей-Люссак сформулював закон з’єднаних об’ємів для газів: об’єм газів, що реагують або що утворюються у результаті хімічних реакцій, знаходяться у відношеннях невеликих цілих чисел. Авогадро висунув гіпотезу, що в рівних об’ємах різних газів при однаковій температурі і тиску знаходиться однакове число молекул.
Один моль будь-якого газу, який є подібним до ідеального газу при однаковій температурі і тиску, займає однаковий об’єм.
При нормальних умовах даний об’єм:
![]() .
.
1.1.4. Рівняння стану ідеального газу
Об’єм даної маси газу є функцією від p і T:
![]() ,
,
тоді
повний диференціал![]() визначається
як похідна:
визначається
як похідна:
![]() . (7)
. (7)
Рівняння (4) запишемо у вигляді:
![]() ,
,
тоді з рівнянь (1) і (.4):
 (8)
(8)
Якщо підставити рівняння (8) у рівняння (7), то отримаємо:
![]() . (9)
. (9)
Якщо проінтегрувати, то:
![]() . (10)
. (10)
Потенціюючи дане рівняння, отримаємо:
![]() . (11)
. (11)
Дане рівняння було отримане французьким фізиком Клайпероном у1834році. У 1884 році Менделєєв придав рівнянню (11) універсального вигляду, записавши його для 1 моль газу з об’ємом V:
![]() , (12)
, (12)
![]() - постійна
величина, універсальна газова стала:
- постійна
величина, універсальна газова стала:
![]() .
.
Якщо
помножити (12) на кількість молів![]() ,
отримаємо рівняння стану ідеального
газу для довільної маси:
,
отримаємо рівняння стану ідеального
газу для довільної маси:
 (13)
(13)
Останнє рівняння – рівняння Менделєєва-Клайперона.
1.1.5. Основне рівняння мкт газів
(тиск газу з точки зору МКТ)
Для ідеального газу розмірами молекул та зіткненнями між ними можна знехтувати. Потрібно враховувати зіткнення молекул зі стінками посудини.
Нехай газ знаходиться в посудині , що має форму прямокутного паралелепіпеда, стінки якого ідеально-відображаючі:

Рис. 3
Розрахуємо тиск газу на стінку з площею S. При зіткненні молекули газу зі стінкою посудини, зміниться складова, що перпендикулярна до грані. Відповідна зміна імпульсу молекули при одиничному зіткненні її зі стінками:
![]() .
.
За одиницю часу молекула здійснює z таких ударів:
![]() ,
,
![]() - середній
час ,за який молекула здійснює 1 удар:
- середній
час ,за який молекула здійснює 1 удар:
![]() ,
,
тоді:
![]() .
.
Відповідно з 2 і 3 законами Ньютона, результуюча сила, що діє на стінку зі сторони N молекул газу, що знаходяться в посудині дорівнює половині зміни імпульсу:
![]() . (14)
. (14)
Тиск газу на грань, яка розглядається, визначається як відношення сили, що діє на грань на площу S грані:
![]() , (15)
, (15)
V – об’єм, який займає даний газ.
Значення дії тиску на інші грані:
 (16)
(16)
Так як в стані термодинамічної рівноваги газу рух молекул у всіх напрямках буде рівномірним, то:
![]()
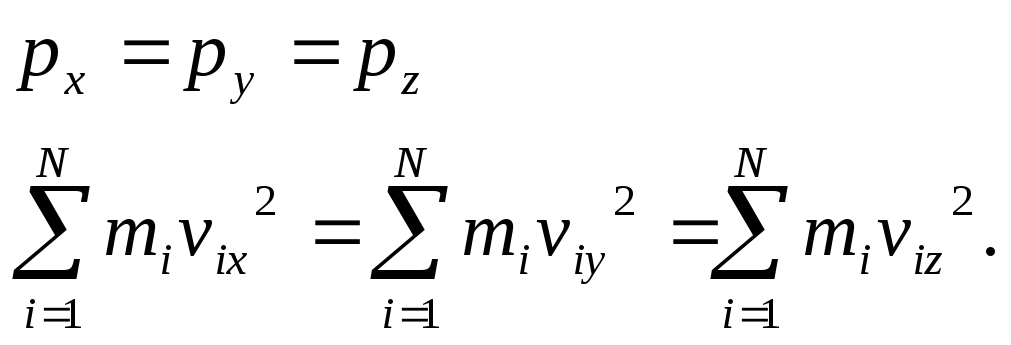
Згідно з теоремою Піфагора:
![]() ,
,
тоді можна записати:
![]() .
.
Для кожної з цих складових:
![]() ,
,
тому тиск газу на стінки посудини визначається за формулою:
![]() , (17)
, (17)
![]() - кінетична
енергія усіх молекул газу.
- кінетична
енергія усіх молекул газу.
Для однорідного газу маса усіх молекул однакова, а швидкості – різні, тому рівняння для тиску:
 , (18)
, (18)
n - концентрація молекул в одиниці об’єму.
Рівняння (17) і (18) використовуються в релятивістському і нерелятивістському русі, але в релятивістському русі необхідно враховувати залежність маси від швидкості руху.
