
- •1.Система отсчёта и системы координат. Основные характеристики механического движения. Прямолинейное и криволинейное движение материальной точки. Скорость и ускорение.
- •2. Движение материальной точки по окружности. Нормальное и тангенциальное ускорения. Связь угловых и линейных характеристик движения
- •3. Векторные величины. Сложение, вычитание и умножение векторов. Силы. Масса. Законы ньютона.
- •4.Силы при криволинейном движении.
- •5. Закон всемирного тяготения. Зависимость веса тел от высоты над уровнем моря и географической широты. Гравитационное поле
- •6. Нормальное гравитационное поле и его аномалии.
- •8.Орбитальное движение земли и ее осевое вращение. Неравномерности вращения земли, их физическая природа
- •9. Приливообразующие силы и их геофизическая роль.
- •10.Закон сохранения и изменения количества движения.
- •11.Работа силы и мощность. Кинетическая и потенциальная энергия
- •12. Гармоническое колебание и его характеристики. Математический, физический и пружинный маятники
- •13. Энергия колеблющегося тела. Собственные колебания земли. Сложение гармонических колебаний
- •14. Волна, ее характеристики. Продольные и поперечные волны. Принцип гюйгенса. Интенсивность волны
- •15. Звуквая волна, характеристики звука. Инфразвук и ультразвук. Принцип локации
- •16. Элементы механики жидкостей. Основные определения. Уравнение неразрывности.
- •17.Уравнение бернулли и его применения для определения статического и динамического давлений
- •18.Основные положения молекулярно-кинетической теории строения вещества. Межмолекулярные силы. Агрегатные состояния вещества.
- •19. Макроскопические системы. Термодинамическое равновесие. Равновесные и неравновесные процессы. Обратимые и необратимые процессы.
- •20. Газовые законы (бойля-мариотта, гей-люсака, авогадро). Уравнение состояния идеального газа
- •21. Барометрическая формула и распределение больцмана.
- •22. Явление переноса в газах и жидкостях. Диффузия в газах.
- •23. Явление переноса. Теплопроводность.
- •24. Явление переноса в газах и жидкостях. Внутреннее трение (вязкость).
- •26. Внутренняя энергия идеального газа.Работа и теплота. Закон сохранения энергии. Первое начало термодинамики.
- •27.Электрические заряды и электрическое поле
- •28. Линии напряженности. Поток вектора
- •29. Примеры вычисления напряженности электрических полей с помощью теоремы остроградского-гаусса
- •30. Потенциал и работа сил электростатического
- •31. Градиент потенциала. Связь между потенциалом и напряженностью электростатического поля
- •32. Эквипотенциальные поверхности. Изображения сечений простейших электрических полей с помощью эквопотенциальных линий. Работа при перемещении электрического заряда по эквипотенциальной поверхности
- •33. Вычисление потенциалов простейших электростатических полей. (создаваемых точечным зарядом, в плоском и шаровом конденсаторе)
- •1 .Потенциал электрического поля точечного заряда q.
- •3. Шаровой конденсатор.
- •34. Геоэлектрическое поле земли. Электрическая проводимость гидросферы, земной коры и недр
- •35. Электрическая проводимость атмосферы. Ионосфера, ионосферные слои. Влияние ионосферы на распространение радиоволн. Нормальное электрическое поле атмосферы. Техногенное воздействие на ионосферу
- •36. Электротеллурическое поле. Региональные и локальные электрические поля земной коры. Вариации меридиальной и широтной напряженности электротеллурического поля
- •37. Изучение глубинного строения Земли с помощью сейсмического зондирования
- •38. Масса, форма, размеры и строение атмосферы. Слои атмосферы и зависимость температур атмосферы от высоты
24. Явление переноса в газах и жидкостях. Внутреннее трение (вязкость).
Если в газе имеются слои, движущиеся с различными скоростями, то обмен молекулами между этими слоями будет сопровождаться переносом количества движения из одного слоя в другой. Молекулы, переходящие из более быстрого слоя в более медленный, приносят с собой избыток количества движения, который путем столкновений распределяется между молекулами этого слоя, вследствие чего медленно двигавшийся слой ускоряется. Наоборот, молекулы, проникшие в быстрый слой из более медленного, получают от молекул этого слоя некоторое количество движения. Вследствие этого более быстрый слой замедляется. Такой процесс переноса количества движения из одного слоя в другой, приводящий к выравниванию скоростей отдельных слоев, называется внутренним трением или вязкостью газа.
Если разность скоростей движения слоев газа внешними силами поддерживается постоянной, то и поток количества движения от слоя к слою будет постоянным.
Для
жидкостей характерна достаточно плотная
упаковка молекул. Поэтому каждая
молекула, постоянно сталкиваясь с
соседними молекулами, в течение некоторого
времени колеблется около определенного
положения равновесия. Время от времени
молекула, получив от соседней молекулы
достаточную энергию, скачком переходит
в новое положение равновесия. Дальность
этого скачка примерно равна размеру молекул (10-10м).
Среднее время,
в течение которого молекула колеблется
около данного положения равновесия,
называется временем оседлой жизни
молекулы. Расчеты показывают,
что![]() 0expE/(kT),(1)где0– средний период колебаний молекулы;E– минимальная энергия, которую нужно
сообщить молекуле жидкости, чтобы она
могла перейти из одного положения
равновесия в другое (Е10-20Дж);k– постоянная
Больцмана;Т– абсолютная температура
жидкости. Для воды при комнатной
температуре010-13с, а10-11с. С
повышением температуры подвижность
молекул возрастает, время оседлой жизни
уменьшается.
0expE/(kT),(1)где0– средний период колебаний молекулы;E– минимальная энергия, которую нужно
сообщить молекуле жидкости, чтобы она
могла перейти из одного положения
равновесия в другое (Е10-20Дж);k– постоянная
Больцмана;Т– абсолютная температура
жидкости. Для воды при комнатной
температуре010-13с, а10-11с. С
повышением температуры подвижность
молекул возрастает, время оседлой жизни
уменьшается.
При движении жидкости между слоями, перемещающимися с различной скоростью, возникают силы внутреннего трения (вязкости) подобно, как и в газе. Эти силы направлены так, что ускоряют медленно движущиеся слои или замедляют быстро движущиеся.
Количественно перенос количества движения между слоями, движущимися с различными скоростями, в газах и жидкостях описывается аналогичными уравнениями.
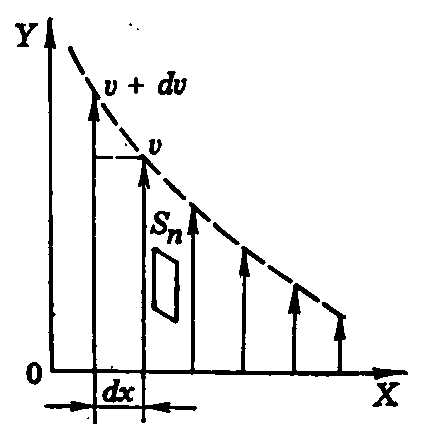
Рис. 1
Рассмотрим
ламинарный поток жидкости или газа в
направлении оси Y(рис. 1). Слои движутся с разными скоростями,
а скорости двух слоев, отстоящих друг
от друга на расстоянииdx,
отличаются наdv.
Величина![]() – градиент скорости – показывает, как
быстро изменяется скорость слоев вдоль
осиХ, здесь
– градиент скорости – показывает, как
быстро изменяется скорость слоев вдоль
осиХ, здесь![]() – единичный вектор в направлении
максимального возрастания скорости.
– единичный вектор в направлении
максимального возрастания скорости.
Ньютон
установил, что модуль силы внутреннего
трения между слоями прямо пропорционален
площади их соприкосновения и модулю
градиента скорости:![]()
![]() (2)
(2)
где – коэффициент пропорциональности, называемыйвязкостью жидкости или газа, соответственно; площадкаSnориентирована перпендикулярно к градиенту скорости.
Между слоями жидкости (или газа) будет происходить передача импульса. По 2 закону Ньютона
![]() ,
(3) где dp– величина
импульса, переносимого за времяdtот слоя к слою через поверхностьSn,
перпендикулярную к направлению переноса
импульса. Знак минус указывает, что
импульс переносится от слоев, движущихся
с большей скоростью, к слоям, движущимся
с меньшей скоростью.
,
(3) где dp– величина
импульса, переносимого за времяdtот слоя к слою через поверхностьSn,
перпендикулярную к направлению переноса
импульса. Знак минус указывает, что
импульс переносится от слоев, движущихся
с большей скоростью, к слоям, движущимся
с меньшей скоростью.
Импульс,
переносимый через единичную площадку,
расположенную перпендикулярно к
переносимому потоку импульса за единицу
времени, называется плотностью потока
импульса
![]() :
:
![]() .
(4)
.
(4)
Соотношения (2)-(4) являются различными формами записи основного закона вязкости - закона Ньютона. Физический смысл вязкостиможно определить из любого соотношения. Например, из (4) следует, что вязкостьопределяется плотностью потока импульса при градиенте скорости, равном единице.
Вязкость жидкости зависит от ее химического состава, примесей и температуры. С повышением температуры Твязкость жидкости уменьшается по закону
=АexpE/(kT). (5) Здесь коэффициентАдля каждой конкретной жидкости можно приблизительно считать постоянным.
 Рис.
2
Рис.
2
Вязкость
газов в отличие от жидкостей с повышением
температуры медленно увеличивается
(![]() ),
при критической температуреТкр.вязкости жидкости и ее пара сравниваются.
Разный характер температурной зависимости
вязкости жидкостей и газов указывает
на различие механизмов внутреннего
трения в них. В газах перенос импульса
осуществляется при переходе молекул
из слоя в слой благодаря тепловому
движению. В жидкостях большую часть
времени молекулы колеблются около
положения равновесия, скачкообразные
переходы редки. Так как молекулы жидкости
находятся близко друг к другу, силы
молекулярного сцепления между ними
значительны. Поэтому одни слои жидкости
увлекают (тормозят) соседние слои в
основном за счет сил притяжения. Перенос
импульса вследствие скачкообразных
переходов молекул не играет решающей
роли. С повышением температуры расстояния
между молекулами увеличиваются, а силы
притяжения уменьшаются и, как следствие,
уменьшается вязкость.
),
при критической температуреТкр.вязкости жидкости и ее пара сравниваются.
Разный характер температурной зависимости
вязкости жидкостей и газов указывает
на различие механизмов внутреннего
трения в них. В газах перенос импульса
осуществляется при переходе молекул
из слоя в слой благодаря тепловому
движению. В жидкостях большую часть
времени молекулы колеблются около
положения равновесия, скачкообразные
переходы редки. Так как молекулы жидкости
находятся близко друг к другу, силы
молекулярного сцепления между ними
значительны. Поэтому одни слои жидкости
увлекают (тормозят) соседние слои в
основном за счет сил притяжения. Перенос
импульса вследствие скачкообразных
переходов молекул не играет решающей
роли. С повышением температуры расстояния
между молекулами увеличиваются, а силы
притяжения уменьшаются и, как следствие,
уменьшается вязкость.
Величина/(6) называется кинематической вязкостью.
Приборы для измерения вязкости называются вискозиметрами. Существует несколько методов определения вязкости: метод Стокса, основанный на измерении скорости падения шарика в исследуемой жидкости; метод Пуазейля, в основе которого лежит измерение объема жидкости, протекающей через капиллярную трубку; метод затухающих колебаний тела, подвешенного на упругой нити в исследуемой среде, и другие.
Молекулярно-кинетическая теория для вязкости газов дает выражение: = (1/3)V
где - средняя длина свободного пробега молекул газа.
25. СРЕДНЯЯ КВАДРАТИЧНАЯ СКОРОСТЬ ТЕПЛОВОГО ДВИЖЕНИЯ МОЛЕКУЛ ГАЗА. СРЕДНЯЯ КИНЕТИЧЕСКАЯ ЭНЕРГИЯ ПОСТУПАТЕЛЬНОГО ДВИЖЕНИЯ МОЛЕКУЛ ГАЗА. СТЕПЕНИ СВОБОДЫ МОЛЕКУЛ. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ.
Средняя кинетическая энергия поступательного движения газовых молекул равна
mV2/2 = 3кТ/2, где к – постоянная Больцмана, Т – абсолютная температура газа.
Кроме поступательного движения газовых молекул могут совершаться и другие виды движения: вращение и колебание. Т о, полный запас кинетической энергии молекулы не исчерпывается энергией лишь поступательного движения, она может обладать кинетической энергией вращения и колебания.
Для того чтобы подсчитать среднюю кинетическую энергию молекулы, приходящуюся на все виды ее движения, необходимо ввести понятие о степенях свободы молекулы и выяснить, какая доля общей энергии приходится на одну степень свободы.
Под числом степеней свободы любой механической системы понимают число независимых движений, которые одновременно может совершать эта система; число степеней свободы – это число независимых переменных, определяющих положение системы в пространстве.
Во многих случаях молекулу одноатомного газа можно рассматривать как материальную точку, которой приписывают три степени свободы поступательного движения. Система Nматериальных точек, могущих двигаться независимо друг от друга, имеет 3Nстепеней свободы. Если же отдельные точки в системе как-то связаны друг с другом, то число степеней свободы такой системы будет меньше 3N. Например, абсолютно твердое тело, могущее как угодно двигаться в пространстве, обладает 6 степенями свободы, из которых 3 отвечают поступательному движению и три – вращательному движению.
Многие газы, например, H2,O2,N2,окись углерода СО состоят из молекул, построенных из двух атомов. В первом приближении двухатомную молекулу можно рассматривать как систему из двух материальных точек, расположенных на некотором расстоянии друг от друга и связанных между собой силами взаимодействия. Можно допустить, что связь между атомами молекул является абсолютно жесткой, т.е. расстояние между атомами не изменяется, тогда такой молекуле следует приписать 5 степеней свободы, а именно: 3 поступательного движения и 2 вращательного движения. Такая молекула кроме трех поступательных движений может совершать еще 2 вращательных движения вокруг 2-х взаимно перпендикулярных осей, составляющих прямой угол с линией, соединяющих атомы. Вращение вокруг самой оси молекул мы не принимаем во внимание, т.к. оно лишено смысла. Таким образом, 2-х атомная молекула обладает пятью степенями свободы (i= 5). Подобно трехатомные и многоатомные линейные молекулы обладают пятью степенями свободы: а именно: 3 поступательного движения и 2 вращательного движения (i= 5). Трехатомные и многоатомные нелинейные молекулы имеют 6 степеней свободы: 3 поступательного и 3 вращательного движения. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул иногда необходимо учитывать также степени свободы колебательного движения. Так 2-х атомная молекула с нежесткой связью между атомами будет обладать, кроме 3 поступательных и 2 вращательных степеней свободы, одной колебательной степенью свободы, соответствующей переменной, определяющей взаимное расстояние между атомами, которое в этом случае будет изменяться. Следовательно, в общем случае 2-х атомные молекулы обладают 6 степенями свободы.
Ни одна из поступательных степеней свободы не имеет преимущества перед другими, все они равноправны, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения средней кинетической энергии поступательного движения молекул газа, а именно
10/3 = (1/2)кТ.
Можно показать, что этот результат относится к вращательному и колебательному движениям молекул, т.е. справедливым является следующее положение: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная кТ/2, а на каждую колебательную степень свободы - в среднем энергия, равная кТ (теорема Больцмана о равномерном распределении энергии по степеням свободы молекул).
Колебательная степень свободы «обладает» вдвое большей энергией, потому что на нее приходится не только кинетическая энергия, но и потенциальная энергия, причем средние значения кинетической и потенциальной энергий одинаковы. Т. о, средняя энергия молекулы =(i/2)кТ,
где i– сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулI = Iпост+ Iвращ + 2iколеб
В классической теории рассматриваются молекулы с жесткой связью между атомами.
