
А Е Щеголев Органическая химия 2016 / 06 Алифатические альдегиды, кетоны и карбоновые кислоты
.pdf
ГЛАВА 6. АЛИФАТИЧЕСКИЕ АЛЬДЕГИДЫ, КЕТОНЫ И КАРБОНОВЫЕ КИСЛОТЫ
В данной главе рассматриваются соединения, содержащие общий структурный фрагмент, — карбонильную группу >C=О. В зависимости от того, с какими атомами или атомными группировками связана карбонильная группа, возможно различное еѐ электронное взаимодействие со своим окружением. Поэтому соединения, содержащие карбонильную группу, могут относиться к разным классам и проявлять отличающиеся химические свойства. Такими соединениями являются:
1)кетоны, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами (R);
2)альдегиды, в молекулах которых вместо одного или обоих углеводородных радикалов — атомы водорода. Альдегиды и кетоны имеют общее название — карбонильные соединения. В зависимости от количества карбонильных групп альдегиды и кетоны подразделяются на монокарбонильные соединения, дикарбонильные и т.д. Общую формулу монокарбонильных соединений, относящихся и к альдегидам, и к кетонам, можно представить так:
O
R C
R'(H)
3) карбоновые кислоты и их производные. Это:
|
|
O |
|
|
O |
|
|
|
|
|
O |
R |
|
C |
R |
|
C |
R |
|
C N |
R |
|
C |
|
|
|
|
||||||||
|
|
OH |
|
|
X |
|
|
|
|
|
O- Me+ |
кислоты |
ацильные производные |
нитрилы |
|
|
соли |
||||||
Наиболее простым для рассмотрения случаем являются насыщенные соединения. Особенности строения и химического поведения непредельных альдегидов, кетонов и карбоновых кислот рассматриваются отдельно.
6.1. НАСЫЩЕННЫЕ АЛЬДЕГИДЫ И КЕТОНЫ
Наличие общей функциональной группы в молекулах карбонильных соединений сказывается и на их строении, и на свойствах. Но есть и различия в поведении этих соединений, обусловленные присутствием атома водорода при карбонильной группе.
224
6.1.1. ИЗОМЕРИЯ, НОМЕНКЛАТУРА
Для карбонильных соединений характерны обе разновидности структурной изомерии: как скелетная, так и позиционная (в данном случае это изомерия положения карбонильной группы). При этом альдегиды являются структурными изомерами кетонов.
Пространственная изомерия определяется особенностями строения углеродного скелета молекул.
6.1.1.1. Номенклатура альдегидов
Для названия альдегидов применяются заместительная, рациональная номенклатуры и используются тривиальные названия. По заместительной номенклатуре к названию углеводорода с тем же числом атомов углерода, что и у данного альдегида, добавляется суффикс -аль. Если альдегидная группа находится в боковой цепи, то радикал -CН=О называется формил.
По рациональной номенклатуре любой альдегид может быть назван как замещѐнный уксусный (табл. 6.1).
Таблица 6.1 Примеры названий первых членов гомологического ряда альдегидов
|
|
|
Название |
|
|
|
|
|
|
|
|
Формула |
|
|
по заместительной |
||
тривиальное |
рациональное |
номенклатуре |
|||
|
|
||||
|
|
|
|
ИЮПАК |
|
|
|
|
|
|
|
НСНО |
муравьиный |
— |
метаналь |
||
|
|
|
|
|
|
СН3СНО |
уксусный |
уксусный |
этаналь |
||
|
|
|
|
|
|
СН3СН2СНО |
пропионовый |
метилуксусный |
пропаналь |
||
|
|
|
|
|
|
СН3СН2СН2СНО |
масляный |
этилуксусный |
бутаналь |
||
|
|
|
|
||
CH3-CH-CHO |
изомасляный |
диметилуксусный |
2-метилпропаналь |
||
|
|
||||
CH3 |
|||||
|
|
|
|||
6.1.1.2. Номенклатура кетонов
Кетоны могут быть названы по заместительной, рациональной и ради- кало-функциональной номенклатурам. Из насыщенных кетонов только для ацетона используется тривиальное название.
По заместительной номенклатуре к названию углеводорода с тем же числом атомов углерода, что и у данного кетона, добавляется суффикс -он.
225

Кетонная функциональная группа младше альдегидной, поэтому в присутствии альдегидной группы (или другой, более старшей) она называется путѐм добавления приставки оксо-.
По рациональной номенклатуре любой кетон может быть назван как замещѐнный ацетон (табл. 6.2).
При использовании радикало-функциональной номенклатуры к названию углеводородных радикалов, с которыми связана карбонильная группа, добавляется слово «кетон» (табл. 6.2).
Таблица 6.2 Примеры названий простейших представителей ряда кетонов
|
|
Название |
|
|
|
|
|
|
|
Формула |
|
по радикало- |
по заместительной |
|
|
функциональной |
|||
рациональное |
номенклатуре |
|||
|
||||
|
номенклатуре |
|||
|
|
ИЮПАК |
||
|
|
ИЮПАК |
||
|
|
|
||
СН3-СО-СН3 |
ацетон |
диметилкетон |
пропанон |
|
|
|
|
|
|
СН3-СО-С2Н5 |
метилацетон |
метилэтилкетон |
бутанон |
|
|
|
|
|
|
СН3-СО-СН2СН2СН3 |
этилацетон |
метилпропилке- |
пентан-2-он |
|
тон |
||||
|
|
|
||
CH3-C-CH-CH3 |
, -диметил- |
метилизо- |
|
|
= |
|
пропилкетон |
3-метилбутанон |
|
O CH3 |
ацетон |
|||
|
||||
С2Н5-СО-С2Н5 |
, -ди- |
диэтилкетон |
пентан-3-он |
|
метилацетон |
||||
|
|
|
||
|
|
|
|
6.1.2. СТРОЕНИЕ КАРБОНИЛЬНОЙ ГРУППЫ
Связь между атомами углерода и кислорода в карбонильной группе — двойная, образована двумя парами валентных электронов, то есть кроме-связи C–О имеется -связь, обусловленная боковым пере-
крыванием негибридных р-орбиталей этих атомов. Атом углерода образует три -связи за счѐт sp2-гибридных орбиталей,
оси которых лежат в одной плоскости.
Двойная связь C=О сильнополярна, поэтому на атомах углерода и кислорода карбонильной группы локализуются соответственно значительные положительный и отрицательный заряды.
Электроны -связи подвижны, поэтому возможно изображение карбонильной группы в виде одной из двух граничных структур:
226

+ -
C = O |
|
C |
|
O |
|
|
6.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА
Альдегиды и кетоны — полярные соединения из-за наличия сильнополярной связи C=О. Поэтому первые представители этих соединений хорошо растворяются в воде. По этой же причине, ввиду наличия диполь-дипольных взаимодействий, температуры кипения альдегидов и кетонов выше, чем у углеводородов с такими же молекулярными массами, но ниже, чем у соответствующих спиртов, так как между молекулами карбонильных соединений отсутствуют водородные связи. Кроме того, кетоны кипят при более высокой температуре, чем изомерные им альдегиды.
Альдегиды и кетоны — бесцветные соединения; многие из них обладают резким запахом.
6.1.4. ХИМИЧЕСКИЕ СВОЙСТВА
Наличие в молекулах альдегидов и кетонов карбонильной группы является причиной проявления ими общих свойств, связанных с особенностями строения этой функциональной группы.
1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (C +), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву -связи и образованию более прочной - связи. Поэтому наиболее характерным типом реакции альдегидов и кетонов должны быть реакции нуклеофильного присоединения (AN).
2. Кроме того, высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой ( -углеродном атоме), значитель-
ный электроноакцепторный эффект и, как следствие |
|
|
|
|
O |
|
этого, повышенную полярность связи С–Н -угле- |
|
|
|
|||
R |
|
CH |
|
C |
||
родного атома. Это характеризует данные соединения |
|
|
||||
|
|
|
|
|
R'(H) |
|
как СН-кислоты, анионы которых могут проявлять |
|
|
|
|
|
|
|
|
H |
|
|
||
сильные нуклеофильные свойства.
Также для альдегидов и кетонов характерны и другие, в том числе связанные с особенностями строения некоторых из них.
227

6.1.4.1. Реакции нуклеофильного присоединения
Реакции нуклеофильного присоединения — большая группа реакций альдегидов и кетонов. Эти реакции могут начинаться либо непосредственным взаимодействием атома углерода с нуклеофильной частицей, либо предварительным протонированием по атому кислорода. При этом быстрое и обратимое протонирование
R |
|
|
|
|
R |
||
|
+ |
|
|||||
|
C = O + H+ |
|
|
|
C |
|
OH |
|
|
|
|
|
|||
|
|
|
|
||||
(H)R' |
|
|
|
|
(H)R' |
||
предшествует, как правило, более медленной нуклеофильной атаке по атому углерода (вместо протонных кислот могут использоваться кислоты Льюиса):
R
+
C OH + :Y
(H)R'
Таким образом, реакции присоединения по карбонильной группе могут катализироваться кислотами.
Но многие активные нуклеофилы являются анионами слабых кислот, и в кислой среде диссоциация этих кислот будет подавлена, например:
|
+ |
+ СN |
|
HCN |
Н |
|
В этом случае в присутствии кислотного катализатора концентрация анионов СN будет ничтожна, а молекулы HCN, в свою очередь, не обладают нуклеофильными свойствами. В таких случаях используют катализ основаниями.
Для нуклеофилов, представленных молекулами аммиака и его производных, применение кислотных катализаторов вообще может быть неэффективно, так как сильные кислоты превращают молекулу в катион, не обладающий нуклеофильными свойствами:
R-NH2 + Н+ R-NH3+
Поэтому взаимодействие с такими нуклеофилами проводят в нейтральной или слабокислой среде, в которой концентрация нейтральных молекул реагента остаѐтся достаточной для осуществления нуклеофильной атаки.
Взаимодействие карбонильных соединений с нуклеофилами в отсутствие кислотных катализаторов осуществляется по схеме:
228

R |
+ :Y- |
|
|
|
R |
|
|
|
|
Y C O- |
|||
C = O |
|
|
|
|||
|
|
|||||
|
|
|
||||
(H)R' |
|
|
|
|
|
|
|
|
|
|
R'(H) |
||
Дальнейшее превращение с образованием продукта присоединения требует наличия в среде хотя бы слабой кислоты, то есть в данном случае соединения, способного отщепить протон:
R |
|
- |
|
R |
|||
|
|
|
+HY |
|
|
||
Y C |
O |
Y C OH |
|||||
|
-Y- |
||||||
|
|
|
|
|
|
||
R'(H) |
|
R'(H) |
|||||
Таким образом, нуклеофильное присоединение к альдегидам и кетонам в отсутствие кислотных катализаторов включает две стадии:
1) взаимодействие карбонильного соединения с нуклеофилом с образованием аниона, протекающее через переходное состояние:
|
|
|
|
|
|
|
|
|
'- |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
Y |
|
|
|
|
|
|
|
|
|
|
Y |
||
+ :Y- |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O- |
||
C = O |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
C |
|
||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
(H)R' |
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
R |
||
|
|
|
|
|
|
|
|
|
(H)R' |
|
|
|
|
|
|
|
|
|
|
(H)R' |
||
2) превращение аниона в нейтральную молекулу: |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
Y |
|
|
|
|
Y |
|
|
|
|
|
|
|
|
|
|
||||||
|
C |
|
O |
- +HY |
|
|
C |
|
|
|
OH |
|||||||||||
|
|
|
|
|
|
|
||||||||||||||||
|
R |
|
|
-Y - |
R |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
(H)R' |
|
|
|
(H)R' |
|
|
|
|
|
|
|
|
|
|
|||||||
При кислотном катализе на первой стадии происходит быстрое протонирование с образованием карбокатиона. Затем следует лимитирующая стадия взаимодействия этого карбокатиона с нуклеофилом (анион или молекула) — образуется продукт присоединения:
R |
|
|
Y |
||||
- |
|
|
|
|
|||
+ |
|
|
|
|
|
|
|
C |
|
OH + :Y |
|
C |
|
OH |
|
|
|
|
|
||||
(H)R' |
|
|
R |
||||
|
|
|
|
|
(H)R' |
||
229

При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный, но в любом случае альдегиды оказываются более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жѐстких условиях, чем альдегиды, а в некоторые реакции не вступают вовсе.
Электронный фактор связан с величиной эффективного положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R . Легкость взаимодействия с нуклеофилом должна зависеть от величины этого положительного заряда. Электронодонорные заместители будут снижать, а электроноакцепторные, наоборот, — повышать реакционную способность карбонильных соединений.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R , а в молекулах альдегидов (R = Н) — только одного (R), поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
|
|
O |
|
R |
C |
= |
|
R'(H) |
|||
|
|
Поэтому взаимодействие кетонов с нуклеофилами протекает труднее. Пространственный фактор связан с доступностью реакционного центра
(C +) для нуклеофильной атаки, а это зависит от размеров заместителей R и R . В молекулах альдегидов (они содержат только один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами — нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Наиболее типичными примерами нуклеофильного присоединения по карбонильной группе являются реакции взаимодействия с водой, со спиртами, с аммиаком и его производными, с синильной кислотой, с гидросульфитом натрия, с реактивом Гриньяра.
1. Гидратация альдегидов и кетонов протекает в водных растворах карбонильных соединений по схеме:
|
|
|
+ |
|
|
|
|
|
||||
R |
|
|
|
|
|
OH |
|
|
OH |
|||
: |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
C = O + H2O |
|
|
|
|
R - C - R'(H) |
|
|
|
R - C - R'(H) |
|||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||
|
|
|
||||||||||
(H)R' |
|
|
|
|
|
O- |
|
|
OH |
|||
В нейтральных водных растворах формальдегид практически полностью гидратирован (на 99.99%), для ацетальдегида эта величина составляет 58%, а для ацетона концентрация гидратной формы пренебрежительно мала. Одна-
230

ко гидратация кетонов в значительной степени катализируется кислотами и основаниями:
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
R |
|
|
|
: |
|
|
|
OH |
|
|
|
|
OH |
||||||||
|
+H |
+ |
+ |
|
+ H2O |
|
2 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
C=O |
|
|
|
C |
|
OH |
|
|
|
|
R |
C |
|
R' |
|
|
|
|
|
R C |
|
R' |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
R' |
|
|
|
|
|
|
-H |
+ |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
R' |
|
|
|
|
|
|
|
|
OH |
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
R |
|
|
|
|
|
|
|
OH |
|
|
OH |
|||||
|
- |
|
|
|
|
|
|
|
|
+H2O |
|
|
|
|
||
C = O |
: |
|
|
|
|
R C |
|
R' |
|
|
R C |
|
R' |
|||
+ HO |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
-OH - |
|||||||||||
|
|
|
|
|
|
|
O- |
|
|
|
|
|||||
R' |
|
|
|
|
|
|
|
|
OH |
|||||||
Электроноакцепторные заместители в алкильных группах облегчают гидратацию и стабилизируют образующиеся гидраты. Так, например, трихлоруксусный альдегид (хлораль) гидратирован практически полностью. Продукт этой реакции, хлоральгидрат Cl3C-CH(OH)2, представляет собой устойчивое кристаллическое соединение, способное отщеплять воду только при нагревании с водоотнимающими веществами (конц. H2SO4 и др.).
2. Присоединение спиртов приводит к образованию полуацеталей и полукеталей. Эта реакция аналогична гидратации альдегидов и кетонов. Например:
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
||||
H C |
|
|
|
|
HO |
|
CH3 |
|
|
|
OCH3 |
||||||
|
|
|
|
|
|
|
|
||||||||||
3 |
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C = O |
|
|
|
H3C C |
|
|
|
CH3 |
|
|
|
H3C C |
|
CH3 |
|||
+ CH3OH |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
H3C |
|
|
|
|
O- |
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
метилкеталь ацетона |
|||
Реакция катализируется как кислотами, так и основаниями (аналогично гидратации). Однако в присутствии кислотных катализаторов реакция идѐт дальше, образующийся полуацеталь (полукеталь) вступает в нуклеофильное замещение и образуются полные ацетали и, соответственно, кетали. Механизм превращения полуацеталя (полукеталя) в ацеталь (кеталь) мономолекулярный, так как образующийся промежуточный карбокатион стабилизирован сопряжением с участием неподелѐнной электронной пары соседнего атома кислорода:
OCH3 |
+H |
+ |
OCH3 |
|
|
|
|
H3C |
+ |
|
+CH3OH |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H3C C |
|
CH3 |
|
|
|
|
H3C C |
|
CH3 |
|
|
|
|
|
C |
|
OCH3 |
|
|
|
|
||
|
|
|
|
|
|
- H2O |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
+ |
|
|
|
H3C |
|
|
|
|
|
|
|
||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||||
2
метилкеталь ацетона (полукеталь)
231
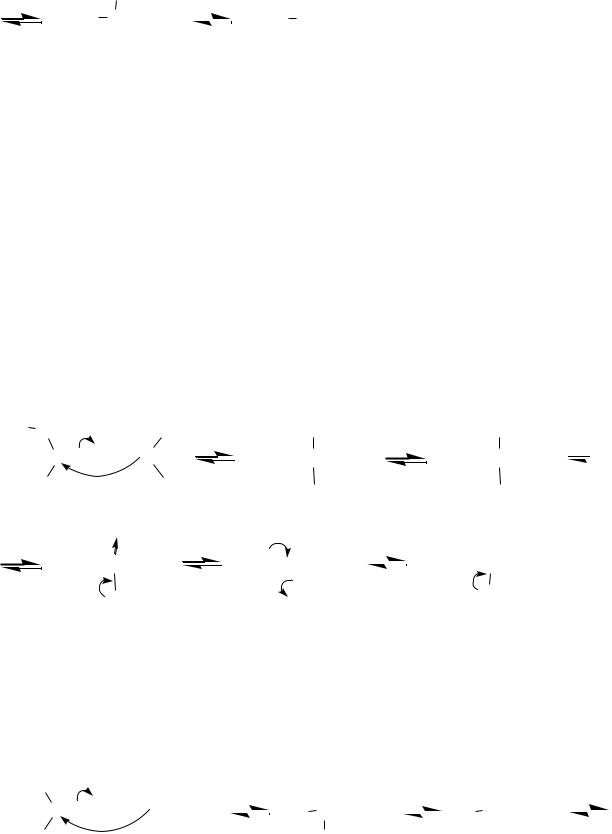
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3OH |
|
|
|
|
OCH3 |
||||||||
|
|
|
|||||||||||
H3C C |
|
CH3 |
|
|
|
|
H C |
C |
|
CH |
|||
|
|
|
|
|
|
||||||||
|
|
|
|
||||||||||
|
|
|
|
-H |
+ |
3 |
|
|
3 |
||||
|
|
|
|
|
|
OCH3 |
|||||||
OCH3 |
|
|
|||||||||||
диметилкеталь ацетона
Эти реакции обратимы — ацетали и кетали гидролизуются под действием кислоты. Основания не катализируют нуклеофильное замещение (превращение полуацеталей в ацетали) ни в прямом, ни в обратном направлениях, поэтому в щелочной среде образуются только полуацетали.
Большинство альдегидов легко превращается в ацетали. Для кетонов процесс протекает значительно медленнее.
3. Взаимодействие с производными аммиака (аминами, гидразином NH2-NH2 и замещѐнными гидразинами, гидроксиламином NH2-ОH и т.д.) обычно не требует катализатора, хотя часто реакцию проводят в слабокислой среде (рН = 3 5). Если центром нуклеофильности атакующей молекулы является вторичный атом азота (например, во вторичных аминах), то сначала протекает обычное присоединение с образованием аминоспирта, который затем отщепляет воду, и образуется непредельный амин винильного типа (енамин), стабилизированный р- -сопряжением, например:
R CH2 |
CH |
|
3 |
C = O + :NH |
|
(H)R' |
CH3 |
+OH2
R-CH2-C-R'(H)
-H2O
:N(CH3)2
O- R-CH2-C-R'(H)
+NH(CH3)2
H
|
|
|
|
|
|||||
R-CH-C-R'(H) |
|
|
|
||||||
|
|
|
|||||||
-H+ |
|||||||||
|
|
|
|
|
+ |
||||
|
|
|
|
|
|||||
|
N(CH3)2 |
|
|
|
|||||
OH R-CH2-C-R'(H) H+
N(CH3)2
R-CH=C-R'(H) :N(CH3)2
Если же нуклеофильная атака производится первичным атомом азота, то присоединение также сопровождается последующим отщеплением, но протон отщепляется от атома азота. При взаимодействии с первичными аминами это приводит к образованию иминов, а при взаимодействии с гидроксиламином — к образованию оксимов. Для этих случаев можно привести общую схему:
R |
|
|
|
O- |
|
|
|
OH |
+ |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||
C = O + :NH2-X |
|
|
|
R C |
|
R'(H) |
|
|
|
|
R C |
|
R'(H) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
+NH2-X |
|
|
|
|
|
|
|
|
|
|
|||||
(H)R' |
|
|
|
|
|
|
NH-X |
|
|
|
||||||||
232

+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
OH2 |
|
|
|
R |
+ |
|
|
|
R |
||
R C |
|
R'(H) |
|
|
|
|
C=NH-X |
|
|
|
C=N-X |
|
|
|
|
|
|
|
|
|
|||||
-H2O |
|
-H+ |
||||||||||
|
|
|
|
(H)R' |
|
(H)R' |
||||||
NH-X |
|
|||||||||||
|
|
|
|
|
|
|
||||||
При взаимодействии карбонильных соединений с одним из производных аммиака — гидразином — образуются гидразоны, широко использующиеся в органическом синтезе.
R |
|
|
R |
|
C=O + NH2-NH2 |
|
|
C=N-NH2 |
|
- H2O |
||||
R'(H) |
R'(H) |
|||
|
|
|||
Их нагревание в присутствии катализатора приводит к разложению с образованием алканов — реакция Кижнера–Вольфа. Катализатором служит гидроксид калия в присутствии платины. Вместо КОН могут быть использованы NaОН или NaОC2Н5. Механизм реакции при действии КОН и Pt можно представить в следующем виде:
|
R |
|
H |
|
|
|
|
|
|
|
R |
- |
|
|
R |
- |
|
|
|
|
||
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C-N=NH |
|
|
|||||
|
|
C=N-NH + :OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
C=N-NH |
|
|
- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
R'(H) |
|
|
|
|
|
|
|
R'(H) |
|
|
|
R'(H) |
|
- OH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
R |
|
Pt |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
CH-N=N-H |
|
|
|
|
|
|
|
R-CH2-R' |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
- N2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
R'(H) |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Данная реакция может применяться как способ получения предельных углеводородов (гл. 2.5).
При взаимодействии карбонильных соединений с гидроксиламином образуются оксимы соответствующих альдегидов и кетонов:
R |
|
|
R |
|
C = O + NH2-OH |
|
|
C = N - OH |
|
- H2O |
||||
|
|
|||
R'(H) |
|
|
R'(H) |
|
При этом оксимы кетонов могут претерпевать перегруппировку Бекмана* — превращение в замещѐнные амиды кислот под действием кислотных катализаторов: H2SO4, полифосфорная кислота, кислоты Льюиса, а также бекманов-
ская смесь (CH3COOH + (CH3CO)2O + HCl).
233
