
А Е Щеголев Органическая химия 2016 / 01 Основы теоретических представлений в органической химии
.pdfГлава 1. ОСНОВЫ ТЕОРЕТИЧЕСКИХ ПРЕДСТАВЛЕНИЙ В ОРГАНИЧЕСКОЙ ХИМИИ
Теоретическими основами органической химии являются теория строения органических соединений и теория реакционной способности. Поэтому данная глава посвящена учению о соединении атомов в молекуле, о взаимном влиянии атомов в молекуле и о протекании реакций. Помимо этого в главе рассмотрены вопросы классификации, номенклатуры и идентификации органических соединений. Без этих вопросов представление об органической химии было бы неполным и невозможно было бы дальнейшее рассмотрение характеристики веществ по классам.
1.1. УЧЕНИЕ А.М. БУТЛЕРОВА
По мере накопления знаний о веществах химическая наука в XIX столетии разделилась на два магистральных направления — неорганическую и органическую химию. Большую роль в становлении и развитии последней сыграла теория строения органических соединений А.М. Бутлерова*. Она создана на основе обобщения полученного к тому времени экспериментального материала по химии органических веществ.
Химическое строение, по Бутлерову, — это порядок химического взаимодействия атомов, или, другими словами, последовательность соединений атомов в молекуле. Бутлеров пришел к выводу, что химическое строение может быть строго отражено в формулах и экспериментально установлено химическими методами. Он считал, что атомы в молекуле оказывают влияние друг на друга; это их взаимное влияние проявляется в свойствах веществ. Так, атомы водорода в веществах НСl, H2O, NH3, Н2 имеют совершенно разные свойства. В хлороводороде они легко замещаются на многие металлы, в воде замещение происходит лишь под действием активных металлов, в аммиаке же такая реакция осуществляется только в особых условиях, и совершенно иные свойства они проявляют, образуя молекулярный водород. Следовательно, атомы кислорода, хлора и азота оказывают влияние на атом водорода, связанный с ними, и это влияние различно. Множество разнообразных примеров имеется среди органических веществ. Бутлеров пришѐл к выводу, что в органических соединениях могут различаться даже такие связи, как С–Н и С–С, в зависимости от характера их химического окружения.
Теория Бутлерова позволила химикам познать строение органических молекул, понять сущность химических процессов, предсказать новые пути синтеза соединений углерода. Еѐ создание относится к 60-м годам XIX сто-
5

летия. Основные положения теории в современной интерпретации заключаются в следующем.
*Атомы в молекуле соединены друг с другом в определенной последовательности согласно их валентности. Эта последовательность называется химической структурой.
*Атомы оказывают взаимное влияние друг на друга.
*Химические свойства веществ определяются составом и химическим (пространственным) строением.
*Химическое строение веществ можно изучить при помощи их химических превращений, и, наоборот, по строению данного вещества можно судить о его химических свойствах.
Например, молекулярной формуле С4Н10 соответствуют два вещества с разной структурой, обладающие различными физическими и химическими свойствами:
|
|
|
CH3 |
|
|
|
|
СН3-СН2-СН2-СН3 |
и |
CH3 CH CH3 |
|
н-бутан (Т кип. = -0.5 С) |
|
изобутан (Т кип. = -12 С) |
|
Эта теория способствовала развитию направленного органического синтеза. К 1865 году было известно около 3000 органических веществ, а к 1880 году — уже 15 000. В настоящее время их более 100 млн. Новый качественный период развития органической химии начался с введения в неѐ в XX столетии электронных и квантово-химических представлений, что явилось дальнейшим развитием классической теории строения А.М. Бутлерова.
1.2. ТЕОРИЯ ГИБРИДИЗАЦИИ АТОМНЫХ ОРБИТАЛЕЙ
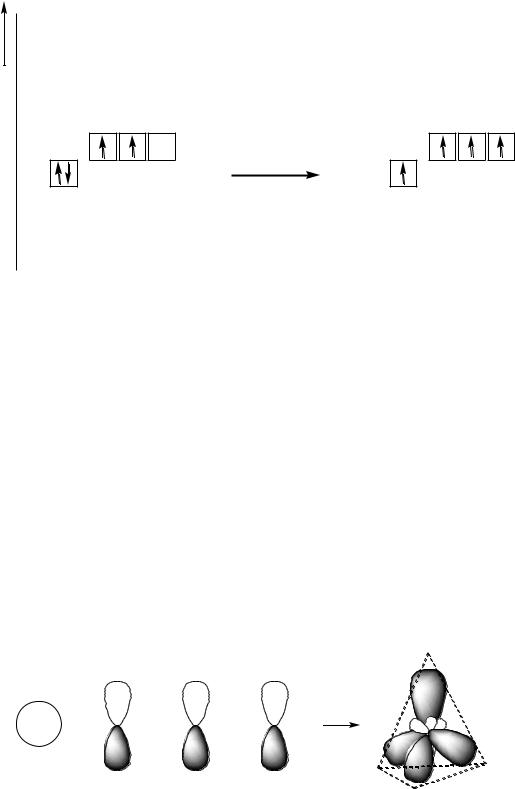
Известно, что в большинстве органических соединений атом углерода четырѐхвалентен. Однако электронная конфигурация его внешнего электронного слоя — 2s22p2, и образование четырѐх ковалентных связей возможно при переходе атома углерода в возбуждѐнное состояние. При этом происходит «распаривание» электронов на s-подуровне, и один из них переходит на близкую по энергии р-орбиталь:
С 2s22p2 + 400 кДж/моль С* 2s12p3
Четыре неспаренных электрона внешнего электронного слоя заселяют разные по энергии орбитали: один электрон находится на s- и три электрона
— на р-орбиталях.
6
E
|
h |
2s2 2px1 2py1 2p0z |
2s1 2px1 2py1 2p1z |
Из свойств соединений углерода известно, что если в молекуле атом углерода образует четыре ковалентные связи с четырьмя одинаковыми заместителями, то такие связи между собой абсолютно одинаковы. Например,
вметане СН4 все четыре связи равноценны.
В1931 году Л. Полинг* выдвинул гипотезу, согласно которой атомные орбитали углерода в возбуждѐнном состоянии как бы смешиваются, выравниваются по форме и энергии, то есть усредняются — гибридизуются.
Из одной s- и трѐх р-орбиталей образуется четыре равноценных гибридных орбитали. Из четырѐх разных орбиталей образуется четыре одинако-
вых по энергии и по форме атомных орбитали, при этом тип гибридизации здесь sp3, так как в гибридизации участие принимают одна s- и три р- орбитали. Для гибридизации, как и для возбуждения атома углерода, требуются затраты энергии.
одна s + три р четыре sp3
+ |
+ |
+ |
Это первое валентное состояние углерода.
Геометрическая форма sp3-гибридных орбиталей — вытянутые объѐмные «восьмѐрки», расположение в пространстве — на максимальном удалении друг от друга, то есть оси этих орбиталей должны быть направлены к вершинам правильного тетраэдра, и валентный угол (угол между осями ор-
7

биталей) соответствует такому пространственному их расположению и составляет 109 28 .
Этим можно объяснить способность атома углерода образовывать четыре равноценные ковалентные связи с четырьмя другими одинаковыми атомами (как, например, с атомами водорода в молекуле метана).
При смешении, гибридизации трѐх орбиталей: одной s- и двух р- орбиталей образуются три равноценные гибридные орбитали sp2-типа:
одна s + две р три sp2.
Геометрическая форма и расположение в пространстве sp2-гибридных орбиталей — объѐмные «восьмѐрки». Эти орбитали — менее вытянутые, чем орбитали sp3-типа, так как доля p-орбиталей в гибридной орбитали здесь меньше, и sp2-гибридная орбиталь менее похожа на p-орбиталь, чем орбиталь sp3-типа. Оси их лежат в одной плоскости и направлены под углом 120 друг к другу.
120o
+ |
+ |
Это второе валентное состояние углерода.
В том случае, когда гибридизации подвергаются одна s- и одна р- орбиталь, образуются две sp-гибридные орбитали:
одна s + одна р две sp ,
оси которых находятся под углом 180 , то есть лежат на одной прямой. Это ещѐ менее вытянутые орбитали, чем sp2-гибридные.
180o
+
Это третье валентное состояние углерода.
Характеристика валентного состояния углерода и образуемых им связей приведена в табл. 1.1.
8
Таблица 1.1
Характеристика углерод-углеродных связей в молекулах этана, этилена и ацетилена
|
|
|
Вклад |
|
|
|
|
Характеристика связи |
|
|
|||
Соедине- |
|
Гиб- |
s- |
Относ. |
|
|
|
|
энергия на |
|
|
||
|
риди- |
орби- |
э/отриц. |
|
|
длина, |
энергия, |
|
|
||||
ние |
|
связь |
|
одну связь, |
|
|
|||||||
|
зация |
тали, |
атома С |
|
нм |
кДж/моль |
|
|
|||||
|
|
|
|
кДж/моль |
|
|
|||||||
|
|
|
% |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
СН3–СН3 |
|
sp3 |
25.0 |
2.50 |
|
С–С |
|
0.154 |
348 |
348 |
|
|
|
СН2=СН2 |
|
sp2 |
33.3 |
2.76 |
|
С=С |
|
0.134 |
607 |
304 |
|
|
|
СН СН |
|
sp |
50.0 |
3.20 |
|
С С |
|
0.120 |
829 |
276 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Но данные типы гибридизации характерны лишь |
H H |
|
|
||||||||||
для небольшого числа соединений. Для соединений с не- |
|
|
|
||||||||||
одинаковыми заместителями у атома углерода имеются |
|
|
|
||||||||||
отклонения |
от |
классической |
|
схемы. |
В пропане |
CH3 |
CH3 |
||||||
СН3-СН2-СН3, например, |
из-за |
того, что |
центральный |
||||||||||
|
|
|
|||||||||||
атом углерода образует две С–С- и две С–Н-связи, орбитали, участвующие в образовании этих связей, будут по-разному отталкиваться и валентные углы искажаются: НСН = 107 ; ССС = 112 . В данном случае говорится о нестрогой гибридизации.
По Полингу, степень гибридизации атомных орбиталей связана с ва-
лентным углом уравнением: |
|
1 + i jcos ij = 0 |
или 1 + 2cos = 0 , |
где i(j) — коэффициент смешения орбиталей, а 2 — степень гибридизации (здесь количество р-орбиталей, принимающих участие в гибридизации с одной s-орбиталью); ij — валентный угол (угол между i-ной и j-ной атомными орбиталями). Например,
для sp-гибридных орбиталей 2 = 1, cos = –1, = 180 ;
для sp2-гибридных — 2 = 2, cos = –1/2, = 120 ;
для sp3-гибридных — 2 = 3, cos = –1/3, = 109.47 (или 109 28 ).
Но в общем случае степень гибридизации может быть и дробной, так как валентные углы между разными связями в различных соединениях могут сильно отличаться от приведенных выше. В этих случаях необходимо помнить, что степень гибридизации — это лишь формальное число р-орбиталей, приходящихся в гибридизации на одну s-орбиталь.
9
1.3. КОВАЛЕНТНАЯ СВЯЗЬ
Как уже говорилось во введении, структурную основу всех органических веществ составляют молекулярные системы, в которых атомы углерода образуют устойчивые ковалентные связи между собой и с другими атомами. За счѐт этого углерод образует устойчивые цепи атомов, характеризующиеся различной протяжѐнностью и разветвлѐнностью. Этим и обусловлено многообразие органических соединений.
1.3.1. ОБРАЗОВАНИЕ КОВАЛЕНТНЫХ СВЯЗЕЙ АТОМАМИ УГЛЕРОДА
Химическая связь, образованная однократным перекрыванием орбиталей по прямой, связывающей центры атомов, с максимумом перекрывания на этой прямой, получила название -связи. Это ординарная (простая) связь двухэлектронная и двухцентровая. Перекрываться могут две s-орбитали, две p-орбитали, s- и p-орбитали или гибридные орбитали. Примеры:
s - s |
p - p |
s - p |
В общем случае возможны и другие варианты образования -связей. Как правило, углерод на образование -связи предоставляет гибридные орбитали. Например, в метане -связь возникает за счѐт перекрывания sp3- гибридных орбиталей атома углерода и s-орбиталей атома водорода:
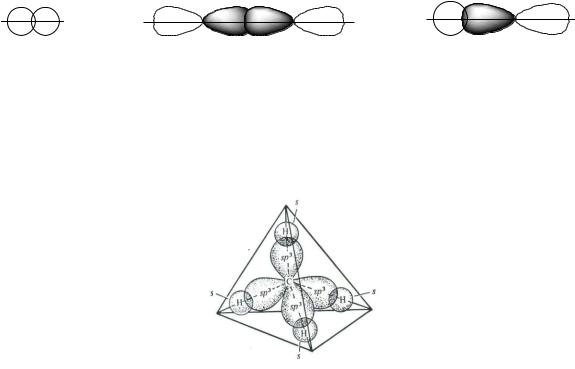
В молекулах алканов имеются также -связи и между углеродными атомами.-Связь образуется в результате бокового перекрывания негибридных («чистых») р-орбиталей с максимумом перекрывания по обе стороны от
прямой, связывающей ядра атомов.
10
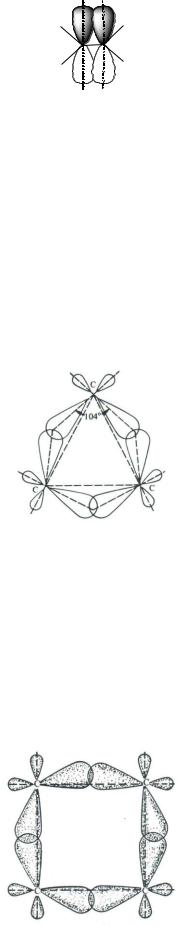
-Связь (или «банановая» связь) может быть образована чистыми р- орбиталями или гибридными орбиталями, но максимум электронной плотности не находится на линии, связывающей центры атомов. Оси перекрывающихся орбиталей не параллельны, они находятся под тупым углом. Такой тип связи наблюдается в некоторых циклических углеводородах и их производных. Это можно объяснить напряжением в цикле, связанным с большим отклонением валентного угла от тетраэдрического (109 28 ). Так, в циклопропане угол между орбиталями, образующими С–С-связи составляет 104 (а валентный угол, равный внутреннему углу правильного треугольника, 60 ); гибридизация атомных орбиталей углерода близка к sp3:
Углерод-углеродные связи возникают в результате перекрывания sp3- гибридных орбиталей вне линии, соединяющей ядра атомов углерода, то есть по характеру своего образования они занимают промежуточное положение между -связью и -связью. При этом область перекрывания орбиталей мала по сравнению с перекрыванием в -связях молекул алканов. Отсюда и меньшая прочность образующейся связи C–C. Аналогичная ситуация и в циклобутане, только отклонение области перекрывания орбиталей от линии, связывающей центры атомов, здесь меньше:
11

Так как образование ковалентной связи предполагает наличие общей электронной пары на перекрывающихся орбиталях, то возможны два способа образования общих электронных пар. Первый способ — каждый атом предоставляет по одному электрону:
H + Cl H:Cl |
H3C + CH3 H3C : CH3 |
Второй способ — один атом даѐт электронную пару, а второй предоставляет незаполненную орбиталь:
H3N: + H+ H3+N:H |
H3C : |
+ +CH3 H3C:CH3 |
Этот способ называется координацией или донорно-акцепторным способом образования ковалентной связи. Более показателен пример образования N- оксидов аминов:
: (CH3)3N: + O: :
|
+ |
|
- |
(CH ) N:O: |
|||
|
|
: |
|
3 3 |
|
: |
|
|
|
|
|
В данном случае возникает координационная связь между атомами азота и кислорода. При этом азот предоставляет электронную пару для образования связи и приобретает положительный заряд, а атом кислорода, являясь акцептором, — отрицательный. Обозначения такой связи могут быть различны:
(CH3)3N+ |
O:- |
или |
(CH3)3N O |
||
|
: |
|
|
|
|
|
: |
|
|
|
|
1.3.2. СВОЙСТВА КОВАЛЕНТНОЙ СВЯЗИ
Энергия (прочность) связи. Энергия -связи соответствует количеству тепла, которое выделяется при образовании этой связи из соответствующих свободных радикалов (или поглощается при еѐ гомолитическом распаде). Чем больше степень перекрывания орбиталей при образовании ковалентной связи, тем выше еѐ энергия, тем она прочнее.
Прочность связи C–H зависит от типа гибридизации углерода и кратности связи. Для этана, этилена и ацетилена она составляет 411, 444 и 503 кДж/моль соответственно.
Длина связи. Атомы в молекуле всѐ время претерпевают колебания. Однако с помощью дифракционных методов удаѐтся определить равновесные расстояния между ними, то есть длину связи. Длина связи рассчитывает-
12
ся как сумма ковалентных радиусов образующих еѐ атомов. Если связь образована двумя одинаковыми атомами (H–H, C–C и др.), то принимают, что еѐ длина как бы состоит из двух равных частей. Эти части называются ковалентными радиусами атомов. Например, ковалентные радиусы F, Cl, Br, I и S равны соответственно 0.064, 0.099, 0.114, 0.133, 0.104 нм. Для атома углерода ковалентный радиус составляет в зависимости от гибридизации 0.077, 0.067 или 0.060 нм (для Сsp3, Сsp2 и Сsp соответственно). Ковалентный радиус водорода принимают равным 0.030 нм, хотя половина длины связи H–H в молекуле H2 равна 0.037 нм. Сумма ковалентных радиусов разных атомов должна быть равна длине ковалентной связи между ними. Для связи C–H — это сумма ковалентных радиусов атомов водорода и углерода (0.030 нм + 0.077 нм = 0.107 нм), и действительно во многих органических молекулах длины C–H-связей у насыщенного атома углерода примерно равны этому значению.
Длины кратных связей (двойной и тройной), образованных атомом углерода, меньше длин ординарных связей. Эти связи образованы sp2- и sp- орбиталями углерода, а чем больше s-характер гибридной орбитали, тем она меньше. Это относится и к углерод-углеродным связям, и к связям С–H, С–O, C–N и другим связям атома углерода во втором и третьем валентном состояниях.
Полярность связи — это смещение области перекрывания атомных орбиталей в сторону более электроотрицательного атома. Полярность связи можно охарактеризовать количественно через еѐ дипольный момент , выражаемый в Дебаях (D). Для двухатомных молекул дипольный момент определяется по формуле:
= q l,
где q — частичный положительный или отрицательный заряд,
l — расстояние между центрами положительных и отрицательных зарядов.
Чем значительнее смещены валентные электроны к одному из атомов, тем более полярны молекулы и тем больше . В случае более сложных молекул дипольный момент связи вычисляется из экспериментально найденного дипольного момента молекулы.
Вклад s-орбитали в гибридную орбиталь сильно влияет на величину относительной электроотрицательности элемента углерода, а следовательно, и на полярность связи С–Н. Она возрастает в соединениях при изменении гибридизации углерода от sp3 к sp2 и sp. Ацетилен в отличие от этилена и этана проявляет отчетливо выраженные кислотные свойства. В нѐм атом водорода способен замещаться (как и в кислотах) на атом металла.
Важной характеристикой химической связи является еѐ поляризуемость, то есть способность к перераспределению электронной плотности на
13

связанных атомах под действием внешних факторов, в том числе и в ходе реакции. Степень поляризуемости зависит от интенсивности внешних факторов и от подвижности электронов. Так, чем больше радиус орбиталей поляризующихся электронов, тем легче они поляризуются. Например, р- электроны поляризуются легче, чем s-электроны. В соответствии с этим легче поляризуется электронная оболочка атома серы, чем атома кислорода, и атома хлора, чем атома фтора.
При анализе поляризуемости иногда выделяют поляризуемость вдоль связи (продольную) и перпендикулярную ей (поперечную). В последнем случае -связь как бы набухает и начинает напоминать -связь. При переходе от ординарной к двойной и тройной углерод-углеродной связи эта величина сильно возрастает.
Порядок (кратность) связи определяется числом пар электронов, связывающих два атома. Для иллюстрации укажем, что порядки связей между атомами углерода в этане, этилене и ацетилене составляют соответственно один, два и три. В органической химии возможна ситуация, когда из-за внутримолекулярных взаимодействий некоторые связи имеют нечѐтное число электронов. В этом случае говорят о дробных порядках связи, например полуторном.
Направленность в пространстве. Ковалентные связи образуются в результате перекрывания атомных орбиталей, имеющих определенную ориентацию относительно других орбиталей своего атомного остова. Следовательно, эти связи имеют пространственную направленность.
1.3.3. ВОДОРОДНЫЕ СВЯЗИ
Присутствие в молекулах атомов сильно электроотрицательных элементов (таких, как фтор, кислород, азот), связанных с атомом водорода, приводит к значительному возрастанию дефицита электронной плотности на этом атоме водорода и увеличению положительного заряда на нѐм. Такой атом водорода способен принимать неподелѐнную пару электронов на частично вакантную орбиталь. В результате возникает слабая связь особого типа, называемая водородной связью. Например, для фтороводорода и воды:
H F: . . . . H F : . . . . H F :
H H H
H O: H O : H O :
Аналогично воде для спиртов характерно образование межмолекулярных водородных связей. В результате такого взаимодействия из молекул
14
