
А Е Щеголев Органическая химия 2016 / 04 Непредельные углеводороды
.pdf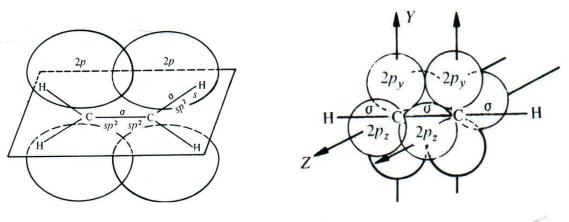
Глава 4. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Непредельные, или ненасыщенные, углеводороды содержат в своѐм составе кратные углерод-углеродные связи, то есть двойные и тройные связи между атомами углерода. Это значит, что помимо -связей в молекулах имеются -связи между атомами углерода. Такими углеводородами являются этиленовые, содержащие одну двойную связь >C=C< ; ацетиленовые — с одной тройной связью -С С- ; а также углеводороды с несколькими кратными связями, среди которых наиболее распространены диеновые — с двумя двойными связями.
4.1. ОБЩНОСТЬ СТРОЕНИЯ И ХИМИЧЕСКИХ СВОЙСТВ
Образование -связи между атомами углерода в молекулах непредельных углеводородов происходит за счѐт бокового перекрывания негибридных р-орбиталей. Оси этих р-орбиталей перпендикулярны осям -связей. При этом в молекуле этилена между атомами углерода имеется одна -связь, а в молекуле ацетилена — две -связи (за счѐт перекрывания двух пар р- орбиталей):
этилен |
ацетилен |
В молекуле этилена все пять -связей (одна связь C–C и четыре связи C–Н) образованы sp2-гибридными орбиталями (гл. 1.2), оси которых лежат в одной плоскости. Поэтому и все шесть атомов, образующих молекулу этилена (два атома углерода и четыре атома водорода), тоже лежат в одной плоскости. Максимум электронной плотности -связи находится по обе стороны этой плоскости. Длина C=C-связи в этилене меньше, чем длина C–C-связи в этане (табл. 1.1), так как sp2-гибридные орбитали, за счѐт которых происходит образование -связей, менее протяжѐнны, чем sp3.
171

В молекуле ацетилена все три -связи (одна связь C–C и две связи C–Н) образованы sp-гибридными орбиталями, оси которых расположены под углом 180 , то есть лежат на одной прямой. Поэтому и все четыре атома молекулы (два атома углерода и два атома водорода) также располагаются на одной прямой. Максимум электронной плотности обеих -связей находится вокруг этой прямой. Длина C C-связи в ацетилене ещѐ меньше, чем длина углерод-углеродной связи в этилене (табл. 1.1), так как sp-гибридные орбитали, за счѐт которых происходит образование -связей, менее протяжѐнны, чем sp2.
Таким образом, атомы углерода, образующие -связи, в молекулах непредельных углеводородов экранированы -электронной плотностью. Это препятствует взаимодействию этих атомов с нуклеофильными реагентами, но становится возможной электрофильная атака (за счѐт электростатического притяжения -электронной плотностью углерод-углеродной связи катиона электрофила или положительного полюса молекулы, проявляющей электрофильные свойства) и, как мы увидим позднее, атака радикальных частиц. Так как прочность -связи меньше, чем -связи, то при взаимодействии непредельного углеводорода с атакующей частицей в первую очередь должна разрываться именно -связь, что приведѐт к образованию новых -связей атомов углерода с частицами реагента:
R |
R' |
|
R |
R |
|||
|
+ X-Y |
|
|
|
|
|
|
C = C |
|
|
R" - C - C - R"' |
||||
|
|
||||||
R" |
R"' |
|
|
|
|
|
|
|
X |
Y |
|||||
Возможность реакции с электрофильными и радикальными частицами с образованием продуктов присоединения может означать, что для данных соединений должны быть характерны реакции электрофильного и радикального присоединения (AE , AR).
4.1.1. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ
Первой стадией электрофильного присоединения (AE) является атака электрофильной частицей субстрата, содержащего кратную связь. Пара электронов -связи более диффузна, слабее удерживается ядрами атомов углерода и поэтому является хорошим объектом для атаки электрофилом. Первоначально образуется -комплекс, затем происходит гетеролитическое расщепление -связи и образование новой -связи (C–Y):
172

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
R' |
|
|
|
R |
X - Y R' |
|
R |
X |
+ Y - |
Y X |
||||||||
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|||||
|
C = C |
+ X - Y |
|
C = C |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
C - C - R' |
|
|
R - C - C - R' |
||||||||||
|
|
|
|
|
|
R" |
- Y |
- |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R" |
R"' |
|
|
|
|
|
|
R"' |
|
R" |
R"' |
|
|
R" R"' |
|||||
|
|
|
|
|
|
|
-комплекс |
|
|
|
-комплекс |
|
|
|
|
|
|||
При этом атакующая частица должна быть либо катионом, либо положительной частью диполя. На последней стадии образующийся карбокатион соединяется с частицей, несущей неподелѐнную пару электронов, обычно это ион (Y ). Установлено, что в ряде случаев (при присоединении галогенов, например) образующийся карбокатион имеет мостиковую структуру:
X
C

 + C
+ C
В этих случаях атака нуклеофила на заключительной стадии осуществляется со стороны, противоположной вступлению электрофила.
Разрыв -связи, то есть превращение -комплекса в карбокатион, является наиболее медленной, лимитирующей стадией этого процесса, поэтому скорость реакции в целом будет зависеть от концентрации и субстрата, и электрофила.
Стереохимия электрофильного присоединения бывает различной. В случаях существования интермедиата (промежуточного соединения) исключительно в виде мостикового иона подход нуклеофила может осуществляться только с противоположной стороны плоскости молекулы субстрата, что приводит к анти-присоединению:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
X - Y |
|
|
X |
|
|
|
|
X |
||
|
|
|
|
|
|
|
|
|
|
|
- |
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
+ |
+ Y |
|
|
|
||||||
|
+ X - Y |
|
|
|
|
|
|
|
|
||||||||
C = C |
C = C |
|
|
C C |
|
|
|
- C - C - |
|||||||||
|
|
|
|
|
|
- Y - |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Y |
||
Но для реакций, идущих без образования мостикового иона, предсказать стереохимию не так легко. Если этот ион имеет относительно большое время жизни, то нуклеофил будет атаковать с любой стороны. Если же существует какой-либо фактор, стабилизирующий определѐнную конфигурацию катиона, то тогда нуклеофильная частица будет присоединяться либо с той же, либо с противоположной стороны, в зависимости от конфигурации.
173

Влияние строения субстрата на скорость и направление реакции
В реакциях электрофильного присоединения электронодонорные заместители повышают реакционную способность -связи, электроноакцепторные группы снижают еѐ. Например, реакционная способность бут-1-ена (этилэтилена, CH2=CH-С2H5) в 100 раз выше, чем этилена CH2=CH2, а цис- пент-2-ена (цис-метилэтилэтилена, CH3-CH=CH-С2H5) — в 4300 раз, тетраметилэтилена (CH3)2C=C(СH3)2 — в 106 раз выше, чем у незамещѐнного этилена в сходных условиях. Это объясняется увеличением электронной плотности -связи по причине присутствия электронодонорных заместителей.
Однако, если атомы углерода двойной связи соединены с акцепторными группами, то происходит уменьшение электронной плотности и снижение реакционной способности. При этом если таких акцепторных групп много (три или четыре), то реакция либо не пойдет вовсе, либо механизм еѐ будет иной. Это относится прежде всего, к полигалогено- и полицианозамещѐнным этиленовым углеводородам.
При сравнении субстратов с двойными и с тройными связями наиболее активными в реакциях электрофильного присоединения оказываются вещества с двойными связями, что можно объяснить несколькими причинами: 1)-электронная плотность тройной связи сильнее притягивается sp- гибридизованными атомами углерода из-за меньшего расстояния между ними, и потому атакующему электрофилу труднее оторвать пару электронов от такой связи; 2) катион, образующийся в результате присоединения электрофильной частицы к тройной связи, менее устойчив, так как не может быть стабилизирован ни сверхсопряжением, ни каким-либо другим видом сопряжения:
R'
|
|
|
+ |
|
+ |
|
R - C |
|
C - R' + E |
|
|
|
R - C=C |
|
|
|
|
|||
|
|
|
||||
E ;
3) превращение образовавшегося катиона в нейтральную молекулу продукта должно произойти при его взаимодействии с анионом из реакционной среды, однако этому препятствует наличие -электронной плотности в катионе.
Ещѐ более активны в AE-реакциях вещества с несколькими двойными связями, в частности диеновые углеводороды с сопряжѐнными двойными связями. Здесь присоединение электрофила протекает легко за счѐт образования карбокатиона, стабилизированного р- -сопряжением:
+ |
|
+ |
|
|
|||||
|
|
||||||||
C = C - C = C + E |
|
|
C = C - C - C - |
||||||
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
||
174

Направление реакции присоединения в общем случае может быть различным, так как при превращении -комплекса в -комплекс электрофильная частица может присоединиться либо к одному, либо к другому атому углерода двойной связи. Так, например, при присоединении Н+ к пропилену (в реакциях с галогеноводородами, водой и аналогичными реагентами) из двух возможных направлений реакции реализуется лишь одно:
|
|
|
+ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
CH3 CH CH3 |
|||||||
CH3 |
CH = CH2 + H |
|
||||||||
|
|
+ |
||||||||
|
|
|
|
CH3 - CH |
|
|
|
CH2 |
||
|
|
|
|
2 |
|
|||||
Это объясняется распределением электронной плотности в молекуле исходного углеводорода и большей устойчивостью образующегося вторичного карбониевого иона за счѐт индуктивных эффектов и эффектов -р- сопряжения.
Во многих случаях при таком присоединении к непредельным углево-
дородам применимо эмпирическое правило Марковникова*: протон из кислот присоединяется к более гидрированному атому углерода кратной связи.
4.1.2. РЕАКЦИИ РАДИКАЛЬНОГО ПРИСОЕДИНЕНИЯ
Реакции присоединения с участием свободных радикалов возможны для непредельных углеводородов в неполярных растворителях в присутствии пероксидов или при инициировании светом. Взаимодействие уже образовавшихся радикалов с другими частицами протекает менее избирательно, чем это имеет место в случае карбониевых ионов. Это взаимодействие включает образование - и -комплексов:
X : Y X + Y
R |
R' |
|
|
|
R |
X |
R' |
|
|
|
R |
X |
||||
X |
|
|
|
|
|
|
||||||||||
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
C - C - R' |
|||
|
C = C |
|
|
|
|
R" |
C = C |
|
|
|
|
|
R" |
|||
R" |
|
|
|
|
R"' |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
R"' |
|
|
|
|
R"' |
|||||||||||
|
|
|
|
|
|
-комплекс |
|
|
|
|
-комплекс |
|||||
Образование -комплекса является лимитирующей стадией большинства AR- реакций (так же, как и АЕ-реакций).
Затем -комплекс, представляющий свободный радикал, взаимодействует с молекулой реагента X-Y, отрывая от неѐ частицу Y.
175

R |
X |
|
Y |
X |
|||
|
|
|
|
|
|
|
|
R" |
C - C - R' + X-Y |
|
R - C - C - R' + X |
||||
|
|||||||
|
|
|
|
|
|
|
|
R"' |
|
R" |
R"' |
||||
Помимо типичных для непредельных углеводородов АЕ- и АR-реакций, общими для них являются реакции радикального замещения, а также другие реакции, протекание которых связано с наличием в структуре углеводорода непредельного фрагмента. Некоторые из них здесь будут рассмотрены.
4.1.3. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ
Реакции радикального замещения (SR), аналогичные алканам (гл. 2.4.1), наблюдаются для непредельных углеводородов только при высоких температурах (400 500 С) и, как правило, с активными радикальными частицами. Типичным примером протекания такой реакции является взаимодействие с хлором по схеме:
R-CH2-CH2-CH=CH2 + Cl2 R-CH2-CHCl-CH=CH2 + HCl
Несмотря на то, что -связь является значительно менее прочной, чем любая -связь в непредельном углеводороде, молекулы этих углеводородов, начиная с пропена, при высоких температурах образуют с хлором исключительно продукты замещения с сохранением кратной связи. Реакция идѐт только по атому углерода, ближайшему к кратной связи. (Этот атом углерода здесь называется -углеродным атомом, а атомы водорода, с ним связанные,
— -водородными атомами).
Такое направление реакции (предпочтительное замещение, а не присоединение) объясняется образованием очень устойчивого радикала, стабилизированного р- -сопряжением:
. .
R - CH2 - CH - CH = CH2 |
|
|
R - CH2 - CH = CH - CH2 |
|
|
При высокой температуре легко преодолевается энергетический барьер разрыва как -связи, так и -связи C–H, и реакция идѐт через образование данного радикала. При этом мезомерный радикал, реагируя с молекулой хлора, может давать два изомерных продукта:
Cl |
|
Cl |
||
|
|
|
|
|
R - CH2 - |
CH - CH = CH2 и |
R - CH - CH = CH - CH |
||
|
|
2 |
2 |
|
176

Ацетиленовые и некоторые диеновые углеводороды ещѐ легче должны вступать в реакции радикального замещения вследствие более полной мезомерной стабилизации промежуточного радикала:
R-CH2-C CH + Cl R-ĊH-C CH + HCl
CH2=CH-CH2-CH=CH2 + Cl CH2=CH-ĊH-CH=CH2 + HCl
Эта реакция лежит в основе пероксидного окисления липидов, одного из наиболее важных окислительных процессов в организме, которому подвергаются их непредельные структурные фрагменты (высшие ненасыщенные карбоновые кислоты). Он инициируется (в организме) гидроксилрадикалами и начинается как типичная реакция радикального замещения с
участием -углеродного атома и молекулярного кислорода: |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
.OH |
|
|
. |
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
H2O |
||||||
|
|
R-CH2-CH=CH2 |
|
|
|
|
|
R-CH-CH=CH2 |
|
|
|
|
R-CH-CH=CH2 |
|
. |
|||||||||||||||||
|
-H2O |
|
|
|
|
|
|
-HO |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O-O. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
R-CH CH=CH2 |
|
|
|
|
|
R-CH |
|
+ |
|
|
CH=CH2 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
O |
OH |
|
|
|
|
O |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
R C |
+ H3C C |
O O2 |
|
C |
O |
|
|
|
|
|
O |
|
|
|||||||||||||||
|
|
|
|
H |
H |
|
|
|
|
|
|
R |
+ |
H3C |
C |
OH |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||||
4.1.4. ДРУГИЕ РЕАКЦИИ
4.1.4.1. Изомеризация
Структурной изомеризации подвергаются непредельные углеводороды с концевым расположением кратной связи. Под действием сильных оснований происходит отщепление протона от -углеродного атома. Образуются мезомерные анионы, которые и будут в дальнейшем присоединять протон, но с образованием более устойчивого углеводорода — с внутренним расположением кратной связи.
Для алкенов эта реакция протекает при температуре выше 400 С по схеме:
RCH -CH=CH |
|
|
|
- |
- |
|
+ H |
|
+ RCH=CH-CH |
||
|
|
|
RCH-CH=CH |
|
RCH=CH-CH |
|
|
||||
|
|
+ |
|
||||||||
2 |
2 - H |
|
2 |
2 |
3 |
||||||
177
Для алкинов обычно требуется значительно меньшая температура (до 180 С) при использовании спиртовой щѐлочи. Реакция протекает через образование алкилаллена:
R-CH2-C CH [R-CH=C=CH2] R-C C-CH3
4.1.4.2. Полимеризация
Полимеризация — это процесс последовательного присоединения молекул непредельных соединений друг к другу за счѐт разрыва -связей с образованием вещества того же состава, но с большей молекулярной массой. Молекулы алкенов называют мономерами, продукты полимеризации — полимерами.
В общем виде схему полимеризации можно представить так:
R' |
R'' |
|
|
R' |
R'' |
||||
|
|
|
|
|
|
|
|
|
|
n |
C = C |
|
|
- C - C - |
|||||
|
|||||||||
R |
R''' |
|
|
|
|
|
|
||
|
|
R' |
R''' n |
||||||
|
|
|
|
|
|
R |
|
R' |
|
n R - C =C - R' |
|
|
|
|
|
C = C |
|||
|
|
|
|
|
|||||
n
где n — степень полимеризации
В зависимости от структуры непредельного соединения и примененного инициатора полимеризация может осуществляться по ионному (катионному и анионному) и радикальному механизмам. Катионная полимеризация непредельных соединений инициируется протонными кислотами и кислотами Льюиса. Анионная полимеризация, то есть полимеризация в присутствии оснований, возможна для тех непредельных соединений, которые могут образовывать относительно стабильный карбанион. Для радикальной полимеризации необходимо наличие небольшого количества кислорода или пероксида, которые легко образуют свободные радикалы.
4.1.4.3. Окисление
Непредельные углеводороды окисляются легко, с участием -элек- тронов кратных связей. В зависимости от условий проведения реакции и природы субстрата образуются различные продукты, и поэтому данные реакции могут использоваться как способы получения представителей разнообразных классов органических соединений.
1. Окисление кислородом воздуха без катализатора и окисление диоксидом селена. Это реакция радикального замещения по -углеродному ато-
178

му. В зависимости от условий образуются непредельные спирты или карбонильные соединения. Например:
CH2=CH-CH3 |
[O] |
CH2=CH-CH2OH |
аллиловый спирт |
|
CH2=CH-CH=O |
акролеин |
|
|
|
Механизм реакции при окислении диоксидом селена может быть представлен в следующем виде:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
CH |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
|
|
|
Se O |
|
|
|
|
|
|
HC |
Se O |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
CH2=CH-CH3 + SeO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C |
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
OH |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
2 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
CH2 |
|
|
|
|
CH2 |
Se OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
HC |
Se OH |
|
HC |
|
|
|
|
|
|
|
|
|
CH2=CH-CH=O + Se |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
H2C |
|
|
|
|
|
|
CH |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
CH2=CH-CH2OH [+ SeO] |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
2. Образование эпоксисоединений: |
|
|
|
|
|
|
|
|
|
(2SeO |
|
|
SeO2 + Se) |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
R' |
|
R'' |
|
[O] |
|
|
R' |
|
|
|
O |
R'' |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
C = C |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
C |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
R |
R"' |
|
|
|
|
|
R |
|
|
|
|
R"' |
|
|
|
|
|
|
|
||||||||||||
При этом при окислении этилена кислородом воздуха на серебряном катализаторе при 250 С образуется эпоксиэтан (этиленоксид):
CH2=CH2 O2/Ag CH2 - CH2
O
Эпоксипроизводные других алкенов можно получить применением органических пероксикислот RCOOOH (реакция Прилежаева, гл. 6.4.6). При этом алкильные группировки при двойной связи облегчают окисление пероксикислотами, а сопряжѐнные двойные связи, а также тройные связи окисляются труднее.
3. Реакция Вагнера*. Это окисление этиленовых углеводородов разбавленным (1%-м) раствором KMnO4 в щелочной среде с образованием гликолей.
179

R |
R' |
|
|
|
|
|
|
R |
|
R' |
|
|
|
|
|
|
|
|
|
R' |
R" |
||||||
O |
O |
|
|
|
C |
O |
O |
|
|
|
H2O |
||||||||||||||||
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
C-R"' |
|||||||||||||||
|
|
|
|
|
+ |
|
Mn |
|
|
|
|
|
|
Mn |
|
|
|
|
|
|
|
|
R-C |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
C |
|
|
|
O |
O |
- |
|
|
|
C |
O |
O |
- |
-[MnO3 ] |
|
|
|
|
|
||||||||
R"' |
|
|
|
R" |
OH |
OH |
|||||||||||||||||||||
R" |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
R"' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
(2MnO3- |
|
|
|
MnO2 + MnO42-) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
Ацетиленовые углеводороды тоже окисляются раствором перманганата калия. Окраска реакционной смеси меняется от фиолетовой до бурой, в связи с чем, эта реакция используется как качественная на кратную углеродуглеродную связь.
Тот же продукт окисления образуется и при окислении алкенов тетраоксидом осмия. Последний токсичен и дорог, но даѐт лучшие выходы и используется только в тонком органическом синтезе. Механизм реакции окисления тетраоксидом осмия аналогичен механизму окисления перманганатом калия, но благодаря отсутствию побочных процессов выходы достигают
90%.
R |
R' |
|
|
R |
|
R' |
|
|
R' |
R" |
|
O |
O |
C |
O |
O |
H2O |
||||||
C |
|
|
R-C |
C-R"' |
|||||||
C |
|
+ |
Os |
|
C |
|
Os |
|
|||
R"' |
O |
O |
R" |
O |
O |
|
OH |
OH |
|||
R" |
|
|
R"' |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
4. Окисление в жѐстких условиях. При действии концентрированного раствора перманганата калия или раствора дихромата калия кратная связь в молекулах непредельных углеводородов разрывается полностью. Из этиленовых углеводородов в этих условиях образуются альдегиды или кетоны и карбоновые кислоты:
R' |
[O] |
R' |
|
|
C = CH - R'' |
|
C = O |
+ R'' - COOH |
|
|
|
|||
|
|
|||
R |
|
R |
. |
|
Ацетиленовые углеводороды превращаются в соответствующие карбоновые кислоты:
[O]
R - C=C - R'
O
=
R - C
O = - C - R'
[O]
R - COOH + R'- COOH .
5. Озонирование (озонолиз). Действие озона на непредельные углеводороды приводит к образованию озонидов, которые легко гидролизуются до карбонильных соединений:
180
