
А Е Щеголев Органическая химия 2016 / 08 Алициклические углеводороды и их производные
.pdf
Глава 8. АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ
Алициклические соединения содержат в молекулах один или несколько насыщенных или ненасыщенных (но не ароматических) циклов, состоящих из атомов углерода. Основой таких соединений являются соответствующие углеводороды. По числу циклов в молекулах различают моноциклические (циклоалканы, циклоалкены и т.д.) и полициклические углеводороды.
Моноциклические соединения могут содержать разное число атомов в цикле: это малые циклы (3 или 4 атома), нормальные (или обычные) (5 7 атомов) и макроциклы, подразделяемые, в свою очередь, на средние (8 11 атомов) и большие (12 атомов и более).
Полициклические соединения по взаимному расположению колец делят на:
соединения с изолированными циклами (циклы не содержат общих атомов), например:
 CH2
CH2 
спирановые — соединения, имеющие один общий атом углерода для двух циклов, например:
конденсированные — соединения, имеющие два общих атома углерода для двух циклов, например:
мостиковые — соединения, имеющие три и более общих атома углерода для двух циклов, например:
CH2
374

8.1. НОМЕНКЛАТУРА МОНО- И БИЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Названия циклоалканов по заместительной номенклатуре образуют, добавляя приставку цикло- к названию соответствующего алифатического соединения, содержащего такое же число атомов, как и в цикле. Для углеводородов с кратными связями и для соединений, содержащих функциональные группы, применяют те же принципы и правила составления названий, что и для алифатических соединений. Например:
H2C |
|
|
|
|
|
|
|
|
CH3 |
||
|
|
|
|
||||||||
CH2 |
или |
|
|
|
|
O |
|||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
||||||
H2C |
|||||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
циклопропан |
циклогексанон 2-метилциклопент-1,3-диен |
||||||||||
|
|
||||||||||
За основу названий бициклических соединений с изолированными циклами выбирается наибольший цикл, например:
— циклобутилциклогексан
В случае спиранов за основу выбирается название алифатического углеводорода с тем же общим числом атомов углерода, перед которым ставится приставка спиро- и цифры (в квадратных скобках, в порядке возрастания), указывающие число атомов в каждом из циклов, связанных со спироатомом. Нумерация начинается со спироатома, сначала нумеруется больший цикл, затем — меньший. Например:
3 |
2 |
|
10 |
|
|
|
4 |
|
|
1 |
|
|
9 |
|
|
|
|
|
— спиро[4.5]декан |
|
|
|
|
|
|
|
|
5 |
|
|
|
7 |
|
8 |
|
|
|
|
|||
|
6 |
|
|
|
||
Для конденсированных и мостиковых алициклических соединений основой названия также служит название алифатического углеводорода, имеющего то же общее число атомов углерода; в приставке указывается число циклов и после слова «цикло» цифрами в квадратных скобках — число атомов углерода в каждом цикле между узловыми (общими для двух циклов) атомами (но здесь в порядке уменьшения). Нумерация начинается с одного из узловых атомов, нумеруется сначала больший цикл, нумерация которого заканчивается другим узловым атомом, затем нумеруются оставшиеся атомы меньшего кольца. Например:
375

4 5 6 OH
3 |
|
|
|
|
|
|
|
|
|
— бицикло[3.2.0]гептан-6-ол, |
|
|
|
|
|
|
7 |
|
|||
2 |
|
1 |
|
|||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
1 |
|
|
|
2 |
|
|
||||
8 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
CH3 |
|||||
|
9 |
|
|
|
— 9-метилбицикло[4.2.1]нонан. |
|||||
7 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6 |
|
|
|
5 |
|
|
||||
Для некоторых полициклических соединений используются тривиальные названия, например:
декалин |
адамантан |
8.2. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ И ИЗОМЕРИЯ ЦИКЛОАЛКАНОВ
ВXIX столетии после создания А.М. Бутлеровым теории строения органических соединений было общепризнано, что среди циклических соединений должны существовать вещества, молекулы которых содержат пять или шесть атомов углерода в цикле. Соединения с меньшим и большим размером цикла были синтезированы позже (в 1883 году были получены циклопропанкарбоновая и циклобутанкарбоновая кислоты). И уже в 1885 году выдающийся немецкий химик-органик А. Байер* высказал предположения о стабильности циклоалканов и факторах, еѐ определяющих.
Воснове созданной Байером «теории напряжения» лежат два постулата. Он полагал, что 1) все циклоалканы плоские и 2) любое отклонение
валентного угла в плоском цикле от тетраэдрического (109 28 ) вызывает внутреннее напряжение цикла. Угловое напряжение, или напряжение Байера, вызвано растяжением или сжатием валентных углов и отклонением их от тетраэдрического 109 28 . Эта теория объясняла немногие известные в то время факты стабильности пяти- и шестичленных циклов и более низкой стабильности трѐх- и четырѐхчленных циклов, но она ставила под сомнение само существование макроциклов, для которых напряжение в плоском цикле должно быть очень значительным.
376

Термин «напряжение» — термодинамическая характеристика стабильности цикла. Общая энергия напряжения является суммой трѐх основных составляющих. Кроме углового напряжения на стабильность цикла влияют напряжения заслонѐнных, противостоящих С–Н-связей и так называемое трансаннулярное напряжение. Напряжение заслонѐнных С–Н-
связей, или торсионное напряжение, напряжение Питцера*, по своей природе аналогично отталкиванию атомов водорода в заслонѐнной конформации этана и других предельных углеводородов для двух заслонѐнных С–Н-связей. Трансаннулярное напряжение, или напряжение Прелога, обусловлено взаимодействием в пространстве двух или большего числа атомов водорода при противоположных атомах углерода в цикле.
8.2.1. ЦИКЛОПРОПАН
Циклопропан представляет собой плоский правильный треугольник с валентными углами ССС = 60 , НСН = 114 , а углами между орбиталями, образующими С–С-связи 104 . Длина углерод-углеродной связи составляет 0.151 нм, т.е. она короче по сравнению с С–С-связью в алканах
(0.1543 нм).
H H
|
1,51 Å |
|
60o |
H |
Ho |
|
116,5 |
H |
H |
При перекрывании атомных орбиталей углерода образуются банановые связи, или -связи (гл. 1.3.1), они имеют более высокий р-характер (83%) и меньший s-характер (17%) по сравнению с sp3-типом гибридизации атомных орбиталей углерода в алканах. Формально это соответствует гибридизации sp4.17 — это согласуется (по Л. Полингу — гл. 1.2) с углом между орбиталями (104 ). Две другие гибридные орбитали углерода, которые образуют С–Н-связи, напротив, имеют более высокий s- характер и меньший р-характер. По существу они очень близки к sp2- орбиталям (по Полингу тип гибридизации, соответствующий валентному углу 116.5 , sp2.28). Плоскость, проходящая через два атома водорода и
377

атом углерода СН2-группы, перпендикулярна плоскости самого циклопропана.
Общее напряжение в молекуле циклопропана определяется наличием не только углового напряжения, обусловленного «изогнутыми» С–С- связями, но и торсионного напряжения. Все шесть связей С–Н находятся в заслонѐнной конформации:
|
|
|
H |
|
|
|
H |
|
C H H |
|
|
|
C |
|
|
C |
|
|
|
|
|
||
|
H |
|
|
H |
|
Общая энергия |
напряжения |
в |
молекуле циклопропана |
составляет |
|
115 кДж/моль, |
а доля в |
ней |
торсионного напряжения |
— 22% |
|
(25 кДж/моль). |
|
|
|
|
|
8.2.2. ЦИКЛОБУТАН
Циклобутан представляет собой неплоский четырѐхугольник с валентными углами ССС = 88 , НСН = 107 . Длина углерод-углеродной связи даже несколько больше, чем в алканах, и составляет 0.1551 нм.
|
H |
H |
|
|
|||
|
|
|
|
|
|||
|
H |
|
|
|
|
|
|
|
|
|
25o |
|
|
||
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
107o |
88o |
H |
|
|
|||
|
|
H |
|
|
|||
H |
|
|
|
|
|||
В циклобутане, так же как и в циклопропане, существует угловое и |
|||||||
торсионное напряжение. |
Его общая энергия напряжения |
близка |
|||||
(110 кДж/моль) к энергии напряжения циклопропана, |
17.5oH |
H |
|||||
хотя угловое напряжение здесь даѐт меньший вклад |
|
|
|
||||
|
|
|
|
||||
по сравнению с циклопропаном, поскольку даже в |
|
|
|
|
|||
плоском циклобутане валентный угол был бы равен |
|
|
H H |
||||
|
|||||||
90 . Но в гипотетическом плоском циклобутане долж- |
|||||||
378

на быть значительно больше энергия торсионного напряжения за счѐт 8 атомов водорода, которые находились бы в заслонѐнной конформации. В неплоской конформации атомы водорода оказываются уже не в заслонѐнном, а в несколько скошенном положении; величина торсионного угла составляет 17.5 .
8.2.3. ЦИКЛОПЕНТАН
Молекула циклопентана неплоская, хотя в гипотетическом плоском циклопентане валентные углы должны быть 108 , что очень близко к значению тетраэдрического угла 109.5 . Здесь существует только торсионное напряжение. Однако в плоской молекуле оно было бы значительно больше за счѐт всех 10 атомов водорода, находящихся в заслонѐнной конформации друг к другу. Реальная молекула циклопентана напоминает «открытый конверт».
H H
H H  H
H
104.5o
H
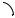 H H
H H
H H
За счѐт скошенной конформации происходит некоторое искажение валентных углов ( ССС = 104.5 ). В результате напряжѐнность молекулы составляет величину порядка 26 27 кДж/моль.
8.2.4.ЦИКЛОГЕКСАН
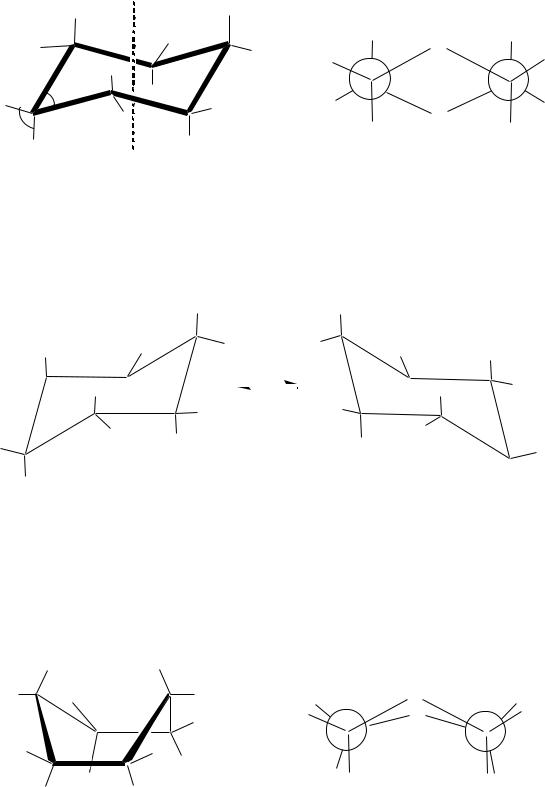
Вмолекуле циклогексана полностью отсутствует напряжение. Молекула находится в форме кресла. Это наиболее устойчивая конформация. В этой конформации все валентные углы близки к тетраэдрическому и все связи С–Н находятся в заторможенном положении.
Связи С–Н, параллельные воображаемой оси молекулы циклогексана, и атомы водорода этих связей называются аксиальными (а). Другие шесть С–Н-связей, расположенные примерно параллельно усреднѐнной
плоскости кольца (под углом 107.5 к аксиальным связям), и атомы водорода этих связей называются экваториальными (е).
379
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
H e |
a |
|
H |
|
a |
|
H |
|
H |
|
|
|
|
e |
|
CH2 |
|||||
|
|
|
|
e |
|
H |
H |
H |
|||
|
|
|
|
H |
|
|
|
|
|||
|
|
|
|
a |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
o |
a |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
||
H e |
111 |
e |
|
H |
|
H |
|
H |
|||
|
|
|
e |
|
CH2 |
||||||
|
o |
a |
|
H |
a |
|
|||||
107.5 |
|
|
|
|
H |
H |
|||||
|
|
|
H |
|
|
|
|
||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конформация «кресло»
Энергетический барьер перехода одной кресловидной конформации в другую составляет 45 кДж/моль, при этом все аксиальные атомы водорода становятся экваториальными, и наоборот все экваториальные — аксиальными:
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
||
|
H |
|
|
|
e H |
|
a 1 |
e H |
|
|
|
a |
4 |
|
H e |
|
H |
|
|
|||
|
|
|
|
|
|
|
|
|
|
H e |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
e a |
5 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
a 6 |
eH |
||
|
H |
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
a |
H |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
a |
3 |
H |
2 |
e |
H |
|
|
|
|
|
H |
e |
3 |
H |
a |
2 |
|
|
||
|
|
|
|
e |
|
a |
|
|
|
|
|
|
|
|
|
e |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
H |
|
|
|
|||||
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H e 4 |
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|
1 e H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||
Этот процесс носит название конверсии цикла.
Существуют и другие конформации молекулы циклогексана, но все они обладают энергией большей, чем конформация кресла. Так, в конформации «ванна» меняется положение водородных атомов при С1, С2 и С6. Атомы водорода при С2 и С3 становятся заслонѐнными, такая же ситуация и при атомах углерода С5 и С6.
|
H |
H |
|
|
|
|
H 4 |
H |
1 |
H |
H |
CH2 |
H |
|
||||||
|
5 |
6 H |
H |
CH2 |
H |
|
|
|
|
||||
H |
3 |
2 H H |
|
H H |
|
H |
|
H |
|
|
|
||
|
H |
|
|
|
H |
|
|
H |
|
|
|
|
|
конформация «ванна»
Кроме того, возникает отталкивание аксиальных атомов водорода при С1 и С4. В целом конформация ванны на 30 кДж/моль выше по энергии по сравнению с кресловидной формой.
380

При скручивании ванны для придания более устойчивой гош- конформации образуется твист-форма («скошенная ванна»):
H H
H
H
H H 

 H
H
H H H
В этой конформации снято напряжение между атомами водорода при С1 и С4, но атомы водорода при С2 и С3, а также при С5 и С6 частично остаются в заслонѐнной форме. Поэтому по энергии твист-конформация менее стабильна, чем конформация кресла. Равновесная смесь конформеров циклогексана содержит при 293 К 99.99% кресловидной формы, а сам процесс конверсии цикла осуществляется с частотой порядка 105 превращений в секунду при 25 С.
8.3. ХИМИЧЕСКИЕ СВОЙСТВА
Циклоалканы с разным размером цикла имеют разную энергию напряжения и поэтому должны по-разному вести себя в химических реакциях. Так, для малых циклов, у которых энергия напряжения оценивается в 110 115 кДж/моль, могут быть характерны реакции присоединения с раскрытием кольца.
Нормальные циклы (5 7-членные) имеют незначительную энергию напряжения или не имеют еѐ совсем (для циклогексана). Для таких соединений характерны те же реакции, что и для алифатических углеводородов и их производных.
Однако в макроциклах имеется трансаннулярное напряжение, что отражается на химическом поведении таких веществ.
Идентификация циклоалканов, как и алканов, с помощью производных почти невозможна. Исключение составляет циклопропан, который способен к превращениям в многообразные соединения за счѐт раскрытия цикла.
8.3.1. РЕАКЦИИ ЦИКЛОПРОПАНА, ЦИКЛОПРОПЕНА И ИХ ПРОИЗВОДНЫХ
Для циклопропана и его производных характерны реакции: 1) присоединения с раскрытием цикла, 2) замещения с сохранением структуры
381

трѐхчленного кольца, а также реакции изомеризации, которые будут рассмотрены отдельно.
Такое разнообразие свойств обусловлено природой -связей между атомами углерода, которые как по геометрии, так и по прочности занимают промежуточное положение между - и -связями.
Циклопропановое кольцо устойчиво к действию озона и разбавленного раствора перманганата калия. Это отличает его от алкенов:
O3
KMnO4
Однако циклопропан подвергается каталитическому гидрированию, но в более жѐстких условиях, чем алкены:
Ni, 390 |
K |
+ H2 |
CH3CH2CH3 |
Pt, 320 |
K |
Присоединение с раскрытием кольца происходит также при нагревании с водными растворами галогеноводородов:
|
H O, t o |
|
|
||
CH3 + HBr |
2 |
|
CH3-CH2- |
CH-CH3 |
|
|
|
|
|||
|
|
|
|
||
|
|
|
|
Br |
|
Механизм в данном случае электрофильный (АЕ), направление реакции определяется стабильностью образующегося карбокатиона или распределением электронной плотности в исходной молекуле:
|
|
|
|
|
+ |
H2C |
|
+ |
- |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
H |
|
|
CH2-CH2-CH-CH3 |
Br |
||
|
|
|
|
|
|
|
|
|
|||
|
|
|
CH3 |
|
|
CH |
CH3 |
|
|
||
|
|
|
|
|
|
H2C |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
H+ |
|
|
|
|
метилциклопропан |
|
-комплекс |
|
|
|
|
|||||
CH3-CH2-CH-CH3
Br
2-бромбутан
Однако сухой бромоводород не расщепляет циклопропановое кольцо даже при нагревании.
382

Возможно также присоединение галогенов к циклопропану на свету. Это реакции радикального присоединения. При этом при бромировании других побочных продуктов не образуется:
+ Br2 h  BrCH2CH2CH2Br
BrCH2CH2CH2Br
1,3-дибромпропан
А при хлорировании в зависимости от температуры процесса может идти как присоединение с раскрытием кольца (АR), так и замещение (SR), с сохранением циклической структуры субстрата:
|
|
|
h , T>370K |
|
ClCH2CH2CH2Cl |
||
+ Cl2 |
|
|
h , T~300K |
||||
|
|
|
|
Cl + HCl |
|||
|
|
|
|||||
|
|
||||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклопропен, в отличие от циклопропана, значительно менее стабилен. Его энергия напряжения составляет примерно 280 кДж/моль. В обычных условиях он быстро разрушается. Одно из направлений такой реакции
— полимеризация, которая протекает уже при температуре около -70 С. Циклопропен стабилен только в твѐрдом виде, он хранится в жидком азоте (при температуре -196 С). Стабильность молекулы возрастает при введении заместителей ко всем трѐм углеродным атомам.
Своеобразным свойством циклопропена является образование стабильного карбокатиона циклопропенилия:
R |
R |
R |
R |
R |
R |
R |
R |
|
|
|
+ |
+ |
|
|
+ |
|
+ |
|
|
|
|
|
|
|
R |
|
R |
R |
|
|
R |
Этот катион является самой простой циклической сопряжѐнной системой и, в соответствии с рассмотренными далее критериями ароматичности, является ароматической системой (гл. 9.1, 9.8).
8.3.2. РЕАКЦИИ ЦИКЛОБУТАНА И ЕГО ПРОИЗВОДНЫХ
Циклобутан значительно менее реакционноспособен, чем циклопропан. Реакции раскрытия цикла не протекают ни под действием галогенов, ни под действием галогеноводородов. Четырѐхчленное кольцо разрушается только гидрированием на платине при значительном нагревании:
383
