
А Е Щеголев Органическая химия 2016 / 11 Полициклические ароматические углеводороды и их производные
.pdf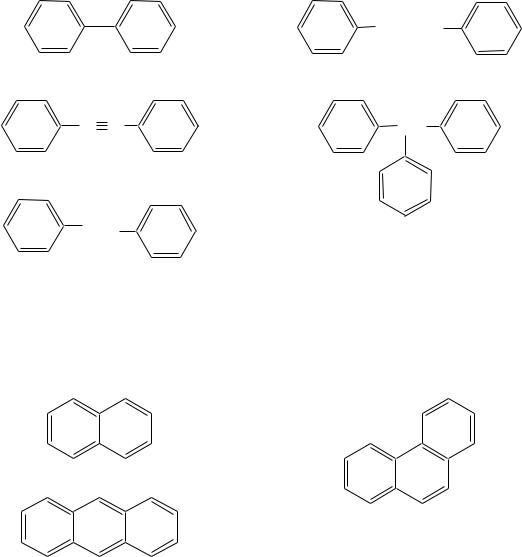
Глава 11. ПОЛИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ И ИХ ПРОИЗВОДНЫЕ
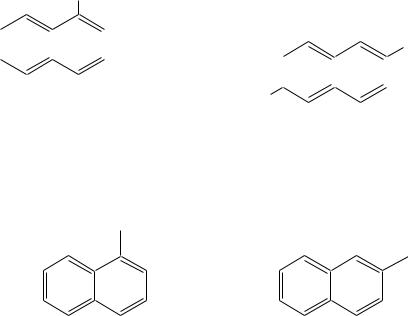
Полициклические соединения содержат несколько бензольных колец. Их молекулы могут содержать как изолированные, так и конденсированные друг с другом циклы.
К соединениям с изолированными бензольными кольцами относят дифенил (бифенил), стильбены, толан, полиарилметаны и их производные:
|
CH=CH |
дифенил |
E- и Z-стильбены |
C C |
CH |
толан |
|
CH2 |
трифенилметан |
дифенилметан |
|
Наличие изолированного бензольного кольца в молекулах этих соединений во многом определяет их строение и важнейшие свойства.
К соединениям с конденсированными бензольными кольцами относят, например, нафталин, антрацен, фенантрен и их производные:
нафталин
фенантрен
антрацен
Эти углеводородные системы обладают большей специфичностью в химическом поведении, чем молекулы с изолированными циклами, они также являются структурной основой для многих природных и биологически важных веществ. Поэтому в данной главе будут рассмотрены соединения с конденсированными бензольными кольцами.
574
11.1. КЛАССИФИКАЦИЯ УГЛЕВОДОРОДОВ
СКОНДЕНСИРОВАННЫМИ ЦИКЛАМИ
Взависимости от расположения нескольких циклов относительно друг друга полициклические углеводороды можно разделить на три груп-
пы: линейные (или линейные ацены), ангулярные (или ангулярные фены) и
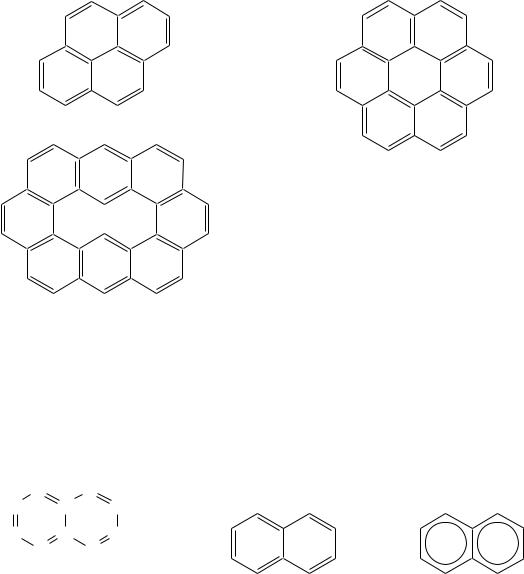
перициклические. К представителям линейных аценов относятся нафталин
иантрацен (см. выше). К представителям ангулярных фенов относится фенантрен (см. выше). Примерами перициклических углеводородов могут служить пирен, коронен, овален:
пирен
коронен
овален
11.2. НАФТАЛИН
Нафталин — конденсированная система, состоящая из двух бензольных колец. Эти кольца имеют два общих атома углерода:
H |
H |
|
|
HC C |
C C |
CH |
|
HC C |
C C CH |
|
|
H |
H |
, или |
, или |
Нафталин широко применяется для производства фталевого ангидрида, нафтолов, нафтиламинов и других производных, используемых в производстве красителей, а также в производстве лекарственных препаратов и дубильных веществ. Используется и в качестве инсектицида.
575
11.2.1. СТРОЕНИЕ, ИЗОМЕРИЯ, НОМЕНКЛАТУРА
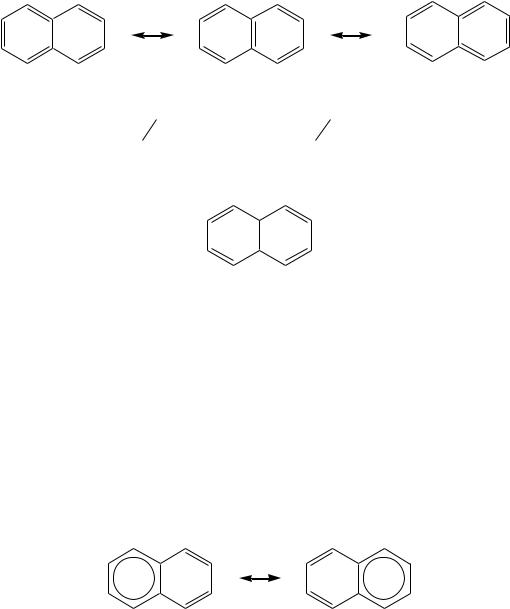
Все атомы углерода молекулы нафталина расположены в одной плоскости, атомные орбитали, участвующие в образовании -связей, находятся в гибридизации, близкой к sp2, а негибридные pz-орбитали образуют единую бициклическую сопряжѐнную систему. Поэтому молекулу нафталина можно представить в виде трѐх граничных структур:
a |
b |
a |
b |
a |
b |
|
|
||||
d |
c |
d |
c |
d |
c |
Из них следует, что связи а, b, c и d обладают разным -характером. Так, для связей а, c и d это 13 , а для связи b — 2 3 . Другими словами, связь b
по характеру ближе к двойной, а остальные углерод-углеродные связи — к ординарным. Это условно можно изобразить следующей структурой:
Это подтверждается и квантово-химическими расчѐтами: связь b имеет больший -характер (0.725 ) по сравнению с другими углеродуглеродными связями.
Длины углерод-углеродных связей в молекуле нафталина также неодинаковы: длина связи b составляет 0.138 нм, а других углеродуглеродных связей — 0.141 0.142 нм.
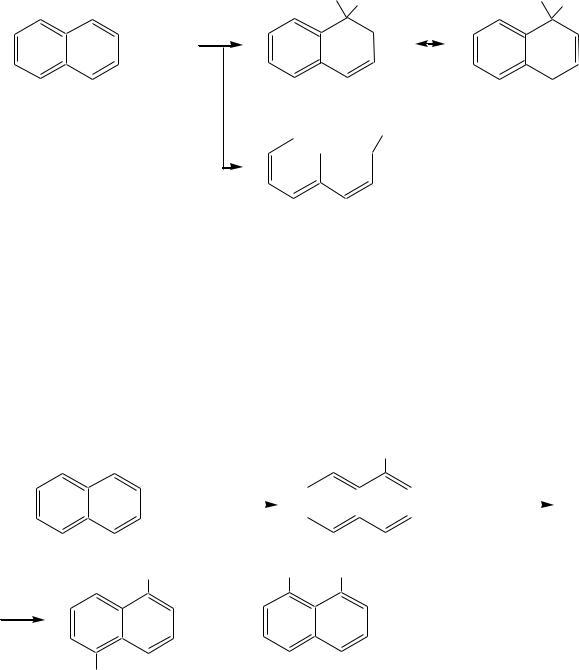
Каждый из шестичленных циклов в молекуле нафталина (один из двух) обладает ароматичностью, так как представляет собой 6- - электронную циклическую сопряжѐнную систему. Оставшиеся четыре атома углерода можно представить диеновой системой, соединѐнной с бензольным кольцом:
Нафталин обладает ароматичностью, однако его ароматичность ниже ароматичности бензола, поскольку электронная плотность распределена неравномерно.
В отличие от молекулы бензола атомы углерода в нафталине неодинаковы. Ниже приведена общепринятая нумерация в нафталиновой систе-
576
ме и обозначения атомов углерода при помощи греческих букв с учѐтом имеющихся плоскостей симметрии:
8 |
9 |
1 |
|
|
||||
7 |
|
|
|
2 |
|
|||
|
|
|
|
|
||||
|
|
|
|
|
|
3 |
||
6 |
10 |
4 |
||||||
|
|
|||||||
5 |
|
|
|
|
||||
|
|
|
|
|
|
|
||
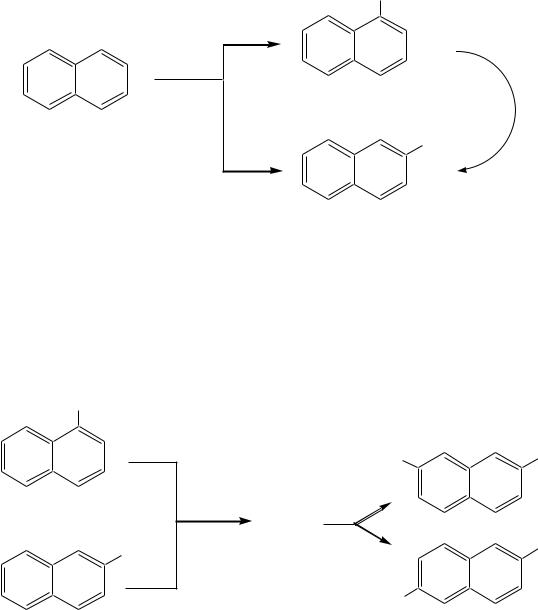
Поэтому для монозамещѐнных нафталинов возможны - и -изомеры:
X
X
-замещѐнный нафталин |
-замещѐнный нафталин |
Положение заместителей в дизамещѐнных нафталинах может быть обозначено как цифровыми локантами, так и в некоторых случаях при-
ставками орто-, мета-, пара-, пери-, амфи-:
X |
X |
X |
|
X |
|
|
|
X |
орто-изомер |
мета-изомер |
X |
|
|
пара-изомер
X X
X
|
X |
пери-изомер |
амфи-изомер |
Всего же возможно для дизамещѐнных нафталинов 10 структурных изомеров в случае одинаковых заместителей и 14 — в случае разных. Примеры названий:
577
NO2
|
|
|
|
|
|
|
|
|
|
SO3H |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
O2N |
||||
|
|
NO2 |
||||||||
1,5-динитронафталин |
6-нитронафталин-2-сульфокислота, или |
|||||||||
|
|
|
|
|
|
амфи-нитронафталинсульфокислота |
||||
Углеводородные радикалы, образованные от нафталина, носят на-
звание нафтилы:
-нафтил |
-нафтил |
11.2.2. СВОЙСТВА
Нафталин — бесцветное кристаллическое вещество, летучее, с характерным запахом. Температура плавления 80 С, температура кипения 218 С. Аналогично углеводородам ряда бензола нафталин незначительно растворим в воде, но хорошо — в неполярных и малополярных органических растворителях.
Химические свойства нафталина должны определяться, с одной стороны, наличием ароматической системы, а с другой стороны — способностью к взаимодействиям, связанным с присутствием диенового фрагмента.
11.2.2.1. Электрофильное замещение
Реакции SE для нафталина протекают легче, чем для бензола. Это объясняется: 1) неравномерностью распределения -электронной плотности, а значит, большей скоростью образования -комплекса; 2) сохранением ароматичности системы на стадии образования -комплекса, что не требует затрат на преодоление энергии делокализации ароматического кольца.
Направление электрофильного замещения — преимущественно в-положение. Это можно объяснить сравнением устойчивости-комплексов, представив нафталиновую систему чередующимися -свя- зями и учитывая повышенный -характер связи С1–С2:
578
+ E+
H E |
H E |
|
+ |
|
+ |
+H

 E
E
Так как связь С9–С10 имеет низкий -характер, то полного сопряжения между кольцами нет или, другими словами, -электронная проводимость между кольцами невелика. Поэтому граничные структуры представлены без учѐта участия второго кольца в делокализации положительного заряда.
Типичными примерами SE-реакций здесь являются нитрование, сульфирование и хлорирование. Нитрование смесью концентрированных азотной и серной кислот протекает легко и в избытке реагента при 50 С приводит к смеси 1,5- и 1,8-динитронафталинов:
NO2
|
HNO3 + H2SO4 |
|
|
|
|
|
|
HNO3 + H2SO4 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
NO2 NO2 |
+
NO2
1,5-динитронафталин 1,8-динитронафталин
То есть как первая, так и вторая нитрогруппы вводятся в одно из-положений. Но реакция введения второй нитрогруппы осуществляется в другое, незамещѐнное, кольцо. Образование динитропроизводных происходит примерно в тех же условиях, что и мононитропроизводных по причине незначительного влияния нитрогруппы в мононитронафталине на незамещѐнное кольцо.
579
Сульфирование нафталина в обычных условиях, так же как и нитрование, приводит к моно- и дизамещѐнным производным. Однако структура молекул продуктов сульфирования здесь сильно зависит от температурного режима. -Изомер образуется при 60 С, но при температуре 160 С он перегруппировывается в термодинамически более стабильный -изомер:
SO3H
333 K
H2SO4
433 K
SO3H
433 K
Вторая сульфогруппа вводится в незамещѐнное кольцо. При этом из-нафталинсульфокислоты образуется в основном смесь 1,5-, 1,7- и 2,7- нафталиндисульфокислот (причѐм при низкой температуре преимущественно 1,5-изомер до 60 70% от теоретического), а из -изомера — смесь 1,6-, 1,7-, 2,6- и 2,7-нафталиндисульфокислот. Хотя при продолжительном нагревании в любом случае образуются только две нафталиндисульфокислоты — 2,6- и 2,7-изомеры:
SO3H |
|
|
|
HO3S |
SO3H |
H2SO4, t |
. . . |
|
|
SO3H |
|
SO3H |
|
|
|
|
|
|
HO3S |
|
Хлорирование нафталина на хлориде алюминия протекает при |
||
110 С. При монохлорировании образуется в основном |
-изомер. Даль- |
|
нейшее введение атомов хлора протекает неселективно как в одно, так и в оба кольца. Среди дихлорпроизводных преобладают 1,4- и 1,5-изомеры (возможно, по пространственным причинам). Но в избытке хлора продолжительное проведение реакции приводит к перхлорнафталину:
580
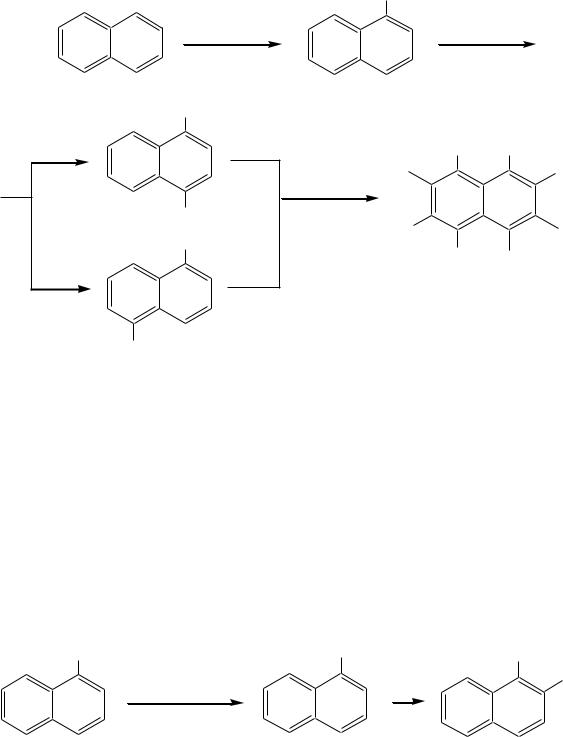
Cl
Cl2 / AlCl3, t |
Cl2 / AlCl3, t |
||
|
1-хлорнафталин |
|
|
Cl |
|
|
|
|
Cl |
Cl |
|
|
Cl |
Cl |
|
|
Cl2 / AlCl3, t |
|
|
Cl |
Cl |
Cl |
|
Cl |
|||
Cl |
|
||
|
Cl |
||
Cl
1,4- и 1,5-дихлорнафталины
Причина такого направления протекания реакции хлорирования, в отличие от нитрования и сульфирования, в значительно меньшем акцепторном влиянии атома хлора как заместителя в ароматическом кольце, что и делает электрофильное замещение неселективным.
В целом для монозамещѐнных нафталинов влияние заместителя распространяется, главным образом, на замещѐнное кольцо. Если активирующая электронодонорная группа находится у -углеродного атома, электрофил направляется, как правило, в четвѐртое положение (в меньшей степени во второе). Типичным примером может служить нитрование-нафтола, причѐм продуктом динитрования является 2,4-ди- нитронафталин-1-ол:
OH |
OH |
OH |
NO2
HNO3 + H2SO4
|
|
|
|
|
|
|
|
|
|
|
NO2 |
NO |
||
|
|
|
2 |
|
нафталин-1-ол |
4-нитронафталин-1-ол |
2,4-динитронафталин-1-ол |
||
Если же электронодонорный заместитель находится у -углеродного атома, то электрофильная атака направляется в первое положение.
Дезактивирующая электроноакцепторная группа направляет атаку электрофила в соседнее незамещѐнное кольцо, при этом, как правило, по
581
-углеродным атомам (например, см. выше нитрование). Но условия реакции (как при сульфировании) могут оказывать влияние на еѐ направление.
11.2.2.2. Реакции присоединения
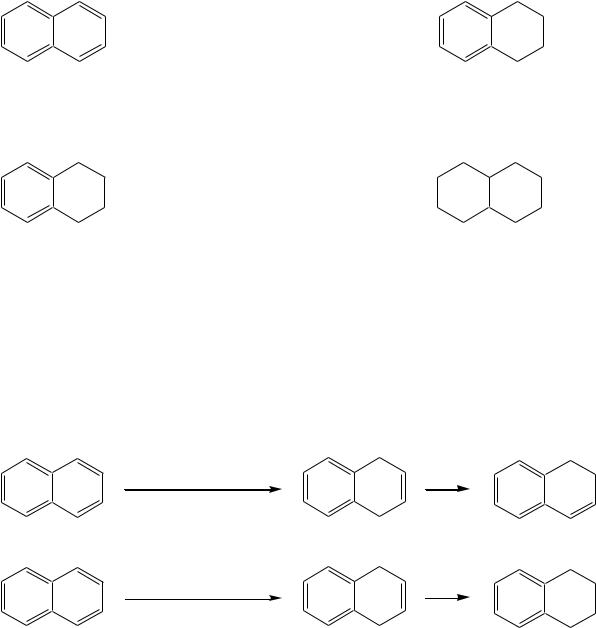
Эти реакции подтверждают диеновый характер нафталиновой системы. Важнейшими из них являются гидрирование, галогенирование и реакции диенового синтеза.
Проведение реакции гидрирования возможно в разных условиях. Присоединение молекулярного водорода на хромоникелевом катализаторе приводит сначала к тетрагидропроизводному:
+ |
Cr2O3 , Ni / 0.15МПа,423К |
2 H2 |
тетралин (1,2,3,4-тетрагидронафталин),
а затем – к пергидропроизводному, но в значительно более жѐстких условиях:
+ |
Cr2O3 , Ni / 0.4МПа,473К |
3 H2 |
декалин (пергидронафталин)
Из этих двух реакций в первой нафталин проявляет свойства диеновой системы, а во второй происходит нарушение ароматической системы кольца. Отсюда и различия в условиях протекания реакций: первая — аналогично диенам, вторая — аналогично алкилбензолам.
Гидрирование атомарным водородом (водородом в момент выделения) проводят металлическим натрием в кипящих этиловом или пентиловом спирте. Продукты реакций при этом могут различаться:
Na + C2H5OH / 351K
1,4-дигидронафталин 1,2-дигидронафталин
Na + C5H11OH / 410K
тетралин
582
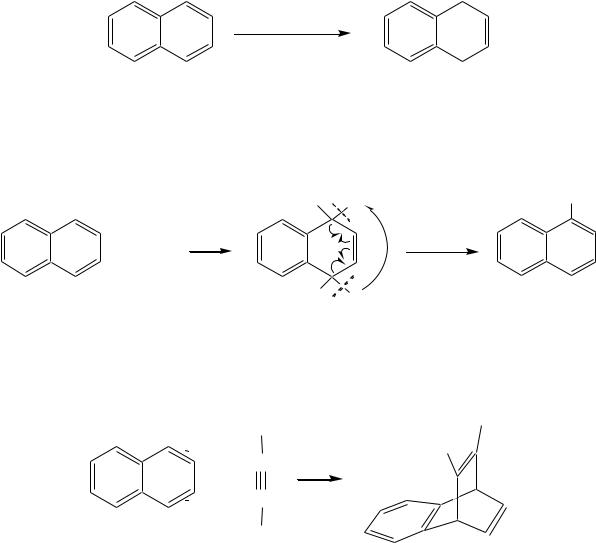
Реакции в обоих случаях начинаются как 1,4-присоединение, но в этаноле промежуточный продукт перегруппировывается в 1,2-дигидронафталин, стабилизированный - -сопряжением, а в пентан-1-оле, при более высокой температуре, реакция протекает дальше до образования продукта полного гидрирования диенового фрагмента.
Восстановление по Бѐрчу (гл. 9.5.1.2, 9.5.2.2) селективно приводит к
1,4-дигидронафталину:
Na,ROH / NH3
Галогенирование также начинается как реакция 1,4-присоединения, но затем наблюдается отщепление молекулы галогеноводорода, так как продукт реакции элиминирования оказывается более стабилен по причине того же - -сопряжения:
Br |
H |
Br |
|
||
+ Br2 |
|
- HBr |
|
|
|
H |
Br |
|
В реакции диенового синтеза (гл. 4.3.3) нафталин является типичным диеном, а в качестве диенофила может быть, например, дицианоацетилен:
CN |
CN |
|
|
|
NC |







 C
C
+







 C
C
CN
583
