
А Е Щеголев Органическая химия 2016 / 08 Алициклические углеводороды и их производные
.pdf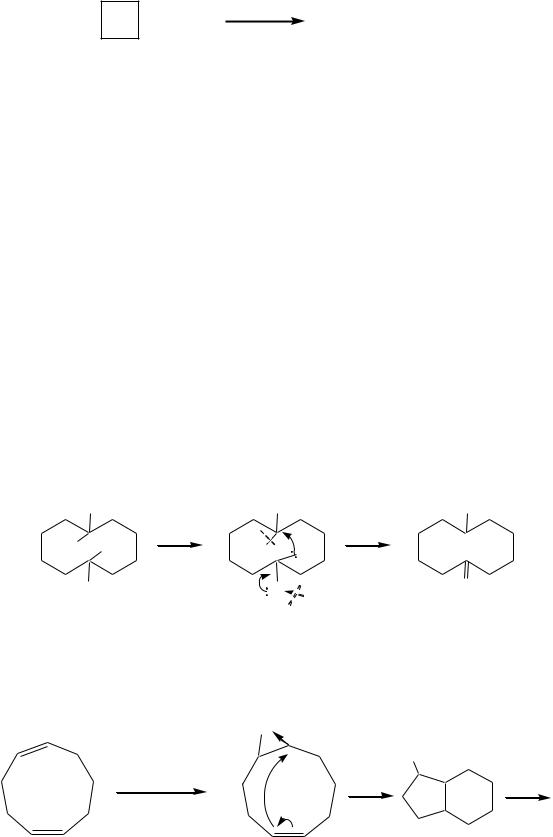
+ H2 |
Pt, 420 K |
CH3CH2CH2CH3 |
|
8.3.3. РЕАКЦИИ СРЕДНИХ ЦИКЛОВ
Для соединений со средним размером цикла (8 11 атомов) по сравнению с нормальными циклами (5 7 атомов) возрастает энергия напряжения до 40 52 кДж/моль. В больших циклах она уменьшается до 10 кДж/моль в циклододекане и затем до нуля в циклах большего размера.
Возрастание общей энергии напряжения в средних циклах обусловлено ростом торсионного напряжения и появлением трансаннулярного напряжения Прелога, характерного для ван-дер-ваальсова отталкивания атомов водорода или других групп, находящихся у пространственно сближенных противоположных атомов углерода кольцевых систем с восе- мью—одиннадцатью атомами углерода. Это, в свою очередь, является причиной целого ряда аномалий в химическом поведении функциональных производных средних циклов. Для них, например, наиболее характерны трансаннулярные реакции. Примером может служить трансаннулярное перемещение гидрид-иона при дегидратации 1-метилциклодекан-1,6- диола:
CH3 |
|
CH3 |
CH3 |
|
HO H |
H+ |
+ |
|
|
|
H2O H |
- H O |
||
|
|
|
|
2 |
|
|
|
|
- H+ |
OH |
|
O |
H |
O |
|
|
|
|
|
1-метилциклодекан-1,6-диол |
|
|
6-метилциклодеканон |
|
Другой пример — присоединение брома к цис-,цис-циклонон-1,5- диену:
|
|
Br |
|
|
+ |
|
|
Br |
|
|
- |
+ Br . . . Br |
Br |
|
- Br- |
|
+ |
|
|
|
цис-,цис-циклонон-1,5-диен
384
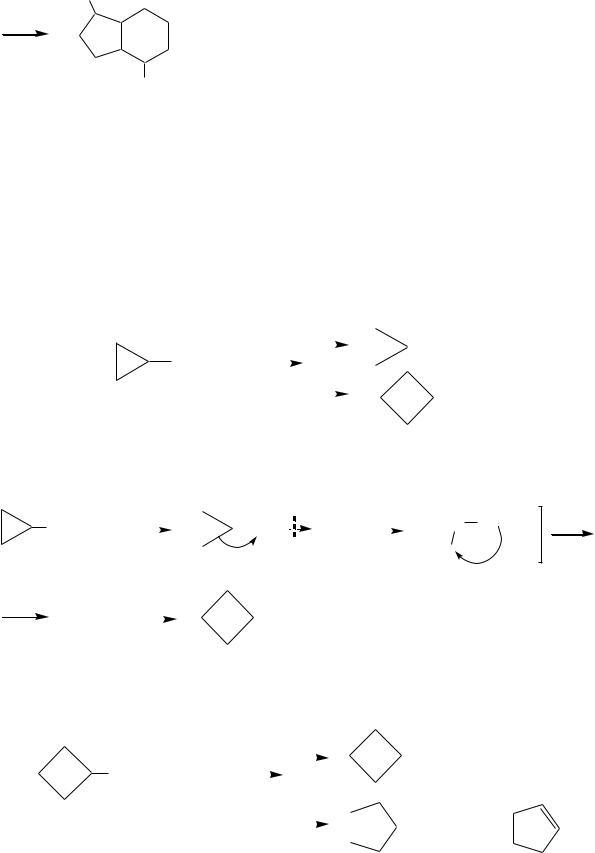
Br
Br
2,7-дибромбицикло[4.3.0]нонан
8.3.4. РЕАКЦИИ ИЗОМЕРИЗАЦИИ ЦИКЛА
Эти реакции характерны, как правило, для алициклических соединений, содержащих функциональные группы в боковой углеродной цепи. В таком случае для малых циклов протекают не только реакции раскрытия кольца, но и его расширения с образованием более устойчивых циклов. Например:
CH2OH |
HBr |
|
|
|
|
|
|
CH2Br |
||
|
|
|
|
|
||||||
- H2O |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Механизм расширения трѐхчленного цикла можно представить следующим образом:
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH2OH |
|
|
H |
|
|
|
CH2 |
|
+ |
|
|
|
H2C |
C |
|
CH2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
OH2 |
|
|
|
|
|
H |
||||||
|
|
|
|
|
|
|
|
|
|
|
-H2O |
H C |
+ |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
Br- |
|
|
|
Br |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примером реакции расширения четырѐхчленного цикла является нитрозирование первичного алифатического амина:
+ |
|
|
|
|
|
|
|
CH2-OH |
|
|
|
|
|
|
|||
HNO2 / H |
|
|
|
|
|
|
||
CH2-NH2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
OH + |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
385

Не всегда изомеризация алициклического соединения сводится к расширению малого цикла. Перегруппировка Фаворского — пример превращения 6-членного кольца в 5-членное. В эту реакцию вступают циклические -галогенокетоны с участием этилата натрия:
H 
|
|
|
|
|
|
|
|
C H O- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C H O- |
|||||||
|
|
|
|
|
O |
2 |
|
5 |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
2 |
5 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Cl- |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
- C2H5OH |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
- |
|
|
|
|
|
- |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
C2H5OH |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
COOC2H5 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
OC2H5 |
|
|
|
|
|
|
OC H |
|
- C2H5O |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
8.4. СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ
Циклопентан, циклогексан и их гомологи входят в состав некоторых нефтей. В связи с этим циклогексаны получают из продуктов переработки нефти. Циклопентаны тоже могут быть получены из нефти, но основное количество получают синтетическим путѐм.
Синтетические способы получения циклоалканов с малым, нормальным и средним размером цикла, а также алициклических соединений с кратными связями могут различаться в связи с их разной устойчивостью.
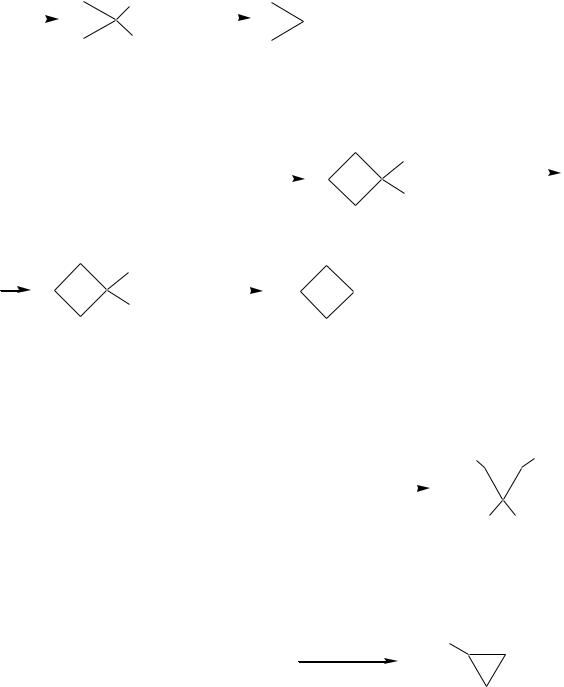
1.Лучшим способом получения циклопропана остаѐтся применѐнное в 1887 году Г. Густавсоном* действие цинковой пыли на спиртовый раствор 1,3-дибромпропана:
Br-CH2-CH2-CH2-Br + Zn |
C2H5OH, 353 K |
+ ZnBr2 |
||
|
|
|
||
|
|
|
|
|
2.Другой способ создания трѐхчленного кольца — взаимодействие 1,2- дибромэтана с малоновым эфиром в 50%-м водном растворе щѐлочи в присутствии солей четвертичного аммония:
COOC2H5 |
|
50% NaOH, R4N+Br- |
|
COOC2H5 |
||||
|
|
|
+ BrCH2CH2Br |
|
||||
|
|
CH2 |
|
|||||
|
|
|
|
|
|
COOC2H5 |
||
|
|
|
|
|
||||
COOC2H5 |
|
|
|
|
|
|||
|
|
|
|
|
|
|||
386
+ |
|
COOH |
390K |
|
|
|
|||
|
|
|
|
||||||
H2O / H |
|
|
|
|
|
COOH + CO2 |
|||
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
Для получения производных циклобутана здесь подходит способ с использованием натриймалонового эфира и 1,3-дибромпропана:
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
COOC2H5 |
|
|
|
|
|
|
|
COOC2H5 H O / H+ |
||||
+ |
|
|
|
|
|
|
Br(CH2)3Br |
|
|
|||||
|
|
|
|
|
|
2 |
|
|||||||
Na |
HC: |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
COOC2H5 |
|||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
COOC2H5 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
COOH |
|
t o |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
COOH |
||||
|
|
|
COOH |
|
- CO2 |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||
3.Производные циклопропана могут быть получены также присоединением карбена и дигалокарбенов (гл. 3.2.4) к алкенам. В настоящее время это наиболее распространѐнный общий способ синтеза производных циклопропана и построения циклопропанового кольца:
|
|
|
C2H5 |
|
CH3 |
CH3CH2-CH=CH-CH3 + CHCl3 |
|
(CH3)3C-O-K+ |
Cl |
||
|
|
Cl |
|||
|
|
|
|||
Эффективный способ превращения алкенов в производные циклопропана основан на реакции алкенов с метилендийодидом и сплавом цинка и меди:
Zn(Cu) R
R-CH=CH2 + CH2I2
(C2H5)2O, 313 K
Активной частицей в этой реакции является карбеноид — йодид йодметилцинка, образующийся при взаимодействии метилендийодида с металлическим сплавом:
CH2I2 + Zn(Cu) ICH2ZnI
4.Производные циклобутана и циклопентана, но не более высоких циклов, получаются с помощью модифицированной реакции Вюрца для циклизации 1,4- или 1,5-дигалогенопроизводных. Например:
387

Cl
Mg
- MgCl2
Cl
Реакция протекает в очень мягких условиях и с высоким выходом.
5.Аналогично кетонам алифатического ряда некоторые циклические кетоны могут быть получены пиролизом кальциевых и бариевых солей карбоновых кислот (гл. 6.1.5). Для этого необходимо использовать соответствующие соли дикарбоновых кислот или нагревать кислоты с гидроксидом кальция или бария:
CH2-COO |
|
t o |
|
|
|
|
Ba |
|
O |
||
(CH2)n-3 |
|
(CH2)n-3 |
|
||
|
|
||||
CH2-COO |
|
- BaCO3 |
|
|
|
|
|
|
|
|
|
Циклопентанон и циклогексанон этим способом получаются с выходом 80% при нагревании соответственно адипиновой и пимелиновой кислот с гидроксидом кальция или бария, а для реакции получения циклогептанона и циклооктанона выход составляет около 20%. Циклические кетоны с n > 9 вообще не могут быть получены этим способом, так как выходы для высших кетонов не превышают 2 5%. Швейцарский химик Л. Ружичка* за эти работы и за исследования в области высших терпенов был удостоен в 1939 году Нобелевской премии.
6.Шестичленные циклы могут быть получены реакцией Дильса–Альдера
(гл. 4.3.3).
7.Димеризацией и олигомеризацией сопряжѐнных диенов можно получить восьмичленные циклы и циклы большего размера. Например, димеризация бут-1,3-диена в присутствии специфических комплексов никеля в качестве катализатора при температуре 80 100 С даѐт цис,цис- циклоокт-1,5-диен с выходом 96% по схеме:
2 CH2=CH-CH=CH2
Однако другие никелевые комплексы катализируют тримеризацию бутадиена с образованием 12-членных циклов (циклододек-1,5,9- триенов). При этом в зависимости от условий (природа катализатора) образуются разные геометрические изомеры:
388

3 CH2=CH-CH=CH2 |
|
|
|
|
|
|
|
+ |
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8.Конденсацией Дикмана* обычно получают пяти- и шестичленные циклы, а макроциклы могут быть получены в сильно разбавленных растворах:
|
|
|
|
|
O |
|
COOC2H5 |
- |
|
|
|
|
|
(CH2)n-2 |
OC2H5 |
(CH2)n-2 |
||||
|
|
|
||||
CH2-COOC2H5 |
|
|
|
|
|
COOC2H5 |
|
|
|
|
|
||
Механизм реакции аналогичен конденсации Кляйзена (гл. 6.4.4.3). Вместо алкоголятов могут быть использованы гидриды щелочных металлов.
Полученный эфир оксоциклоалканкарбоновой кислоты далее может быть гидролизован и декарбоксилирован с образованием соответствующих циклических кетонов:
|
|
|
|
O |
|
|
O |
||
|
H2O |
(CH2)n-2 |
|
t o |
(CH2)n-2 |
||||
. . . |
|
|
|
|
|
||||
|
|
- CO2 |
|||||||
|
|
|
|
COOH |
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
9.Циклогексан и его производные могут быть получены каталитическим гидрированием ароматических соединений (см. далее в соответствующих главах). Как, например, циклогексан из бензола (гл. 9.5.1.2) или циклогексанол из фенола (гл. 10.5.3.5).
8.5. ТЕРПЕНЫ И ТЕРПЕНОИДЫ. КАРОТИНОИДЫ
Терпенами называют углеводороды, представляющие собой продукты олигомеризации изопрена, с общей формулой
(C5H8)n , где n = 2 8
Терпены подразделяют на монотерпены (C5H8)2, сесквитерпены (C5H8)3, дитерпены (C5H8)4, сестертерпены (C5H8)5, тритерпены (C5H8)6 и тетратер-
пены (C5H8)8.
Терпеноиды — кислородосодержащие производные терпенов. Это спирты, альдегиды, кетоны.
Терпены и терпеноиды являются продуктами растительного происхождения. Они содержатся в эфирных маслах растений, смоле хвойных
389

деревьев, скипидаре. Работы О. Валлаха* по химии терпенов послужили основой промышленности душистых веществ.
По природе углеродного скелета терпены и терпеноиды могут быть ациклические, моноциклические и бициклические.
8.5.1. АЦИКЛИЧЕСКИЕ ТЕРПЕНЫ И ТЕРПЕНОИДЫ
Одним из монотерпенов алифатического ряда является мирцен
CH3 CH2 CH3-C=CH-(CH2)2-C-CH=CH2 ,
содержащийся в эфирных маслах хмеля и благородного лавра. Производные мирцена гераниол и нерол являются цис-транс-
изомерами с общей структурной формулой:
CH3 CH3 CH3-C=CH-(CH2)2-C=CH-CH2-OH
3,7-диметилокт-2,6-диен-1-ол
Гераниол является составной частью розового, гераниевого, вербенового и лимонного масел; нерол содержится в померанцевом и бергамотовом маслах. Оба спирта являются ценными душистыми веществами, определяют характерный аромат ряда мускатных вин и рислингов, их запах подобен запаху розы, но аромат каждого заметно отличается от другого.
Линалоол, изомерный гераниолу и неролу, обладает запахом, напоминающим запах ландыша, является ценным душистым веществом и также определяет характерный аромат ряда мускатных вин и рислингов.
CH3 CH3 CH3-C=CH-(CH2)2-C-CH=CH2
OH
линалоол (3,7-диметилокт-1,6-диен-3-ол)
Он содержится, в частности, в линалоевом, бергамотовом, кориандровом и лавандовом маслах.
Цитронеллол содержится почти всегда вместе с гераниолом во многих растениях и также, как и предыдущие три монотерпеновых спирта, является душистым веществом мускатных вин и рислингов. В розовом масле он находится в виде левовращающего, а в лимонном масле – в виде правовращающего изомера. В масле герани содержатся оба энантиомера. Природный цитронеллол представляет собой смеси 3,7-диметилокт-7-ен-1-ола
390
и 3,7-диметилокт-6-ен-1-ола, в которых значительно преобладает последний.
CH3 |
CH3 |
CH3 |
CH3 |
|
* |
|
* |
CH2=C-(CH2)3-CH-CH2CH2-OH |
CH3-C=CH-(CH2)2-CH-CH2CH2-OH |
||
3,7-диметилокт-7-ен-1-ол |
3,7-диметилокт-6-ен-1-ол |
||
цитронеллол
Цитронеллаль также находится в природе в виде двух стереоизомеров. Правовращающий изомер встречается в цитронелловом и эвкалиптовом маслах, а левовращающий – в яванском цитронелловом масле. Цитронеллаль представляет собой смесь 3,7-диметилокт-7-еналя и 3,7-ди- метилокт-6-еналя.
CH3 |
CH3 |
CH3 |
CH3 |
|
* |
|
* |
CH2=C-(CH2)3-CH-CH2-CHO |
CH3-C=CH-(CH2)2-CH-CH2-CHO |
||
3,7-диметилокт-7-еналь |
3,7-диметилокт-6-еналь |
||
цитронеллаль
Большое значение имеет цитраль, образующийся при окислении гераниола; он встречается во многих эфирных маслах, но больше всего его в лимонном масле.
CH3 CH3 CH3-C=CH-(CH2)2-C=CH-CHO
цитраль (3,7-диметилокт-2,6-диеналь)
Он обладает сильным лимонным запахом, применяется в качестве душистого вещества и как исходное соединение для получения веществ, обладающих запахом фиалок.
Примерами сесквитерпеноидов алифатического ряда являются спирты фарнезол и неролидол и альдегид -синенсаль. Фарнезол обладает стойким запахом, напоминающим запах ландышей
CH3 |
CH3 |
CH3 |
CH3-C=CH-(CH2)2-C=CH-(CH2)2-C=CH-CH2OH
фарнезол (3,7,11-триметилдодек-2,6,10-триен-1-ол)
Он содержится в мускусном масле и масле цветов липы. Неролидол содержится в перуанском бальзаме
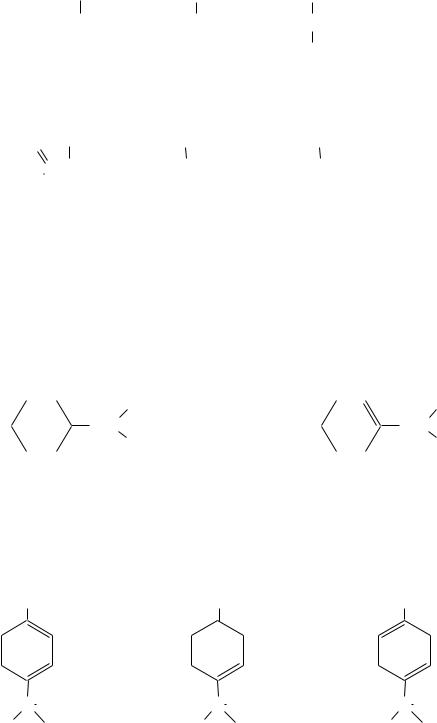
391
CH3 |
CH3 |
CH3 |
*
CH3-C=CH-(CH2)2-C=CH-(CH2)2-C-CH=CH2
OH
неролидол (3,7,11-триметилдодек-1,6,10-триен-3-ол),
-синенсаль — в апельсиновом соке
O CH3 |
CH3 |
CH3 |
H C-C=CH-(CH2)2-C=CH-CH2-CH=C-CH=CH2
-cиненсаль (2,6,10-триметилдодек-2,6,9,11-тетраеналь)
8.5.2. МОНОЦИКЛИЧЕСКИЕ ТЕРПЕНЫ И ТЕРПЕНОИДЫ
Моноциклические терпены можно рассматривать как производные углеводородов ментана, ментена и изомерных ментенов (с иным расположением двойной связи).
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||
H3C |
|
|
|
CH |
H3C |
|
|
|
CH |
|
|
|
|||||||
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||
|
|
|
ментан |
|
|
|
ментен |
||
(или п-ментан, или 1-метил-4- |
(4-метил-1-изопропилциклогекс-1-ен) |
||||||||
изопропилциклогексан) |
|
|
|
|
|
||||
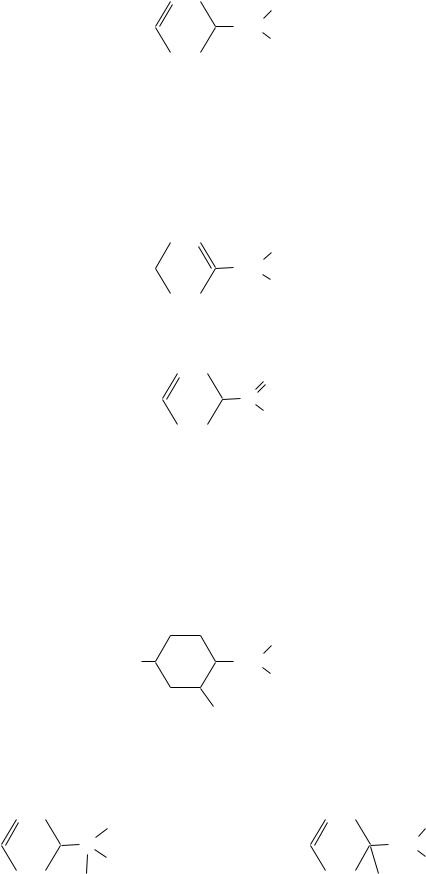
Эти углеводороды терпенами не являются, однако к терпенам относятся такие ментадиены, как -, - и -терпинены:
CH3 |
|
CH2 |
CH3 |
|
CH |
CH |
CH |
H3C CH3 |
H3C CH3 |
H3C CH3 |
-терпинен |
-терпинен |
-терпинен |
Терпинены содержатся во многих эфирных маслах, например в кардамоновом и кориандровом, в масле манильской элеми и др.; -терпинен — в можжевельнике.
-Феландрен также является ментадиеном:
392
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
H C |
|
|
|
|
|
* CH |
|
|
|
|
|
||
3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-феландрен |
||||
Он оптически активен. Правовращающая форма встречается в частности в ост-индском гераниевом масле, масле элеми, масле из семян аптечного укропа; левовращающая форма находится в эвкалиптовом масле, масле китайского звѐздчатого аниса, в масле ямайского перца.
Терпинолен содержится в манильском, кориандровом масле и в масле элеми.
|
|
|
|
CH3 |
|
|
|
|
|
H2C |
|
|
|
CH |
|
|
|
||
|
|
|
||
|
|
|
|
CH3 |
|
|
|
|
|
|
|
терпинолен |
||
Лимонен широко распространѐн в эфирных маслах.
|
|
|
|
CH2 |
|
|
|
|
|
H C |
|
|
|
* C |
|
|
|
||
3 |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
лимонен |
||
(+)-Лимонен содержится, например, в масле апельсиновой корки и в тминном масле; (–)-лимонен – в масле сосновой хвои и еловых шишек; рацемат, называемый дипентеном, содержится в больших количествах в скипидаре.
К монотерпеноидам относится насыщенное гидроксипроизводное ментана — ментол, важнейший спирт, содержащийся в значительных количествах в эфирном масле перечной мяты.
|
CH3 |
H3C |
CH |
|
CH3 |
OH
ментол
Из ненасыщенных спиртов ментанового ряда в природе встречаются
-терпинеол и терпинеол-4:
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||
H3C |
|
|
|
C |
H3C |
|
|
|
CH |
|
|
|
|
||||||
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
OH |
|
|
|
|
OH |
|
-терпинеол |
|
|
|
терпинеол-4 |
||||
393
