
- •Иркутский государственный технический университет молекулярная физика термодинамика
- •Оглавление
- •Введение
- •Молекулярно-кинетическая теория
- •Идеальных газов
- •Исходные понятия и определения
- •Молекулярной физики и термодинамики
- •Молекулярно-кинетическая теория идеальных газов
- •Которое называется распределением Больцмана. Лабораторная работа Определение постоянной Больцмана
- •Лабораторная работа Определение универсальной газовой постоянной
- •2. Явления переноса в термодинамически неравновесных системах
- •Лабораторная работа Определение динамического коэффициента вязкости методом пуазейля
- •Лабораторная работа Определение динамического коэффициента вязкости методом Стокса
- •Лабораторная работа Определение средней длины свободного пробега и эффективного диаметра молекул воздуха
- •Лабораторная работа Определение коэффициента теплопроводности твердых тел
- •3. Термодинамика
- •Взаимосвязь между внутренней энергией, работой и теплотой (первый закон термодинамики)
- •Второе начало термодинамики
- •В незамкнутой системе энтропия всегда возрастает. Функция состояния, дифференциалом которой является , называетсяприведенной теплотой.
- •Основное уравнение термодинамики.Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Подставим уравнение (3.9), выражающее второе начало термодинамики, в равенство (3.10):
- •Лабораторная работа Определение отношения теплоемкостей газов методом клемана - дезорма
- •Лабораторная работа Определение изменения энтропии при изохорическом процессе в газе
- •Лабораторная работа Определение адиабатической постоянной по скорости звука в воздухе
- •4. Свойства жидкостей
- •Лабораторная работа Определение коэффициента поверхностного натяжения жидкости
- •Заключение
Которое называется распределением Больцмана. Лабораторная работа Определение постоянной Больцмана
Цель работы: 1 экспериментально подтвердить зависимость давления газа от концентрации молекул при постоянной температуре газа; 2 определить постоянную Больцмана.
Методика эксперимента
Давление газа пропорционально концентрации молекул n и термодинамической температуре Т газа см. формулу (1.8):
![]() ,
,
где k постоянная Больцмана.
Если изменить концентрацию молекул на величину n при неизменной температуре газа, то давление газа изменится на величину p:
![]() .
.
Изменение давления газа при постоянной температуре пропорционально изменению концентрации молекул газа.
Целью работы является экспериментальное подтверждение зависимости (1.34) при Т = const и определение постоянной Больцмана.
Используемая в лабораторной работе установка (рис. 1.8) состоит из сосуда С, объем которого VC известен; шприца Ш; U-образного водяного манометра М и крана К. Резиновый шланг 1 соединяет сосуд с одним из колен манометра, шланг 2 соединяет шприц (через кран) с сосудом.
Р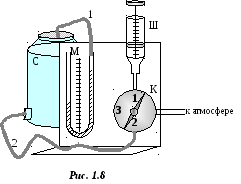 укоятка
крана имеет три положения: в положении
"1
полости сосуда и шприца сообщаются друг
с другом и с атмосферой; в положении 2
связь сосуда и шприца с атмосферой
прекращается; в положении 3
происходит полная изоляция сосуда и
восстанавливается связь шприца с
атмосферой.
укоятка
крана имеет три положения: в положении
"1
полости сосуда и шприца сообщаются друг
с другом и с атмосферой; в положении 2
связь сосуда и шприца с атмосферой
прекращается; в положении 3
происходит полная изоляция сосуда и
восстанавливается связь шприца с
атмосферой.
В начальный момент времени рукоятку крана ставят в положении 1, в шприц из атмосферы набирают определенный объем VШ воздуха. При этом температура Т воздуха в сосуде и шприце равна температуре воздуха в аудитории. Давления воздуха в шприце и в сосуде будут равны атмосферному р = рА. Разность уровней жидкости в коленах манометра равна нулю. Число молекул N, находящихся в объеме VШ шприца:
![]() , (1.17)
где
число молей воздуха; NА
– число Авогадро; Vш,0
– объем, который занимал бы воздух в
шприце при нормальных условиях; V,0
= 22,4 л – объем одного моля газа при
нормальных условиях (см. приложение).
, (1.17)
где
число молей воздуха; NА
– число Авогадро; Vш,0
– объем, который занимал бы воздух в
шприце при нормальных условиях; V,0
= 22,4 л – объем одного моля газа при
нормальных условиях (см. приложение).
Определим, каким был бы объем воздуха в шприце при нормальных условиях. Для этого запишем уравнение состояния газа см. формулу (1.6):
![]() , отсюда
, отсюда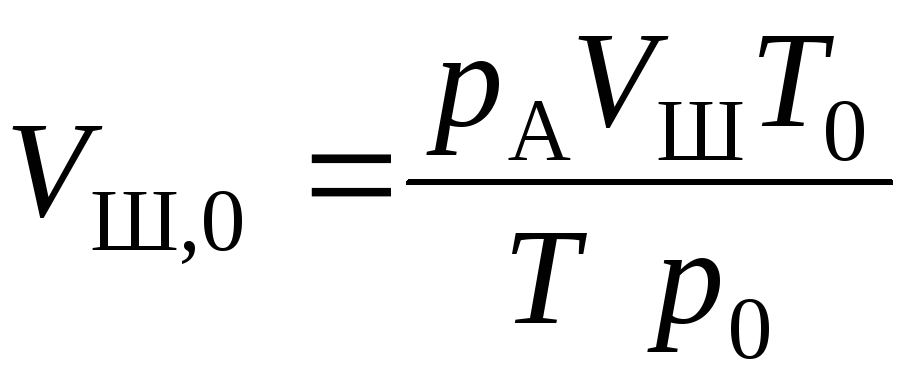 ,
гдер0
= 1,01105
Па; Т0
= 273К – давление и температура газа при
нормальных условиях.
,
гдер0
= 1,01105
Па; Т0
= 273К – давление и температура газа при
нормальных условиях.
Подставив последнее выражение в уравнение (1.17), получим:
![]() . (1.18)
. (1.18)
Повернув рукоятку крана в положение 2 и, переводя газ из шприца в сосуд, увеличиваем концентрацию газа в сосуде на величину n:
![]() . (1.19)
. (1.19)
Подставив формулу (1.18) в выражение (1.19), получим:
![]() , (1.20)
гдерА
атмосферное давление; р0
= 760 мм Hg = 1,01105
Па; Т0
= 273К;
NА
= 6,021023
моль-1;
Т
температура воздуха в аудитории; V,0
= 22,410-3
м3;
VС
– объем сосуда; VШ
– объем воздуха, набираемого шприцем.
, (1.20)
гдерА
атмосферное давление; р0
= 760 мм Hg = 1,01105
Па; Т0
= 273К;
NА
= 6,021023
моль-1;
Т
температура воздуха в аудитории; V,0
= 22,410-3
м3;
VС
– объем сосуда; VШ
– объем воздуха, набираемого шприцем.
Обозначим ![]() ,
(1.21)
,
(1.21)
тогда формула
(1.20) будет иметь вид ![]() . (1.22)
. (1.22)
Изменение концентрации молекул в сосуде вызовет изменение давления (р = n k T) на величину р. В связи с этим высота столбика жидкости в колене манометра, соединенном с сосудом, уменьшится, а в другом – увеличится. Разность давлений найдем по формуле:
![]() , (1.23)
где
, (1.23)
где![]()
разность уровней жидкости в коленах
манометра;
= 103 кг/м3
– плотность воды; g = 9,81 м/с2
– ускорение свободного падения тел.
разность уровней жидкости в коленах
манометра;
= 103 кг/м3
– плотность воды; g = 9,81 м/с2
– ускорение свободного падения тел.
в формуле (1.23) обозначим B = g, (1.24)
тогда : р = Вh. (1.25)
Порядок выполнения работы
Поставить кран К в положение 1. Набрать в шприц воздух объемом Vш = 10 см3. Перевести кран в положение 2.
Ввести воздух из шприца в сосуд. Рукоятку крана перевести в положение 3, повернув ее по часовой стрелке на 90.
Подождать 1 – 1,5 минуты, пока прекратится перемещение жидкости в коленах манометра. Измерить по шкале манометра М высоты уровней жидкости h1 и h2. Результаты измерений занести в таблицу 1.1.
Оставить кран в положении 3. Набрать в шприц воздух объемом Vш = 10 см3. Перевести кран в положение 2. Ввести воздух из шприца в сосуд. Вернуть кран в положение 3. Таким образом, в сосуд уже будет введено 20 см3 воздуха.
Подождать 1 – 1,5 минуты, пока прекратится перемещение жидкости в коленах манометра. Измерить по шкале манометра М высоты уровней жидкости h1 и h2. Результаты измерений занести в таблицу 1.1.
Повторить пункты 4, 5 два раза. При этом в сосуд уже будет введено соответственно 30 см3, затем 40 см3 воздуха.
По шкале барометра определите величину атмосферного давления р.
По шкале термометра определите температуру воздуха в аудитории Т.
Таблица 1.1
|
VШ,м3 |
h1, мм |
h2, мм |
h, м |
рА, мм Hg |
Т, К |
VC, м3 |
А, м-6 |
В кг/м2с2 |
n, м-3 |
р, Па |
k, Дж/К |
|
1010-6 |
|
|
|
|
|
2,3510-3 |
|
|
|
|
|
|
2010-6 |
|
|
|
|
|
|
| ||||
|
3010-6 |
|
|
|
|
|
|
| ||||
|
4010-6 |
|
|
|
|
|
|
|
Обработка результатов измерений
Вычислить постоянные А и В по формулам (1.21) и (1.24).
Используя формулы (1.22) и (1.25), вычислить для каждого из четырех измерений величины n и р. Результаты вычислений записать в таблицу 1.1.
П
 остроить
график зависимостир
= f(n).
Прямую, проходящую через ноль, проводим
усредненно.
остроить
график зависимостир
= f(n).
Прямую, проходящую через ноль, проводим
усредненно.Определить по графику
![]() .
.
Вычислить постоянную Больцмана
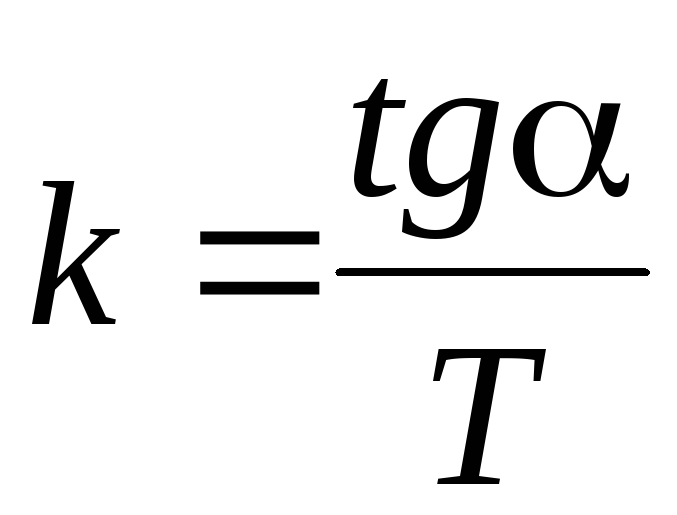 .
.Сравнить полученное значение постоянной Больцмана с табличным.
Сделать вывод по проделанной работе.
Контрольные вопросы и задания
Запишите уравнение Клайперона-Менделеева для произвольной массы газа и для одного моля.
Чему равно численное значение универсальной газовой постоянной?
Запишите уравнение молекулярно-кинетической теории идеального газа.
Запишите формулу, выражающую связь между термодинамической температурой газа и средней кинетической энергией теплового движения молекул.
Запишите формулу, выражающую связь постоянной Больцмана с универсальной газовой постоянной и числом Авогадро.
Какой физический смысл имеет постоянная Больцмана?
Как давление газа, находящегося при постоянной температуре, зависит от концентрации молекул?
