
Литература от Абакумова ч2 / Осмотический массоперенос
.pdfбента. Согласно закона Клапейрона-Менделеева концентрация газа С=m/(μV) =p/(RT), кмоль/м3, где m — масса поглощаемого вещества в паровой фазе, кг; μ — его молекулярная масса, кг/кмоль; V — объем пор, м3; Т — температура, К; R — универсальная газовая постоянная, Дж/(кмоль·К). В начале сорбции объем пор остается постоянным. Так как опыты проводятся при постоянной температуре, то концентрация пара С пропорциональна парциальному давлению пара p поглощаемого вещества.
С учетом приведенных допущений запишем уравнение a =b (am −a) р. Из этого соотношения следует уравнение (1.5.1). При р→0 (а→0) оно переходит в уравнение Генри: a =k р, где k ≈b am — постоянный коэффициент.
Брунауэр, Эммет, Теллер предложили уравнение полимолекулярной
адсорбции. В линейной форме уравнение БЭТ имеет вид: |
|
(p/ps)/[a (1 – p/ps)] =1/am c + [((c – 1)/am c)] (p/ps), |
(1.5.2) |
где a, am — величины, аналогичные тем, которые приведены в уравнении (1.5.1), ps — давление насыщенного пара, с — постоянная величина, численно равная отношению времени жизни молекул в первом и последующих слоях. Она учитывает различие в адсорбционных взаимодействиях между первым и последующими слоями.
Уравнение БЭТ, как и уравнение Ленгмюра, при малых значениях p/ps применимо для микропористых сорбентов. В этом случае молекулы локально сорбируются внутри пор на одинаковых по энергии связи сор- бат–сорбент активных дискретных центрах n0. С увеличением парциального давления пара p на активных центрах образуются комплексы («гроздья») из двух, трех и более молекул. Общая величина сорбции равна: a =am(θ′+2θ′′+3θ′′′+...), где θ′, θ′′, θ′′′ — доли активных центров, имеющие единичные, двойные, тройные и большего числа молекулярные комплексы; am — емкость мономолекулярной сорбции (см. уравнение (1.5.1)). Дальнейший вывод уравнения аналогичен его получению для полимолекулярной адсорбции молекул на поверхности адсорбента ([9], т. 1, с. 451).
Энергия взаимодействия между молекулами второго и последующих комплексов близка к теплоте конденсации. Эти молекулы заполняют свободное сорбционное пространство за счет осмотических сил.
В набухающих материалах взаимодействием сорбат—сорбат и изменением сорбционного объема при набухании пренебречь нельзя, поэтому уравнение (1.5.2) при сорбции молекул воды удовлетворяется для
p/ps < 0,5 [2].
В разнообразных реализуемых на практике сорбционных процессах применяются пористые различные адсорбенты. Поры разделяются на мик-
ропоры [r < (0,6–0,7) нм], супермикропоры [(0,6–0,7) < r < (1,5–1,6) нм], мезопоры [(1,5–1,6) < r < (100–200) нм] и макропоры [r > (100–200) нм]. Экви-
21

валентный радиус поры r определяется как удвоенное отношение площади нормального сечения поры к ее периметру.
Наиболее мелкие поры адсорбентов (микропоры) соизмеримы с размерами адсорбируемых молекул. Благодаря наложению адсорбционных потенциалов противоположных стенок микропор энергия адсорбции в микропорах больше, чем в непористых адсорбентах одинаковой химической природы. В начале процесса сорбции в этих местах происходит интенсивное заполнение микропор молекулами сорбата.
М. М. Дубининым с сотрудниками разработана теория сорбции в микропористых материалах с неизменяющейся структурой в процессе сорбции [6].
Уравнение Дубинина-Радушкевича имеет вид:
|
|
|
|
а=(w0/V0 )exp{−В[(Т/β)lg(ps/p)]2}, |
(1.5.3) |
||
где w0 — предельный объем заполнения пор, V0 — мольный объем сорбата, Т — температура, при которой получена изотерма адсорбции, p, ps — соответственно давления ненасыщенного и насыщенного пара, В — параметр, соответствующий характерному размеру пор, β — коэффициент аффинности.
Построенные по уравнению (1.5.3) изотермы сорбции для набухающих сорбентов — нелинейные вследствие изменения пористости в процессе набухания материала [2].
Уравнение сорбции для набухающих материалов имеет вид [10]:
u–1 =d + g lg(ps/p), |
(1.5.4) |
Вывод этого уравнения основывается на следующих допущениях. Сорбция молекул воды синтетическими и природными высокомолекулярными материалами происходит преимущественно на специфических центрах сорбции — функциональных полярных группах. Одна молекула воды, как и в обычной воде, может образовывать до четырех водородных связей с функциональными группами (первичными центрами сорбции) и соседними молекулами воды. При малых влажностях вокруг функциональных полярных групп внутри микропор сорбента образуются «гроздья» (кластеры) молекул воды.
Подвижность сорбированных молекул в микропорах при образовании кластеров, как отмечалось, ниже, чем в обычной воде. Это влечет снижение парциальной энтропии S сорбата.
Построенные в координатах уравнения (1.5.4) изотермы — нелинейные (рис. 1.9). Разделяя их на несколько линейных участков, можно определить для каждого отрезка угловые коэффициенты g и экстраполяцией при ϕ= 0 значения d. При известных значениях d и g, варьируя значением α, определяют координационное число взаимодействующих молекул, непосредственно сорбированных на первичных центрах сорбции z0. Затем находят ко-
22
ординационные числа z молекул, взаимодействующих с первичными сорбированными молекулами. Величина α учитывает долю молекул от общего их количества непосредственно сорбированных на активных центрах сорбента.
Таблица 1.2. Числа гидратации z0, z и количество активных центров при сорбции (с) nос 1023 и десорбции (д) nод 1023 кг–1; t (°C)
Материал |
t |
p/ps |
g |
d |
d/g |
α |
z0 |
z |
nос |
nод |
|
|
|
|
0,1 |
10,6 |
-6,48 |
-0,613 |
1 |
2 |
0 |
6,1 |
|
|
|
|
0,15 |
6,95 |
1,02 |
0,146 |
1 |
3 |
1,22 |
6,2 |
|
|
|
|
0,2 |
5,47 |
3,63 |
0,67 |
1 |
4 |
3,04 |
6 |
|
|
|
|
0,3 |
4,29 |
5,22 |
1,218 |
1 |
4,44 |
4 |
6,8 |
|
|
|
с |
0,4 |
4,07 |
5,49 |
1,351 |
1 |
4,58 |
4 |
7 |
|
|
|
0,5 |
4,40 |
5,22 |
1,188 |
1 |
4,41 |
4 |
6,7 |
|
|
|
|
|
0,6 |
5,27 |
4,73 |
0,897 |
1 |
4,11 |
4 |
6 |
|
|
|
|
0,7 |
6,59 |
4,12 |
0,625 |
0,79 |
4 |
4 |
6,2 |
|
|
|
|
0,8 |
9,42 |
3,27 |
0,35 |
0,44 |
4 |
4 |
7,9 |
|
|
|
|
0,9 |
11,8 |
2,86 |
0,242 |
0,3 |
4 |
4 |
9,2 |
|
Пшеница |
20 |
|
1 |
13,2 |
2,8 |
0,212 |
0,27 |
4 |
4 |
9,1 |
|
|
0,1 |
8,87 |
-3,82 |
-0,43 |
1 |
2 |
0,5 |
|
7,3 |
||
|
|
|
|
||||||||
|
|
|
0,15 |
6,24 |
1,57 |
0,251 |
1 |
3 |
1,4 |
|
7,1 |
|
|
|
0,2 |
5,41 |
2,99 |
0,553 |
1 |
3,5 |
2 |
|
6,8 |
|
|
|
0,3 |
4,64 |
4,09 |
0,882 |
1 |
4,09 |
4 |
|
6,8 |
|
|
д |
0,4 |
4,23 |
4,53 |
1,071 |
1 |
4,28 |
4 |
|
7,1 |
|
|
0,5 |
4,09 |
4,64 |
1,13 |
1 |
4,35 |
4 |
|
7,3 |
|
|
|
|
0,6 |
4,59 |
4,4 |
0,958 |
1 |
4,17 |
4 |
|
6,8 |
|
|
|
0,7 |
5,3 |
4,09 |
0,772 |
0,97 |
4 |
4 |
|
6,3 |
|
|
|
0,8 |
7,72 |
3,38 |
0,438 |
0,46 |
4 |
4 |
|
9,1 |
|
|
|
0,9 |
10,8 |
2,91 |
0,27 |
0,34 |
4 |
4 |
|
8,8 |
|
|
|
1 |
13,2 |
2,80 |
0,212 |
0,27 |
4 |
4 |
|
9,1 |
Крахмал |
|
с |
0,1–0,4 |
10,7 |
-1,4 |
-0,138 |
1 |
2 |
1,5 |
– |
|
|
0,4–0,95 |
5,4 |
5,1 |
0,944 |
1 |
4 |
5 |
6,3 |
|
||
картофель- |
20 |
|
|
|
|
|
|
|
|
|
|
|
0,1–0,4 |
7 |
2,0 |
0,286 |
1 |
2 |
4 |
|
– |
||
ный |
|
д |
|
||||||||
|
0,4–0,95 |
4,67 |
4,6 |
0,985 |
1 |
4 |
5,5 |
|
6,9 |
||
|
|
с |
0,1–0,2 |
40,8 |
-29 |
-0,711 |
1 |
1 |
0,5 |
– |
|
Целлюлоза |
50 |
0,2–0,3 |
26,5 |
-8 |
-0,302 |
1 |
1 |
2 |
– |
|
|
|
|
|
0,3–0,9 |
17,2 |
5 |
0,291 |
1 |
2 |
4 |
4,1 |
|
|
|
д |
0,1–0,9 |
14,6 |
5 |
0,343 |
1 |
2 |
4 |
|
4,9 |
|
|
с |
0,01–0,1 |
42,9 |
-29 |
-0,676 |
1 |
1 |
1 |
– |
|
|
|
0,1–0,4 |
31,1 |
0,86 |
0,028 |
1 |
1 |
4 |
– |
|
|
Лигнин |
20 |
|
0,4–1 |
27,1 |
5,7 |
0,21 |
1 |
1,6 |
4 |
3 |
|
д |
0,02–0,1 |
29,1 |
-24,3 |
-0,83 |
1 |
1 |
0,5 |
|
– |
||
|
|
|
|||||||||
|
|
0,1–0,2 |
21,5 |
-6,0 |
-0,28 |
1 |
1 |
2 |
|
– |
|
|
|
|
0,2–1 |
14,2 |
5,7 |
0,402 |
1 |
3 |
3 |
|
3 |
|
|
с |
0,01–0,08 |
12,4 |
-12 |
-0,964 |
1 |
1 |
0 |
– |
|
Торф |
|
0,08–0,5 |
7,2 |
2 |
0,278 |
1 |
2,5 |
3 |
– |
|
|
20 |
|
0,5–1 |
6,15 |
4,3 |
0,699 |
1 |
3 |
4 |
10 |
|
|
низинный |
|
|
|||||||||
д |
0,01–0,3 |
5,04 |
1 |
0,198 |
1 |
2 |
3 |
|
– |
||
|
|
|
|||||||||
|
|
|
0,3–0,9 |
3,2 |
3 |
0,938 |
1 |
4 |
5 |
|
10 |
23
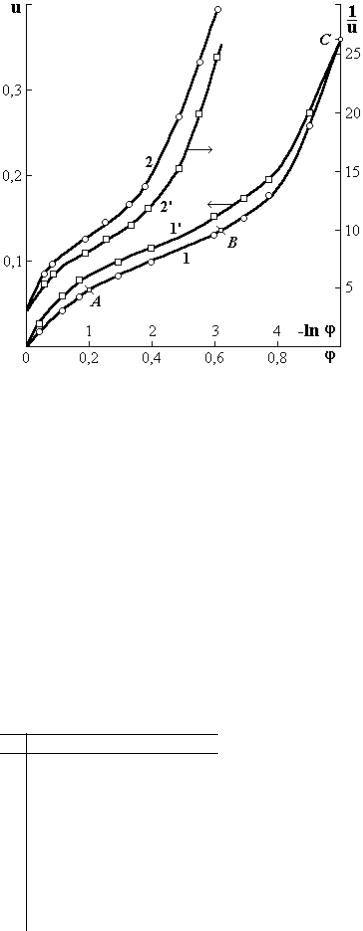
Рис. 1.9. Изотермы сорбции (1, 2) и десорбции (1′, 2′) зерна пшеницы в обычных (1, 1′) и (2, 2′) в координатах уравнения (1.5.6)
Расчетные значения z0, z приведены в табл. 1.2. Согласно расчетам (материал — пшеница) при малых значениях p/ps молекула воды может взаимодействовать двумя, тремя водородными связями с активными полярными центрами и соседними, сорбированными на других активных центрах молекулами воды.
По мере увеличения p/ps происходит сорбция молекул воды на первичных сорбированных молекулах. Возрастает вероятность образования четырех водородных связей с соседними молекулами воды. Подобный механизм сорбции на-
блюдается и для других материалов.
На основе экспериментальных изотерм можно рассчитать количество одновалентных центров сорбции на единицу массы сорбента
n0 =RT N0/(g μ Δω z0), |
(1.5.5) |
||||
изменения парциальной энтальпии |
|
||||
|
|
|
|
=−RT/(g u) |
(1.5.6) |
H |
|||||
и энтропии сорбата |
|
||||
|
|
=−R d/g, |
(1.5.7) |
||
S |
|||||
Таблица 1.3. Эмпирические уравнения сорбции
№Уравнение
1u = A exp[−BT ln(1/ϕ)]
2u = A/[1 +BT3 ln(1/ϕ)]
3u = A/[1 +BT2 ln(1/ϕ)]
4u = A/[1 +BTln(1/ϕ)]
5u = A{(1/T)ln[1/(1 −ϕ)]}B
6u = A{(1/T)ln[1/(1 −ϕ)]}/ /{B −(1/T)ln[1/(1 −ϕ)]}
7u = A [Tln(1/ϕ)]–В
8u = A +(B/T)ln[1/(1−ϕ)]
где μ — молярная масса воды; Δω — приходящаяся на одну связь средняя по объему сорбента разность энергии взаимодействия молекулы сорбата с активными центрами и окружающими ее молекулами после и до начала сорбции [2].
Процесс поглощения осмотической влаги гидрофильными высокомолекулярными соединениями можно рассматривать как смешение функциональных полярных групп макромолекул с молекулами воды. В
24
гидрофобных ВМС происходит процесс смешения звеньев макромолекул с неполярными молекулами сорбируемого вещества.
Многие исследователи применяют различные эмпирические уравнения изотерм сорбции [11], подобные уравнению (1.5.4). Они удовлетворяют экспериментам в определенном диапазоне значений ϕ= р/рs (табл. 1.3).
1.6.Поглощение влаги набухающими материалами
Изотермы полного цикла сорбции-десорбции в набухающих материалах имеют петлю гистерезиса. При поглощении паров воды зернами пшеницы гистерезис наблюдается во всем диапазоне относительной влажности воздуха ϕ (рис. 1.9).
Процесс сорбции в набухающих материалах происходит с сорбентами, которые предварительно подвергались полному обезвоживанию. Такой материал претерпевает усадку. Он существенно отличается по структуре от набухшего материала, с которым проводят опыты при десорбции влаги. Поэтому в начале процесса сорбции молекулы воды стремятся сорбироваться в доступных периферийных зонах ассоциатов макромолекул.
Согласно расчетам при ϕ=0,2 заканчивается процесс образования кластеров внутри микропор. Последующее поглощение молекул сорбата происходит путем диффузии их в свободные пространства между макромолекулами и увеличения объема микрополостей. Начальное набухание сопровождается увеличением координационного числа взаимодействующих молекул воды до 4,58 (табл. 1.2). Это свидетельствует о том, что молекулы воды заполняют свободные полости внутри микропор и образуют структуру, близкую к тетраэдрической структуре льда-I.
По мере заполнения микрополостей и начального набухания возникает пространственная сеть водородных связей между поглощенными молекулами воды, в которую «встраиваются» функциональные полярные группы макромолекул. Их подвижность уменьшается из-за наличия дополнительных связей через молекулы воды — образования поперечных водяных «мостиков». Контракция системы сорбент-сорбат вызывает снижение проницаемости матрицы и числа доступных центров сорбции n0. Ее максимальное значение наблюдается при ϕ≈0,6.
При дальнейшем поглощении влаги зернами пшеницы происходит «удлинение» водяных мостиков за счет внедрения вновь поступивших молекул между сорбированными молекулами воды. Это приводит к увеличению расстояния между макромолекулами, ослаблению, и затем разрыву поперечных водородных связей между ними. По этой причине при u >0,22
25

(ϕ>0,85) имеет место значительное увеличение объема матрицы и числа активных центров до 9,1 1023 кг–1 (табл. 1.2).
На рис. 1.9 точке А соответствует конец образования «гроздей» молекул воды на первичных полярных центрах сорбции. Затем имеет место контракция системы (участок АВ). После этого наблюдается осмотическое поглощение влаги (участок ВС). Такой механизм сорбции (рис. 1.10) сле-
дует из анализа кривых парциальной энтальпии |
|
H |
и энтропии смешения |
||||||||||||||||||||
сорбата |
|
|
(см. раздел 3.3). Кривая |
|
|
возрастает при малых влагосо- |
|||||||||||||||||
|
S |
H |
|||||||||||||||||||||
|
|
|
|
|
держаниях (кривая 1). Затем она |
||||||||||||||||||
|
|
|
|
|
проходит через |
максимум при |
|||||||||||||||||
|
|
|
|
|
u = 0,1 |
и снижается. Эта ветвь |
|||||||||||||||||
|
|
|
|
|
кривой совпадает с изостериче- |
||||||||||||||||||
|
|
|
|
|
ской |
парциальной |
|
энтальпией |
|||||||||||||||
|
|
|
|
|
|
|
|
и (кривая 3). |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
Парциальная |
|
|
|
энтропия |
|||||||||||
|
|
|
|
|
смешения при малых влагосо- |
||||||||||||||||||
|
|
|
|
|
держаниях |
|
|
|
> 0 |
(кривая 5), а |
|||||||||||||
|
|
|
|
|
S |
||||||||||||||||||
|
|
|
|
|
затем |
при |
|
u ≥0,07 |
( |
|
< 0) |
||||||||||||
|
|
|
|
|
|
S |
|||||||||||||||||
|
|
|
|
|
уменьшается. По мере заполне- |
||||||||||||||||||
|
|
|
|
|
ния свободных полярных цен- |
||||||||||||||||||
|
|
|
|
|
тров сорбции подвижность сор- |
||||||||||||||||||
|
|
|
|
|
бированных |
молекул |
|
воды по |
|||||||||||||||
|
|
|
|
|
отношению к обычной жидко- |
||||||||||||||||||
|
|
|
|
|
сти снижается. Это вызывает |
||||||||||||||||||
|
|
|
|
|
уменьшение |
|
|
|
. С увеличением |
||||||||||||||
|
|
|
|
|
|
S |
|||||||||||||||||
|
|
|
|
|
поглощенной влаги |
|
|
|
→0. |
||||||||||||||
|
|
|
|
|
S |
||||||||||||||||||
|
|
|
|
|
|
|
|
Значения |
|
|
и |
рассчиты- |
|||||||||||
|
|
|
|
|
|
|
|
H |
|||||||||||||||
|
|
|
|
|
вались |
по |
экспериментальным |
||||||||||||||||
|
|
|
|
|
изотермам сорбции и десорб- |
||||||||||||||||||
|
|
|
|
|
ции, полученным при темпера- |
||||||||||||||||||
Рис. 1.10. Зависимость парциальной энтальпии |
|
турах 283, 293, 323, 353 К (см. |
|||||||||||||||||||||
смешения |
|
Н (кДж/моль) (1, 1′); работы |
|
раздел 1.7). |
|
|
|
|
|
|
|
|
|
поглоще- |
|||||||||
сорбции и десорбции Аа (кДж/моль) (2, 2′); |
|
|
|
|
При начальном |
|
|||||||||||||||||
|
нии влаги происходит значи- |
||||||||||||||||||||||
изостерической энтальпии Ни (кДж/моль) (3, |
|
||||||||||||||||||||||
3′); числа активных центров n0 1023 (кг–1) (4, |
|
тельное выделение тепла (кри- |
|||||||||||||||||||||
4′); парциальной энтропии смешения (5, 5′) и |
|
вая 3). Снижается также диффе- |
|||||||||||||||||||||
сорбированной влаги (6, 6′) S (кДж/(моль К); |
|
ренциальная |
|
энтропия (кривая |
|||||||||||||||||||
давления набухания π (МПа) (7, 7′) от влагосо- |
6) [2, 9]. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
держания u. Значения (1–7) рассчитаны при |
|
|
|
|
При набухании выделяет- |
||||||||||||||||||
сорбции, а (1′–7′) — десорбции влаги из зерен |
|
ся тепло за счет сорбции на но- |
|||||||||||||||||||||
пшеницы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
вых активных центрах. Они становятся доступными для молекул сорбата в процессе набухания (табл. 1.2).
Работы сорбции и десорбции Аа =−RT/lnϕ совпадают (кривые 2, 2′). Энтропия смешения (кривые 5, 5′), рассчитанная при температуре 293 К, совпадают с кривыми мольной энтропии 6 и 6′ при влагосодержании u > 0,1. При меньшем влагосодержании, как отмечалось, происходит сорбция молекул воды на функциональных полярных группах и снижается их подвижность.
Различие между всеми кривыми сорбции и десорбции при u >0,1 вызвано тем, что при десорбции происходит усадка материала. Она влечет снижение подвижности звеньев макромолекул. Возрастает упорядоченность структуры ассоциатов макромолекул и сорбированной влаги. Изменение парциальной энтропии смешения Sсм при влагосодержании u ≈0,12 имеет отрицательное максимальное значение.
В процессе сорбции воды возникает постепенная диффузия молекул воды в материал, претерпевший усадку. Поэтому в начальном периоде сорбции число центров сорбции возрастает. Затем при влагосодержании
|
u = 0,1 |
наблюдается |
контрак- |
|
|
ция, и число активных центров |
|||
|
уменьшается. |
При |
наличии |
|
|
осмотической |
влаги |
(u > 0,15) |
|
|
происходит набухание сорбен- |
|||
|
та и рост числа центров сорб- |
|||
|
ции вследствие разрывов по- |
|||
|
перечных водородных связей |
|||
|
между |
макромолекулами и |
||
|
диссоциации функциональных |
|||
|
групп (раздел 1.2). |
|
||
|
При десорбции влаги и |
|||
|
усадке сорбента эти процессы |
|||
|
происходят в обратном поряд- |
|||
|
ке. Вначале до влагосодержа- |
|||
|
ния u = 0,2 удаляется осмоти- |
|||
|
ческая влага, а число центров |
|||
|
сорбции, при этом, остается |
|||
|
неизменным. Затем возникают |
|||
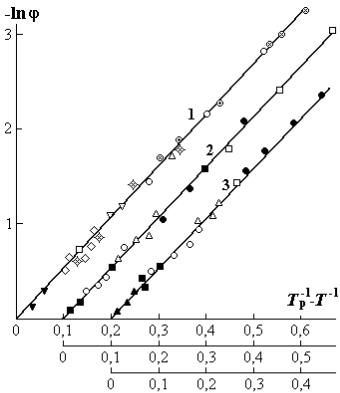
Рис. 1.11. Зависимость –lnϕ от разности |
непосредственные взаимодей- |
|||
(Т–1р −Т–1) 10–3 (К–1) для пшеницы (1), шерсти (2), |
ствия через водородные связи |
|||
и древесины ρ=600 кг/м3 (3). Одинаковым знач- |
между |
ассоциатами |
макромо- |
|
кам на графиках соответствуют разные темпера- |
лекул и внутри них. Это вле- |
|||
туры при постоянном влагосодержании материа- |
чет снижение центров сорб- |
|||
ла, а различным обозначениям — неоднозначные |
ции. При десорбции молекул |
|||
влагосодержания сорбента |
воды из водяных мостиков при |
|||
27 |
|
|
|
|
u < 0,18 возрастает число центров сорбции. При последующем удалении сорбированной влаги и усадке возникают непосредственные контакты через водородные связи между макромолекулами. Поэтому число центров сорбции при u < 0,14 снижается.
Сравнение начальных значений z0, z2, n0 (табл. 1.2), а также начальных участков кривых 6 и 6′ свидетельствует о том, что при малом влагосодержании материала молекулы воды в процессе десорбции имеют меньшую парциальную энтропию, а сорбент — число активных центров, чем при сорбции. Вызвано это тем, что в процессе сорбции происходит гидратация доступных и преимущественно периферийных центров сорбции. При десорбции молекулы воды изначально находятся на активных центрах матрицы во всем внутриматричном пространстве.
Давление набухания в зерне пшеницы при наличии прочной внешней оболочки достигает более 60 МПа (рис. 1.10, кривые 7, 7′).
В набухающих глинах сорбция молекул воды преимущественно происходит в межслоевых промежутках. Поглощение сорбата внутри них зависит от динамического равновесия между числом молекул в паровой фазе и сорбированном состоянии. Равновесие, в свою очередь, зависит от скорости диффузии пара из внешней парогазовой среды к активным центрам внутри сорбционного объема.
С увеличением зазора между слоями многократно возникают упорядоченные кластеры сорбированных молекул у активных центров и последующая по мере набухания их дезорганизация. Число активных центров определяется исходной структурой ми-
|
нерала. Степень их заполнения зависит |
|
от возможности диффузии к ним моле- |
|
кул сорбата. С увеличением ширины |
|
межслоевых промежутков доступность |
|
к активным центрам возрастает. Плот- |
|
ность поглощенной воды в глинах по |
|
мере набухания изменяется от 0,5 до |
|
0,94 г/см3 [2]. |
|
Изотермы, полученные при раз- |
|
ных температурах, можно нанести на |
|
одну прямую (рис. 1.11), в координатах |
|
-ln(ϕ) =f(Tр–1 −T–1), где Tр — температу- |
|
ра «точки росы» при известных значе- |
|
ниях T и ϕ (рис. 1.12). |
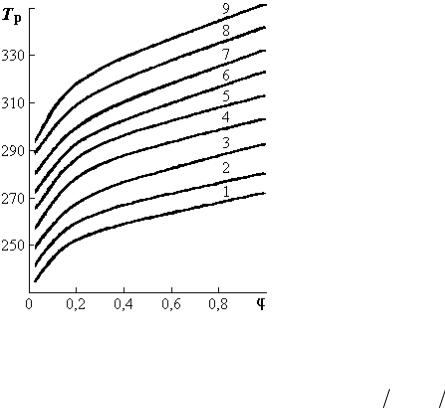
Рис. 1.12. Зависимость точки росы Тр |
Запишем уравнение Клапейрона- |
(К) от относительной влажности ϕ и |
Клаузиуса для фазового перехода моля |
температуры воздуха: 273 (1), 283 (2), |
пара в жидкость: |
293 (3), 303 (4), 313 (5), 323 (6), 333 |
dp dT = r (T(υп −υж )), (1.6.1) |
(7), 343 (8), 353 (9) К |
|
|
28 |

где р — равновесное парциальное давление пара над материалом с влагосодержанием u, υп, υж — соответственно мольные объемы пара и жидкости, м3/моль; r — теплота испарения со свободной поверхности воды, Дж/моль.
Из уравнения Клапейрона-Менделеева найдем мольный объем, который занимает пар, υп =RT/р. Пренебрегая значением υж <<υп, после подстановки υп в (1.6.1) имеем:
d p p = (r R)d(1 Т). |
(1.6.2) |
При температуре Тр парциальное давление пара равно рs, после интегрирования получим [2]:
−lnϕ = (r R)(Тр−1 −Т−1 ). |
(1.6.3) |
На рис. 1.11 приведены графики для изотерм сорбции и десорбции влаги из пшеницы при температурах 283, 293, 323, 383 К, для шерсти при температурах 273, 303, 333, 353 К и древесины плотностью 600 кг/м3 при Т=273, 283, 293, 308 К. Графики имеют одинаковые угловые коэффициенты, равные отношению r/R.
1.7. Теплота сорбции и десорбции
Чистая изостерная теплота сорбции вычисляется по формуле [1, 9]:
q′= Qа – L =– H =–R ∂ln(p/ps)/∂(1/T), |
(1.7.1) |
где L — теплота испарения со свободной поверхности, H — парциальная энтальпия.
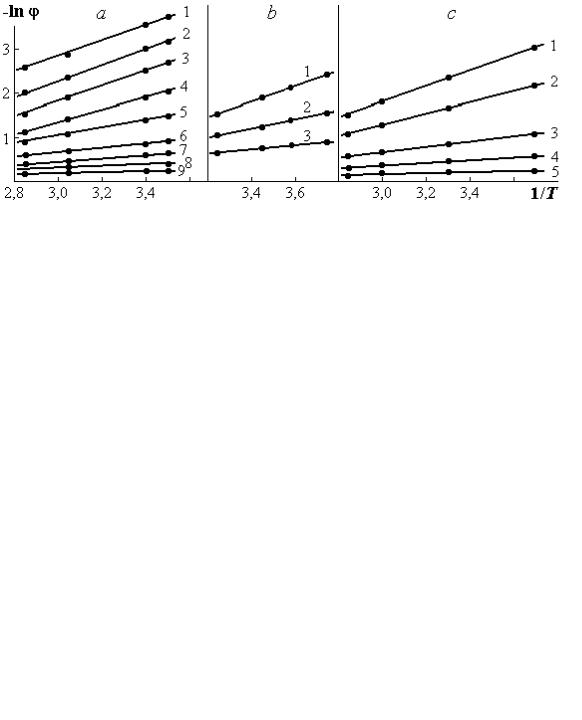
Для расчета чистой теплоты сорбции (десорбции) q′ строятся изостеры (рис. 1.13) — линейные зависимости -lnϕ=ƒ(1/T) для определенных значений влагосодержания сорбата.
По угловым коэффициентам этих зависимостей определяют искомую величину q′. Для древесины, шерсти, кукурузного крахмала (рис. 1.14) они близки друг другу. Такое соответствие связано с тем, что механизм сорбции на органических гидрофильных материалах подобен.
Другим методом определения теплоты сорбции (десорбции) является калориметрический.
Опыты с недеформируемыми материалами проводятся следующим образом. Вначале добиваются максимальной десорбции из материала поглощенных газов и паров. Затем начинается цикл сорбции-десорбции.
Для набухающих материалов первичная десорбция поглощенных веществ приводит к необратимым изменениям его структуры. При усадке возникают дополнительные молекулярные связи между частицами сор-
29
бента. Из-за этого последующие циклы сорбции-десорбции проводятся с измененной структурой сорбента, имеющего неоднозначное количество центров сорбции. Поэтому для органических материалов, природных биополимеров необходимо проводить калориметрические исследования, начиная с десорбции вещества (влаги) [13, 14].
Рис. 1.13. Изостеры при сорбции воды пшеницей (а) с влагосодержанием 0,05 (1); 0,1
(2);0,15 (3); 0,2 (4); 0, 25 (5); 0,3 (6); 0,4 (7); 0,5 (8); 0,6 (9); древесиной (b) 0,05 (1); 0,075 (2); 0,1 (3); шерстью (с) 0,06 (1); 0,08 (2); 0,1 (3); 0,014 (4); 0,2 (5) (1/Т 103, К–1)
На рис. 1.15 приведена установка для определения теплоты десорбции влаги. Образец 1 помещается в калориметрический стакан 2. Температура стакана и образца с помощью электрического нагревателя поддерживается постоянной в течение всего времени опыта. Между калориметрическим стаканом 2 и оболочкой 3 имеется постоянный теплообмен. При этом тепло, выделяемое термометрами сопротивления, отводится полностью в оболочку. Между калориметрическим стаканом и оболочкой устанавливается и поддерживается постоянная разность
|
температуры |
Т= 10–3 К. |
|
Неизменность температуры кало- |
|
|
риметрического стакана обеспечивается |
|
|
плавной регулировкой тока нагревателя. |
|
|
Основные части электрических схем с |
|
|
целью более стабильной работы калори- |
|
|
метра смонтированы в оболочке 3. Для |
|
|
устранения влияния внешних изменений |
|
|
среды температура внутри калориметра |
|
|
поддерживается постоянной с помощью |
|
|
водяной рубашки 4 и ультратермостата. |
|
|
При десорбции пары воды проходят че- |
|
|
рез отверстия калориметрического ста- |
|
Рис. 1.14. Изостерическая чистая те- |
кана, оболочки и поглощаются силикаге- |
|
плота сорбции воды q′ (кДж/моль) в |
лем 5. |
|
древесине (1), шерсти (2), кукуруз- |
Образец |
подвешивается к фото- |
ном крахмале (3) |
|
|
|
30 |
|
