
Литература от Абакумова ч2 / Осмотический массоперенос
.pdf5. Полярные ОН-группы спиртов взаимодействуют с активными гидрофильными центрами через водородные связи, а неполярные группы (менее интенсивно) — с гидрофобными участками макромолекул. Образующиеся при этом ассоциаты сорбированных молекул спиртов менее организованы, чем воды.
В ограниченно набухающих материалах при относительной влажности ϕ>0,95 происходит конденсация капиллярной влаги в макропорах между агрегатами частиц. Капиллярные мениски образуются в том случае, если сопротивление агрегатов, на которые опирается мениск, больше, чем капиллярное давление. При отсутствии жестких стенок капилляров наблюдается деформация частиц и тела в целом. Во влагонасыщенных частицах капиллярное давление воспринимается не только матрицей, но и находящимся внутри нее раствором.
1.3. Структура и свойства поглощенной воды
Предложено несколько моделей, описывающих аномальные свойства воды. Однако ни одну из них нельзя признать в полной мере удовлетворительной. Специфические свойства воды и ее структуры вызваны наличием между молекулами воды водородных связей. Каждая сорбированная молекула воды стремится максимально реализовать все четыре Н-связи при взаимодействии с соседними молекулами воды и активными полярными центрами. Структура воды в макропорах материала зависит от их объема и энергии взаимодействия молекул H2O со специфическими центрами сорбции.
До настоящего времени нет единого мнения о плотности адсорбированной влаги. Различные авторы приводят ее значения больше и меньше 1000 кг/м3. Для определения плотности двухмерной жидкости необходимо знать точные значения количества адсорбата и удельной поверхности адсорбента. Последнюю определяют путем сорбции известного газа на этой поверхности и рассчитывают мономолекулярную адсорбцию по уравнению БЭТ.
Любое вещество может быть условно принято за эталонное (например, азот, бензол). Каждой паре сорбат–сорбент соответствует свой механизм сорбции и количество поглощенного вещества. Молекулы одного («эталонного») газа (пара) сорбируются на локальных участках поверхности твердых частиц, которые имеют для него максимальную энергию связи. Молекулы другого газа или пара также избирательно сорбируются на своих специфических центрах адсорбции и пространственных неоднородностях того же материала. Это обстоятельство является причиной ошибок измерения удельной поверхности, размера «посадочной площадки» и расчета плотности адсорбата, основанных на применении «эталонных» газов
11
и паров. Следовательно, удельная поверхность твердых тел зависит от специфики связи молекул любого газа или пара с сорбентом. Для каждого газа, пара она своя.
Задача определения плотности сорбата в пористых материалах (силикагелях, цеолитах, ненабухающих глинах, углях) осложняется тем, что кроме отмеченных особенностей адсорбции
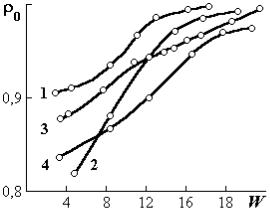
Рис. 1.2. Плотность сорбированной во- на твердых поверхностях необходимо ды ρ0 (г/см3), полученная гелиевым учитывать также заполнение микропор, которое зависит от проницаемости зе-
рен сорбента и размера атомов, молекул сорбата.
Еще более сложная задача — определение плотности сорбата в набухающих материалах. Плотности сорбированной влаги для желатина, хлопка, шерсти, агар-агара, полученные методом гелиевого пикнометрирования [4] в диапазоне влажности 4–20%, находятся в пределах 830–1000 кг/м3 (рис. 1.2). Гелий при комнатной температуре практически не сорбируется. Размер атомов гелия 0,2 нм. Поэтому гелий проникает в большую часть микропор материала.
Макромолекула представляет собой комплекс связанных между собой атомов и занимает определенный «атомный объем». Этот объем V0 можно определить по методике, предложенной А. М. Китайгородским [5]. Мономером при расчете атомного объема крахмала и целлюлозы служило глюкозное кольцо. Для желатина атомный объем рассчитывался как сумма инкрементов объемов каждой из входящих в него аминокислот.
Значения V0 остаются постоянными в процессе сорбции. Объем микропор Vд был найден по уравнению М. М. Дубинина [6] и изотермам десорбции воды при низких влажностях. Сумма атомных объемов и микропор примерно равна экспериментальному объему абсолютно сухого органического материала Vэ (табл. 1.1).
Таблица 1.1. Определение внутренней пористости материалов, см3/кг сорбента
Материал |
Атомный |
Объем микропор Vд |
Экспериментальный |
объем V0 |
объем Vэ |
||
Желатин |
350 |
150 |
520 |
Крахмал |
500 |
44 |
510 |
Целлюлоза |
500 |
69 |
580 |
Проницаемость атомов гелия в органический сорбент зависит от его влажности. Об этом можно судить по величине разности недоступных для атомов гелия объемов Vк влажного и сухого материала. Согласно прове-
12
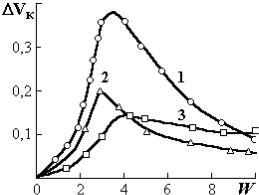
денным экспериментам (рис. 1.3) при сравнительно большой влажности структура набухающих сорбентов для атомов гелия более проницаема. По мере обезвоживания она вследствие молекулярной контракции уплотняется, становится менее проницаемой. При удалении последних молекул воды вновь становится более проницаемой.
Рис. 1.3. Зависимость недоступного |
При определенной влажности на- |
||
блюдается максимальная |
контракция |
||
объема Vк (см3/г) от влажности W |
|||
(%): желатин (1); целлюлоза (2); |
системы. Вызвано это тем, что молекулы |
||
крахмал (3) |
воды соединяют через водородные связи |
||
|
функциональные полярные |
группы со- |
|
седних макромолекул. Они создают между ними своего рода «водяные мостики». Последние уплотняют — снижают подвижность системы ВМСсорбат. По мере удаления «водяных мостиков» макромолекулы приобретают большую подвижность. Возрастает проницаемость их ассоциатов для молекул сорбата. В связи с этим увеличивается объем органического материала.
Внутри микрополостей на полярных группах сорбируются отдельные молекулы или их «гроздья» (кластеры), состоящие из небольшого числа молекул воды. Эти дискретные включения сорбата, «висящие» на активных центрах, не связаны между собой. Поэтому они не образуют фазу сорбированного вещества. В связи с этим понятие «плотность сорбированной воды» теряет физический смысл. При больших влагосодержаниях, когда имеют место заполнение всех микропустот и слияние кластеров, можно определять плотность сорбированной воды с помощью гелиевого и жидкостного пикнометров. Она не превышает плотность обычной воды.
Молекулы сорбированной воды могут смешиваться с другими молекулами и ионами в той части сорбционного объема, который доступен для этих молекул и ионов. Проницаемость пористой частицы сорбента зависит от ее структуры, подвижности матрицы и размера сорбируемой молекулы или гидратированного иона.
1.4.Изучение свойств поглощенной влаги ЯМР и диэлектрическим методами
Метод ядерного магнитного резонанса (ЯМР) широко применяется для изучения механизмов взаимодействия молекул воды с различными материалами, в том числе в белках, клетках, вирусах и других биологических объектах. В настоящем разделе ограничимся работами, в которых иссле-
13

довали воду в набухающих материалах. Для этих целей применялся спектрометр высокого разрешения с частотой 100 МГц. Исследовалась поглощенная крахмалом, агар-агаром вода в диапазоне влагосодержаний соот-
ветственно 2,8–25,1%, 2,5–25,8% и температур 233–293 К [2].
Отмечено изменение ширины сигнала ЯМР ядер атомов водорода (протонов) сорбированной воды, поглощенных крахмалом и агар-агаром, при положительных значениях (по шкале Цельсия) температур. Это связано с протонным обменом между молекулами сорбированной воды и содержащими атомы водорода функциональными группами сорбента.
Протоны имеют аномально большую подвижность в воде, водных растворах, в кристаллах льда, некоторых кристаллогидратах, силикатах, органических материалах.
На изменение ширины сигнала ЯМР молекул сорбированной воды влияют два механизма: протонный обмен и диполь-дипольное взаимодействие молекул воды, имеющих в микрополостях сорбента ограниченную подвижность. В зависимости от влияния на сорбцию этих механизмов в различных соотношениях имеют место неоднозначные величины энергии активации переноса протона.
Расчеты показали, что значения энергии активации скачков сорбированных молекул воды находятся в пределах 33–64 кДж/моль. Такие величины равны энергии, требуемой для разрыва двух-четырех водородных связей.
|
Согласно |
рис. 1.4 |
|||
|
при Т< Т0 =273 |
К |
для |
||
|
всех влагосодержаний об- |
||||
|
разцов |
|
интенсивность |
||
|
сигнала |
|
изменяется |
не- |
|
|
значительно. Это свиде- |
||||
|
тельствует о том, что мо- |
||||
|
лекулы |
воды в |
пределах |
||
|
исследованных |
влагосо- |
|||
|
держаний |
непосредствен- |
|||
|
но взаимодействуют |
с |
|||
|
функциональными груп- |
||||
|
пами биополимеров. Мо- |
||||
|
лекулы воды не переходят |
||||
|
в лед. Их количество не- |
||||
|
достаточно, чтобы обра- |
||||
Рис. 1.4. Зависимости натурального логарифма отно- |
зовать |
в |
микрополостях |
||
структуру льда. |
|
|
|||
шения интенсивностей сигналов ЯМР J при Т=273 К |
Максимальные |
из- |
|||
к J0 (Т=293 К) от обратной температуры 1/Т 10–3 (К–1) |
|||||
для различной влажности W (%) агар-агара — 4,1 (1); 6 |
менения |
интенсивности |
|||
(2); 8,8 (3); 15,0 (4); 20,9 (5). Штриховой линии соот- |
сигнала |
|
соответствуют |
||
ветствует температура 273 К |
большим |
влагосодержа- |
|||
ниям материалов. Это может быть связано с увеличением протонного обмена между молекулами сорбированной воды. По этой же причине происходит закономерное смещение точек излома прямых в область более низких температур (рис. 1.4).
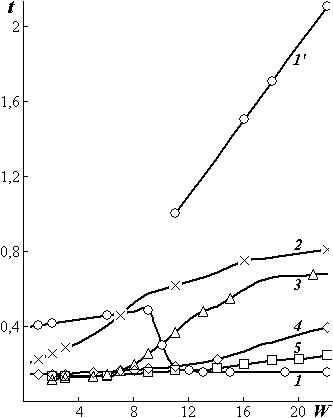
Методом спин-эхо исследовалось поглощение влаги хлопком, крахмалом, шерстью, желатином и агар-агаром при температуре 293 К (рис. 1.5). Полученные в этих опытах значения спин-спиновой релаксации t с увеличением влагосодержания материалов незначительно возрастают. Это свидетельствует о малой подвижности молекул воды при низких влагосодержаниях биополимеров [7].
Для сорбированных молекул воды в хлопке, состоящем, в основном, из кристаллической и аморфной целлюлозы, наблюдаются две зависимости t при влажности больше и меньше 8%. Особенно интенсивно молекулы сорбируются в некристаллических участках волокон целлюлозы. В аморфных участках вследствие более высокой подвижности звеньев макромолекул размеры микропор и расположение их в пространстве все время изменяются. Чем более аморфна целлюлоза, тем более «подвижно» пространственное перераспределение внутри нее микрополостей. В кри-
|
сталлической части целлюлозы |
||||||
|
также возможно |
образование |
|||||
|
микрополостей |
— |
дефектов |
||||
|
кристаллической структуры. |
|
|||||
|
При |
влажности |
8% |
все |
|||
|
микрополости |
целлюлозы |
за- |
||||
|
полнены |
молекулами |
воды. |
||||
|
Образуются взаимные |
водо- |
|||||
|
родные связи между молекула- |
||||||
|
ми воды и с функциональными |
||||||
|
полярными группами макромо- |
||||||
|
лекул целлюлозы. Это снижает |
||||||
|
подвижность звеньев макромо- |
||||||
|
лекул и молекул воды. При |
||||||
|
влажности от 8% до полной |
||||||
|
влагоемкости 20% заполняются |
||||||
|
более крупные поры. Молеку- |
||||||
|
лы воды в них имеют большую |
||||||
|
подвижность. Вследствие на- |
||||||
|
бухания возрастает также под- |
||||||
Рис. 1.5. Зависимость спин-спиновой ре- |
вижность |
звеньев |
макромоле- |
||||
лаксации t 10–3 (c) от влажности W (%) |
кул, так как уменьшается число |
||||||
кристаллической (1) и аморфной (1′) |
непосредственных |
водородных |
|||||
структуры хлопка, крахмала (2), шерсти |
связей между функциональны- |
||||||
(3), желатина (4), агар-агара (5) |
ми группами контактирующих |
||||||
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
|
|
макромолекул.
В меньшей степени подобное явление наблюдалось во влажном агар-агаре. В остальных материалах двойная подвижность сорбированных молекул не наблюдалась, так как поглощение воды этими материалами в исследуемом диапазоне влажности было значительно меньше их полной влагоемкости.
Другим методом, позволяющим исследовать структуру и свойства сорбированной воды, является диэлектрический метод [2, 8]. Сущность диэлектрического метода состоит в измерении макроскопических характеристик поляризации диэлектрика во внешнем электрическом поле. В постоянном электрическом поле поляризация диэлектрика характеризуется диэлектрической проницаемостью ε0, а в переменном — комплексной диэлектрической проницаемостью ε . Действительная часть ε′ комплексной диэлектрической проницаемости пропорциональна электроемкости конденсатора с исследуемым диэлектриком. Мнимая его часть (коэффициент диэлектрических потерь ε″) пропорциональна изотермическим потерям энергии при поляризации вещества.
Применение диэлектрического метода наиболее эффективно для изучения полярных сорбатов, молекулы которых обладают сравнительно большими дипольными моментами.
Анализ исследований различных материалов, значительно отличающихся по структуре и физико-химическим свойствам, позволяет установить общие закономерности сорбции на них воды.
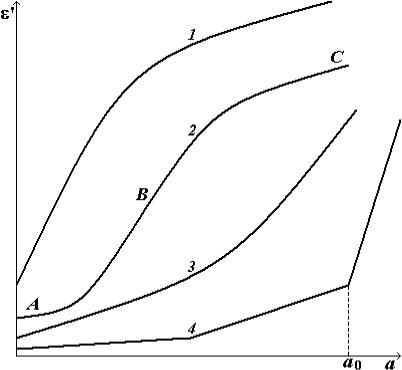
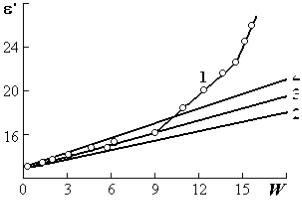
Наиболее типичной из представленных на рис. 1.6 диэлектрических
|
изотерм |
является |
S- |
|
|
образная |
|
изотерма |
|
|
(кривая 2). При малых |
|||
|
величинах |
адсорбции |
||
|
а на твердых поверх- |
|||
|
ностях молекул воды |
|||
|
(участок А) происхо- |
|||
|
дит сравнительно |
не- |
||
|
большое |
|
увеличение |
|
|
ε′. Это свидетельству- |
|||
|
ет о низкой подвиж- |
|||
|
ности молекул воды. |
|||
|
Обработка |
изотерм |
||
|
адсорбции |
воды |
по |
|
|
методу БЭТ показала, |
|||
|
что участку А диэлек- |
|||
|
трической |
изотермы |
||
Рис. 1.6. Диэлектрические изотермы |
соответствует форми- |
|||
рование |
первого |
ад- |
||
|
16 |
|
|
|
сорбированного слоя молекул. Участку АВ — образование второго слоя, имеющего большую подвижность молекул воды. Об этом свидетельствует увеличение значений ε′. При дальнейшей сорбции основную роль в поляризации играют последующие слои адсорбированных молекул воды. Их число и подвижность возрастают. Поэтому значения ε′ стремятся к величине диэлектрической проницаемости обычной воды (участок ВС).
На некоторых диэлектрических изотермах отсутствует участок ВС (кривая 3) и участок А (кривая 1). Это связано с экспериментальными трудностями измерений ε′ при больших и малых значениях сорбции а.
Особый интерес представляют диэлектрические изотермы для органических материалов. Согласно калориметрическим и сорбционным исследованиям первым двум участкам изотермы (график 4) соответствует различная энергия связи молекул с центрами сорбции биополимеров.
Поглощение влаги в начале сорбции происходит внутри микропор, в которых находятся единицы молекул воды. Они имеют наибольшую энергию связи. Затем сорбция имеет место в более крупных полостях. При этом энергия связи с макромолекулами снижается.
Ориентационная поляризация таких молекул воды зависит от степени их связанности с полярными центрами сорбции. Для оценки ориентационной поляризации предложена модель заторможенных диполей. Согласно этой модели жесткие диполи могут ориентироваться в ограниченном пространстве микропор в пределах определенного телесного угла.
В обычной воде все диполи молекул воды ориентируются преимущественно вдоль вектора внешнего электрического поля и частично против него. В пространстве микропор сорбированные полярные молекулы воды такой возможности не имеют. Поэтому их ориентационная поляризация существенно меньше, чем молекул объемной жидкости.
Третий участок графика 4 начинается с влагосодержания а0. На этом участке резко возрастают значения ε′, а также ε′′ из-за увеличения, в основном, переноса протонов.
Для третьего участка характерно образование внутри сорбента комплексов с водородной связью (КВС). Это «цепочки» связанных между собой водородными связями функциональных полярных групп и сорбированных молекул воды. Их длина при малой влажности сорбента ограничена размерами микрополости. По этим «цепочкам» происходит туннельный перенос протонов. Их миграция вызывается реорганизацией системы сор- бент-сорбат.
По мере увеличения числа сорбированных молекул воды в микропорах и их ориентации в электрическом поле возрастает диэлектрическая проницаемость системы сорбент-сорбат. Это влечет локальные переходы молекул воды в ионную форму с выделением протонов по схеме: H2O ↔H++OH–.
17
Аномальная подвижность протонов в структуре льда дает основание полагать, что и в КВС возможен перенос протонов по конечной длине цепочек вдоль вектора внешнего электрического поля и образование макродиполей. Согласно расчетам доли ориентационной и протонной поляризации приблизительно одинаковы. Наблюдаемые в опытах частотные зависимости величины ε′ от влагосодержания свидетельствуют об изменении механизмов процесса ориентационной и связанной с ней протонной поляризацией в переменных электрических полях. С увеличением частоты уменьшается ориентационная поляризация, что приводит к снижению в КВС числа переходов из молекулярной формы молекул воды в ионную.
Равные значения диэлектрических проницаемостей при более высоких частотах наблюдаются в больших по длине цепочках КВС. Последние возрастают с увеличением влажности сорбента. Пробег протона увеличивается, так как происходит слияние совокупности сорбированных молекул в нескольких соседних микрополостях. Вследствие этого величина а0 возрастает с увеличением частоты.
При большой влажности материала происходит разложение молекул воды на электродах. За счет этого дополнительного механизма наблюдается значительное увеличение электропроводности, перенос ионов гидроксония и гидроксилов к электродам (подробнее см. раздел 3.7).
Из анализа диэлектрических исследований [2] сорбированной воды в набухающих органических материалах (крахмал, целлюлоза, торф) следует, что первоначально молекулы сорбируются на функциональных группах и заполняют микрополости. В них помещаются единицы или ассоциаты из нескольких молекул воды. При неполном заполнении подвижность молекул H2O внутри микрополостей сравнительно велика за счет перескоков на свободные центры сорбции и поворотов относительно линии связи с ними. При полном заполнении микрополостей происходит стабилизация структуры сорбированных молекул, приводящая к снижению их подвижности.
При влажности крахмала до 3% диссоциация молекул вод на ионы маловероятна. По мере дальнейшего увлажнения сорбента молекулы воды сорбируются в более крупных порах-полостях с меньшей средней энергией связи. Отдельные дискретные ассоциаты из молекул воды в микро- и промежуточных порах крахмала начинают контактировать друг с другом. Между ними образуются Н-связи. В результате возникает пространственная сеть молекул воды. Они «опираются» на функциональные полярные группы и связаны между собой водородными связями внутри пор крахмала. Это влечет резкое увеличение его электропроводности за счет перехода части молекул воды в ионную форму и миграции протонов и гидроксилов по цепочкам КВС к электродам.
18
В природных материалах (глины, торф) из-за наличия поглощенных катионов [2] механизм поляризации и электропроводности более сложный, чем в крахмале.
Одной из проблем при диэлектрических исследованиях является определение диэлектрической проницаемости сорбированной воды. Для ее оценки обычно применяют формулы Бруггемана, Лоренца, Вагнера. Диэлектрическая проницаемость, как и плотность, является массовой характеристикой сорбированной воды. Поэтому для отдельных, не связанных между собой сорбированных молекул некорректно определять диэлектрическую проницаемость.
Рассмотрим два варианта сравнительной оценки диэлектрических свойств сорбированной и свободной (обычной) воды.
Согласно первому варианту можно рассчитать диэлектрическую проницаемость гипотетической смеси сорбент+свободная вода+воздух на основе теории Онзагера-Фрелиха. Затем необходимо провести сравнение зависимости диэлектрической проницаемости смеси от объемного содержания воды с экспериментальной диэлектрической изотермой сорбции. На основе этого можно судить о том, насколько велик вклад сорбированных молекул воды в поляризацию по сравнению с поляризацией свободной воды (рис. 1.7).
Второй подход позволяет рассчитывать диэлектрическую проницаемость сорбированной воды по той же методике. В этом случае получается относительная диэлектрическая проницаемость εс не реальной сорбированной влаги, а включений некоторой «гипотетической» воды. Последняя налагает запрет на расчет молекулярных характеристик поглощенных молекул воды, но дает возможность провести оценку вклада сорбированных молекул по сравнению с молекулами свободной воды ε0 (рис. 1.8).
|
Экспериментальная |
зависи- |
|
мость (график 1), приведенная на |
|
|
рис. 1.7, подобна графику 4 на рис. |
|
|
1.6. При малых абсолютных влаж- |
|
|
ностях W <9% молекулы дискретно |
|
|
расположены внутри частиц мате- |
|
|
риала. Диэлектрическую прони- |
|
|
цаемость ε′ хорошо согласуется с |
|
|
формулой Вагнера. При влажно- |
|
|
стях W >9% вследствие |
затормо- |
Рис. 1.7. Зависимость диэлектрической |
женной ориентационной и наличия |
|
проницаемости ε′ от влажности торфа W протонной поляризации эта форму- |
||
при частоте 5 кГц и температуре 298 К: |
ла не применима. |
|
экспериментальная (1) и теоретические, |
Диэлектрическая |
проницае- |
рассчитанные по формулам Лоренца (2), |
мость при малых влажностях для |
|
Вагнера (3), Бруггемана (4) |
|
|
19 |
|
|
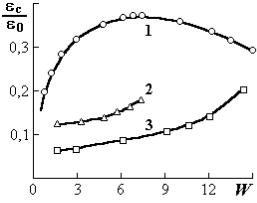
сорбированной воды в крахмале εс ≤0,4ε0 (рис. 1.8). Расчетная величина диэлектрической проницаемости воды ε0 по формулам Онзагера-Кирквуда-Фрелиха равна 75. Она меньше, чем экспериментальное значение ε0 =80. Для более жестких сорбентов (целлюлоза, торф) значения εс ≤0,2ε0.
При большой влажности материалов поглощенная влага в макропорах, как показывает ЯМР, диэлектрические и ка-
бированной воды εс к объемной ε0, лориметрические методы исследований, от влажности W (%): крахмала (1), близка соответствующим характеристи-
целлюлозы (2), торфа (3) кам обычной воды.
Таким образом, при малых влажностях более низкая диэлектрическая проницаемость сорбированной влаги по отношению к обычной воде в макрообъемах вызвана не только энергией ее связи с центрами сорбции. Основной причиной являются ориентационная и протонная поляризации молекул воды в стесненных пространствах микрополостей.
1.5. Уравнения сорбции
Для расчета адсорбционных процессов применяются уравнения Ленгмюра, БЭТ и другие [1, 9]. В линейной форме уравнение Ленгмюра:
p/a =1/(am b) +p/am, |
(1.5.1) |
где b — константа, слабо зависящая от температуры; а — масса вещества, адсорбированного при давлении p; am — емкость монослоя.
Уравнение (1.5.1) можно применять при малых значениях p/ps для тел, имеющих внутреннюю пористость. Внутри этих пор происходит локальная сорбция молекул на активных дискретных центрах, имеющих одинаковую энергию связи сорбат–сорбент. В связи с этим понятие «мономолекулярный слой» следует заменить «мономолекулярной сорбцией» am, понимая под этим термином сорбцию на каждом активном центре по одной молекуле сорбата.
Если количество центров сорбции в объеме зерна на килограмм сорбента равно n0, то значение am =n0/N0, кмоль/кг (N0 — число Авогадро). При поступлении молекул сорбата вглубь частиц их сорбция происходит пропорционально числу свободных центров сорбции и соответственно разности am −a. Кроме того, количество сорбированных молекул пропорционально концентрации газа (пара), поглощаемого вещества в порах сор-
20
