
- •Кафедра теоретических основ материаловедения
- •Гринева с.И., Сычев м.М., Лукашова т.В.,
- •Коробко в.Н., Мякин с.В.
- •Коррозия и методы защиты
- •Содержание
- •Введение
- •1 Краткие сведения о коррозионных процессах
- •1.1 Классификация коррозионных разрушений
- •1.2 Методы оценки коррозионной стойкости
- •1.3 Методы коррозионных испытаний
- •2 Факторы, влияющие на развитие коррозии материалов
- •2.1 Внутренние факторы коррозии
- •2.1.1 Термодинамическая устойчивость металла
- •2.1.2 Положение металла в периодической системе элементов
- •2.1.3 Химический состав и структура сплавов
- •2.1.4 Шероховатость поверхности и внутренние напряжения в деталях
- •2.2 Внешние факторы коррозии
- •2.2.1 Влияние рН на скорость коррозии
- •2.2.2 Влияние кислорода на скорость коррозии
- •2.2.3 Влияние температуры на скорость коррозии
- •2.2.4 Влияние давления на скорость коррозии
- •2.2.5 Влияние скорости движения электролита на скорость коррозии
- •2.2.6 Влияние состава и концентрации нейтральных солей на скорость коррозии
- •3 Химическая коррозия металлов
- •3.1 Газовая коррозия
- •3.1.1 Образование оксидных соединений на поверхности металла
- •3.1.2 Условия образования, защитных оксидных пленок
- •3.1.3 Скорость роста пленки на металлах
- •3.1.4 Газовая коррозия стали и чугуна
- •3.1.5 Катастрофическая газовая коррозия
- •3.1.6 Водородная коррозия. Водородный износ
- •3. 1.7 Карбонильная коррозия
- •3.1.8 Коррозия, вызываемая сернистыми соединениями
- •3.1.9 Коррозия, вызываемая хлором
- •3.1.10 Защита от газовой коррозии
- •3.2 Коррозия металлов в неэлектролитах
- •4. Электрохимическая коррозия
- •4.1 Особенности строения электролитов
- •4.2 Образование двойного электрического слоя
- •4.3 Электродные потенциалы
- •4.4 Механизм электрохимической коррозии
- •4.5 Поляризация электродов
- •4.6 Деполяризация электродов
- •4.7 Коррозионная диаграмма Эванса
- •4.8 Факторы, ограничивающие электрохимическую коррозию
- •5. Пассивность металлов
- •5.1 Теория пассивности металлов
- •5.2 Кинетика анодных процессов при пассивации металлов
- •6 Атмосферная коррозия металлов
- •6.1 Факторы, вызывающие атмосферную коррозию
- •6.2 Виды и механизм атмосферной коррозии
- •6.3 Скорость атмосферной коррозии
- •7. Подземная коррозия
- •7.1 Почвенная коррозия
- •7.2 Коррозия, вызванная действием блуждающих токов
- •8. Локальная коррозия
- •8.1 Точечная (питтинговая) коррозия
- •8.2 Щелевая коррозия
- •8.3 Межкристаллитная коррозия
- •8.4 Ножевая коррозия
- •9 Методы защиты от коррозии
- •9.1 Защита металлов от коррозии обработкой коррозионной среды
- •9.1.1 Удаление агрессивных компонентов из коррозионной среды
- •9.1.2 Защита металлов от коррозии ингибиторами
- •9.1.3 Механизм защитного действия ингибиторов
- •9.1.4 Влияние некоторых факторов на эффективность действия
- •9.2 Защитные покрытия
- •9.2.1 Металлические покрытия
- •9.2.2 Защитные покрытия на органической основе
- •9.2.3 Защитные покрытия на неорганической основе
- •9.3 Электрохимическая защита
- •9.3.1 Катодная зашита
- •9.3.2 Анодная защита
- •9.3.3 Защита от коррозии, вызываемой блуждающими
- •9.4 Защита от коррозии на стадии проектирования
- •9.4.1 Выбор материалов
- •9.4.2 Рациональные геометрические формы конструкций
- •Литература
- •Коррозия и методы защиты
2.1.4 Шероховатость поверхности и внутренние напряжения в деталях
Различают грубую обработку (например, пескоструйная, крацевание, обработка напильником и др.) поверхности и тонкую (шлифование, полирование).
С увеличением шероховатости поверхности коррозионная стойкость снижается, так как облегчается смачивание металла и на его поверхности имеется больше активных мест. На отшлифованной, более чистой поверхности, формируется плотная и однородная оксидная пленка, защищающая металл в начальный период развития коррозии, Конечно, если реагент обладает очень высокой коррозионной активностью и коррозия идет быстро, то разница в скорости коррозии на поверхности с различной шероховатостью невелика.
Внутренние напряжения в деталях, вызванные внешней нагрузкой или термической обработкой при воздействии агрессивной среды, приводят к ускоренному коррозионному разрушению. Коррозионно-механическое разрушение металлов носит общее название «коррозия под напряжением». В химической промышленности аппараты работают в условиях высоких механических нагрузок и агрессивных сред.
2.2 Внешние факторы коррозии
Наиболее существенным фактором коррозии является агрессивная среда, с которой контактирует металл. Чаще всего коррозионные процессы протекают в растворах электролитов (кислот, щелочей, солей) и неэлектролитов (жидкостей и газов). К внешним факторам относятся условия, в которых происходит коррозия, такие как температура, давление, движение раствора и др. На скорость и характер коррозии в электролитах существенное влияние оказывают водород и кислород.
2.2.1 Влияние рН на скорость коррозии
Скорость электрохимической коррозии, как правило, является функцией концентрации ионов водорода Н+, которая оценивается водородным показателем рН. Молекулы воды диссоциируют на ионы водорода Н+ (катионы) и гидроксилионы ОН— (анионы):
H2O ⇄H+ + OH—
Степень диссоциации дистиллированной воды незначительна. Концентрация ионов Н+ и ионов ОН— в чистой нейтральной воде одинакова и равна [Н+] = [ОН— ] = 10—7 моль/л. Произведение концентрации [Н+] и концентрации [ОН—] в воде называется ионным произведением воды КB:
КB= [Н+] ⋅[ОН—] =10—7∙10—7= 10—14.
Концентрацию Н+ в водном растворе электролита можно определить через концентрацию ОН— и наоборот, по формулам:
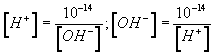
Ионы Н+ являются носителями кислотных свойств, а ионы ОН— —носителями щелочных свойств. Изменение концентрации ионов водорода, а, следовательно, и концентрации гидроксилионов приводит к изменению кислотности или щелочности среды.
Использование отрицательных чисел не всегда удобно. Поэтому введена особая единица измерения концентрации ионов водорода, называемая водородным показателем рН. Водородным показателем называется отрицательный десятичный логарифм концентрации ионов водорода:
рН = - lg [Н+].
Если концентрация ионов водорода Н+ равна 10—5 моль/л,
то —lg10—5 = 5. Аналогично принят гидроксильный показатель рОН. Как степень кислотности, так и степень щелочности среды можно количественно охарактеризовать значениями рН и рОН:
нейтральная — рН = 7 и рОН = 7
кислая — рН < 7 и рОН > 7
щелочная — рН >7 и рОН < 7
Следует помнить, что из-за отрицательного показателя степени с увеличением концентрации ионов водорода и повышения кислотности числовое значение рН понижается.
Водородный показатель имеет важное значение для понимания большинства коррозионных процессов, протекающих в электролитах, так как ионы Н+ и ионы ОН - непосредственно участвуют в этих процессах.

Рисунок 4 — Зависимость скорости коррозии разных металлов от рН
На рисунке 4 приведены кривые изменения скорости коррозии разных металлов в зависимости от рН растворов. Диаграмма (а) характерна для благородных металлов Аg, Аu, Рt. Для них скорость коррозии не зависит от рН среды. Эти металлы обладают высокой коррозионной стойкостью в кислых, нейтральных и щелочных средах. Диаграмма (б) характерна для Fе, Сu, Мn, Мg—малостойких в кислых средах и стойких в щелочных. В связи с большим практическим применением железа (стали) отметим, что при рН = 4 наблюдается сильная коррозия железа с выделением водорода и образованием растворимых продуктов коррозии. В средней области, при
рН = 4÷9 скорость коррозии железа практически не зависит от рН. В щелочной области при рН=9÷12 скорость коррозии уменьшается вследствие образования малорастворимых продуктов коррозии. Диаграмма (в) характерна для Аl, Рb, Sn, Zn — устойчивых в нейтральных средах и сильно корродирующих в кислых и щелочных. Это объясняется растворимостью оксидов этих металлов в кислотах и щелочах. Минимальная скорость коррозии наблюдается для алюминия при рН = 7, для свинца при рН = 8, для олова при рН = 9, для цинка при рН = 10. Диаграмма (г) характерна для Ni, Со, Сr —малостойких в кислых средах и более стойких в щелочных. Диаграмма (д) характерна для W, Мо, Та— коррозионно-стойких в кислых средах и неустойчивых в щелочных.
