
- •Содержание
- •2. Классификация органических соединений.
- •3. Соединения с открытой цепью.
- •3.1. Углеводороды
- •3.1.1. Алканы
- •3.1.2. Алкены или олефины (соединения этиленового ряда).
- •3.1.3. Углеводороды с двумя двойными связями (алкадиены).
- •3.1.4. Алкины (ацетиленовые углеводороды).
- •3.2. Производные углеводородов.
- •3.2.1. Галогенопроизводные алканов.
- •3.2.2. Металлоорганические соединения.
- •3.2.3. Спирты.
- •3.2.4. Простые эфиры.
- •3.2.5. Нитросоединения.
- •3.2.6. Амины.
- •3.2.7. Альдегиды и кетоны.
- •3.2.8. Карбоновые кислоты.
- •4. Карбоциклические соединения.
- •4.1. Алициклические соединения.
- •4.2. Ароматические соединения.
- •4.2.1. Ароматические углеводороды ряда бензола.
- •4.2.2. Галогенопроизводные аренов.
- •4.2.3. Ароматические сульфокислоты.
- •4.2.4. Ароматические нитросоединения.
- •4.2.5. Ароматические амины.
- •4.2.6. Диазо- и азосоединения.
- •4.2.7. Фенолы.
- •4.2.8. Ароматические альдегиды и кетоны.
- •4.2.9. Ароматические карбоновые кислоты.
- •4.2.10. Ароматические соединения с конденсированными ядрами.
- •5. Полимеры.
- •5.1. Полимеры, получаемые методом поликонденсации.
- •5.2. Полимеры, получаемые методом полимеризации.
- •6. Указания к выполнению контрольных работ.
- •7. Типовые задачи и их решение.
- •8. Контрольные задания
- •8.1. Контрольная работа 1.
- •8.2. Контрольная работа 2.
- •8.3. Контрольная работа 3.
3.2.5. Нитросоединения.
Нитросоединения характеризуются наличием нитрогруппы - NO2. Ей изомерна структура -О-NO (эфиры азотистой кислоты). В зависимости от строения атома углерода, с которым связана нитрогруппы, различают первичные
R-CH2-NO2,
вторичные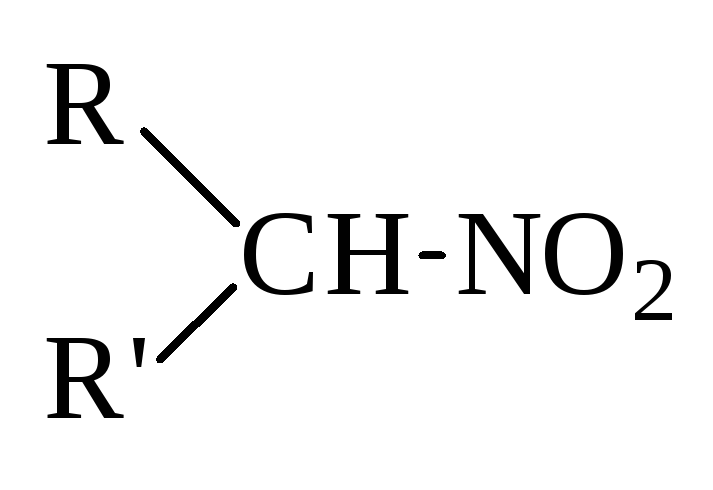 ,
третичные
,
третичные нитросоединения.
нитросоединения.
Нитрогруппа может быть представлена в виде гибрида двух эквивалентных резонансных структур
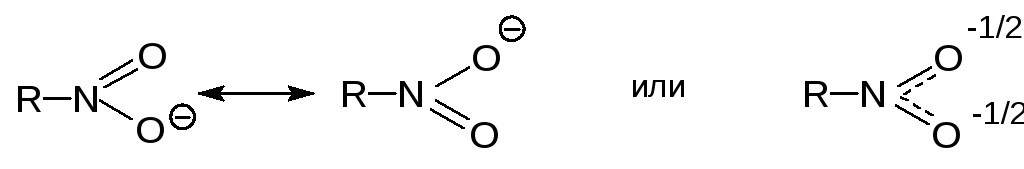
В гибридной структуре атом азота несет полный положительный заряд, а каждый атом кислорода - половину отрицательного заряда. Это обуславливает сильный отрицательный индуктивный эффект нитрогруппы - INO2 и высокую полярность нитросоединений.
Нитросоединения получают в промышленности нитрованием алканов парами азотной кислоты при 250-500оС. Другие способы получения алифатических нитросоединений основаны на реакции алкилгалогенидов с нитритом натрия в растворе диметилсульфоксида или диметилформамида. Вместо нитрита натрия часто применяют азотистокислое серебро, обычно в растворе диэтилового эфира.
Вследствие сильных электроноакцепторных свойств нитрогруппы -метиленовое -СН2- и метиленовое -СН- звенья первичных и вторичных нитроалканов обладают подвижными атомами водорода. Это проявляется прежде всего в том, что соединения с нитрогруппой при первичном или вторичном атомах углерода реагирует со щелочью в таутомерной форме. Пара электронов, связывающая этом углерода с уходящим протоном, перемещается, осуществляя связь атомов углерода и азота. При этом заряд аниона сосредотачивается на атоме кислорода и образуются соли так называемых ацинитросоединений:

Ацинитроформа характеризуется кислыми свойствами и в щелочной среде образует соль. При подкислении равновесие реакций сдвигается влево. Подвижность атомов водорода первичных и вторичных нитросоединений сказывается на их отношении к азотистой кислоте (качественная реакция).
Первичные и вторичные нитросоединения конденсируются в присутствии щелочей с альдегидами, образуя нитроспирты (нуклеофильное присоединение):
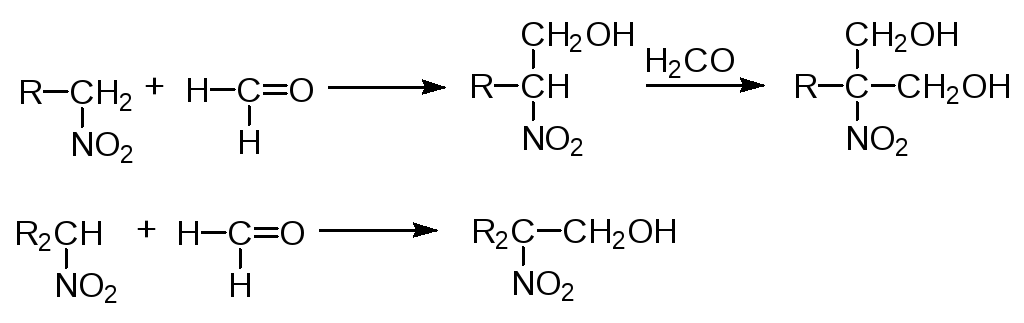
Нитроалканы используются в технике как растворители, для производства альдегидов, кислот, взрывчатых веществ, в реактивной технике, резиновой промышленности (вулканизаторы), при изготовлении пластмасс и т.д.
3.2.6. Амины.
Амины - соединения, образующиеся в результате замещения водородных атомов в аммиаке алкильными группами. В зависимости от того, сколько атомов водорода замещено радикалами, различают первичные (RNH2) и третичные (R3N) амины. Изомерия аминов зависит от положения аминогруппы и строения радикалов, связанных с атомом азота.
Первичные амины получают восстановлением нитросоединений, нуклеофильным замещением галогена в галогеналкилах или ОН-группы в спиртах под действием аммиака. Вторичные и третичные амины получают алкилированием первичных аминов (по реакции Гофмана).
Аминогруппа весьма реакционноспособна благодаря наличию связанных с атомом азота подвижных атомов водорода (реакции с азотистой кислотой, алкилирование, ацилирование и др.). Подобно аммиаку, амины проявляют основные свойства, что обусловлено наличием у атома азота неподеленной электронной пары.
Амины используют в синтезе лекарственных препаратов, красителей, в производстве ПАВ и синтетических волокон.
