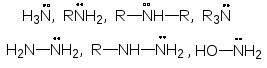- •Содержание
- •2. Классификация органических соединений.
- •3. Соединения с открытой цепью.
- •3.1. Углеводороды
- •3.1.1. Алканы
- •3.1.2. Алкены или олефины (соединения этиленового ряда).
- •3.1.3. Углеводороды с двумя двойными связями (алкадиены).
- •3.1.4. Алкины (ацетиленовые углеводороды).
- •3.2. Производные углеводородов.
- •3.2.1. Галогенопроизводные алканов.
- •3.2.2. Металлоорганические соединения.
- •3.2.3. Спирты.
- •3.2.4. Простые эфиры.
- •3.2.5. Нитросоединения.
- •3.2.6. Амины.
- •3.2.7. Альдегиды и кетоны.
- •3.2.8. Карбоновые кислоты.
- •4. Карбоциклические соединения.
- •4.1. Алициклические соединения.
- •4.2. Ароматические соединения.
- •4.2.1. Ароматические углеводороды ряда бензола.
- •4.2.2. Галогенопроизводные аренов.
- •4.2.3. Ароматические сульфокислоты.
- •4.2.4. Ароматические нитросоединения.
- •4.2.5. Ароматические амины.
- •4.2.6. Диазо- и азосоединения.
- •4.2.7. Фенолы.
- •4.2.8. Ароматические альдегиды и кетоны.
- •4.2.9. Ароматические карбоновые кислоты.
- •4.2.10. Ароматические соединения с конденсированными ядрами.
- •5. Полимеры.
- •5.1. Полимеры, получаемые методом поликонденсации.
- •5.2. Полимеры, получаемые методом полимеризации.
- •6. Указания к выполнению контрольных работ.
- •7. Типовые задачи и их решение.
- •8. Контрольные задания
- •8.1. Контрольная работа 1.
- •8.2. Контрольная работа 2.
- •8.3. Контрольная работа 3.
Министерство общего и высшего образования Российской Федерации
Тульский Государственный университет
Кафедра химии
В.А.Аверьянов, Л.П.Бородина, А.А.Горячева
Методические указания и контрольные задания по органической химии для
студентов-заочников технических специальностей
Тула 2001 г.
Рассмотрены и утверждены советом естественно-научного факультета
"_______"_____________2001 г.
г.Тула 2001 г.
Содержание
|
|
Стр | |
|
1 |
Введение |
4 |
|
|
Методические указания по темам курса |
4 |
|
2 |
Классификация органических соединений. |
14 |
|
3. |
Соединения с открытой цепью. |
15 |
|
3.1. |
Углеводороды |
15 |
|
3.1.1. |
Алканы |
15 |
|
3.1.2. |
Алкены или олефины (соединения этиленового ряда). |
17 |
|
3.1.3. |
Алкадиены (углеводороды с двумя двойными связями) |
20 |
|
3.1.4. |
Алкины (ацетиленовые углеводороды). |
21 |
|
3.2. |
Производные углеводородов. |
22 |
|
3.2.1. |
Галогенопроизводные алканов. |
22 |
|
3.2.2. |
Металлоорганические соединения. |
23 |
|
3.2.3. |
Спирты. |
24 |
|
3.2.4. |
Простые эфиры. |
25 |
|
3.2.5. |
Нитросоединения. |
25 |
|
3.2.6. |
Амины. |
26 |
|
3.2.7. |
Альдегиды и кетоны. |
27 |
|
3.2.8. |
Карбоновые кислоты. |
28 |
|
4. |
Карбоциклические соединения. |
28 |
|
4.1. |
Алициклические соединения. |
28 |
|
4.2. |
Ароматические соединения. |
29 |
|
4.2.1. |
Ароматические углеводороды ряда бензола. |
30 |
|
4.2.2. |
Галогенопроизводные аренов. |
31 |
|
4.2.3. |
Ароматические сульфокислоты. |
32 |
|
4.2.4. |
Ароматические нитросоединения. |
33 |
|
4.2.5. |
Ароматические амины. |
33 |
|
4.2.6. |
Диазо- и азосоединения. |
34 |
|
4.2.7. |
Фенолы. |
35 |
|
4.2.8. |
Ароматические альдегиды и кетоны. |
36 |
|
4.2.9. |
Ароматические карбоновые кислоты. |
37 |
|
4.2.10. |
Ароматические соединения с конденсированными ядрами. |
37 |
|
5. |
Полимеры.Типы полимеров.Физические свойства полимеров. |
38 |
|
5.1. |
Полимеры, получаемые методом поликонденсации. |
38 |
|
5.2. |
Полимеры, получаемые методом полимеризации. |
40 |
|
6. |
Указания к выполнению контрольных работ. |
42 |
|
7. |
Типовые задачи и их решение. |
43 |
|
8. |
Контрольные задания |
48 |
|
8.1. |
Контрольная работа 1. |
48 |
|
8.2. |
Контрольная работа 2. |
54 |
|
8.3. |
Контрольная работа 3. |
59 |
|
|
Литература |
64 |
Введение
Органическая химия является составной частью дисциплины общеобразовательного блока студентов ряда технических специальностей высших учебных заведений.
Курс "Органическая химия" студенты-заочники указанных специальностей изучают в осеннем семестре на втором году обучения.
В процессе подготовки в начале семестра студенты слушают установочные лекции (4-6 час.). Самостоятельная работа над курсом предполагает выполнение трех контрольных работ, представляющих собой разделы курса: "Соединение с открытой цепью", "Карбоциклические соединения", "Теоретические представления в органической химии".
После сдачи зачета по контрольным работам студенты вызываются на сессию, где выполняют лабораторный практикум (6 час.) и сдают экзамен. Объем самостоятельной работы студента составляет часов.
Самостоятельная работа должна быть ориентирована на проработку программы курса утвержденного Минобразования РФ для не химических специальностей ВУЗов.
Методические указания по темам курса
1. Общие положения.
Органическая химия - раздел химической науки, изучающий состав структуру и свойства соединений углерода и водорода и их производных.
Основным объектом исследования органической химии являются химические превращения органических соединений.
Современный уровень представлений об электронных и пространственных эффектах различных функциональных групп в органических соединениях позволяет предсказывать на основе структуры их химическое поведение.
В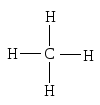 настоящее время принято изображать
строение органических соединений с
помощью графических формул, состоящих
из символов атомов и черточек, изображающих
ковалентные связи. Каждая черточка
соответствует обобществленной паре
электронов. Например, четыре ковалентные
связи в метане изображают четырьмя
черточками
настоящее время принято изображать
строение органических соединений с
помощью графических формул, состоящих
из символов атомов и черточек, изображающих
ковалентные связи. Каждая черточка
соответствует обобществленной паре
электронов. Например, четыре ковалентные
связи в метане изображают четырьмя
черточками
каждая из которых соответствует одной паре обобществленных электронов.
Неподеленные пары электронов изображают точками, каждая точка соответствует одному электрону.
Н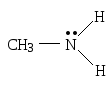 апример,
в молекуле метиламина у атома азота
три ковалентные связи, каждую из которых
изображают черточкой, и одна неподеленная
пара электронов, которую изображают
парой точек:
апример,
в молекуле метиламина у атома азота
три ковалентные связи, каждую из которых
изображают черточкой, и одна неподеленная
пара электронов, которую изображают
парой точек:
Число неподеленных пар электронов может быть легко определено на основе правила октета: в органических соединениях атомы элементов второго периода таблицы Менделеева имеют восьмиэлектронную оболочку. Иными словами, для каждого из этих атомов сумма неподеленных и обобществленных электронов равна 8.
Каждому соединению отвечает одно название. В настоящее время общеупотребительны три способа наименований.
1. Тривиальные или случайные названия связаны с происхождением или способом получения вещества. Например, ацетон, муравьиная кислота и т.д.
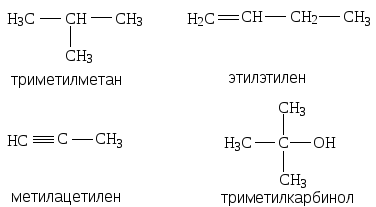
2. Рациональная номенклатура рассматривает сложные соединения как производные простейших веществ: метана, этилена, ацетилена и т.д. Названия радикалов производят от названия углеводорода, с заменой окончания -ан на -ил. Атом углерода в радикале называют первичным, вторичным или третичным, в зависимости от того, со сколькими атомами углерода он связан, например:
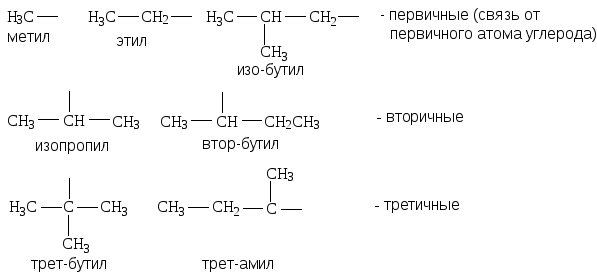
Иными словами, название любого вещества строится по названию простейшего представителя гомологического ряда, например:
3. Систематическая номенклатура. Согласно этой номенклатуре за основу названия выбирается самая длинная цепь атомов углерода, а боковые цепи рассматриваются как заместители:
- если необходимо указать положение заместителя, то его обозначают порядковым номером атома углерода в цепи:
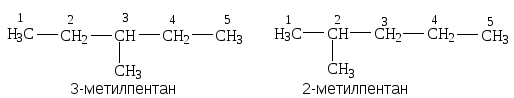
- нумерацию цепи начинают с конца, к которому ближе заместитель: 2-метилпентан, а не 4-метилпентан;
- если заместитель встречается больше одного раза, то перед ним ставят приставку ди-, три-, тетра-, а в случае, если у одного атома углерода стоят два заместителя, то цифру повторяют два раза, например:
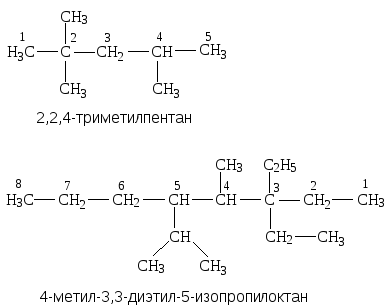
- при наличии нескольких различных заместителей, их перечисляют в порядке возрастания размера или по алфавитному порядку.
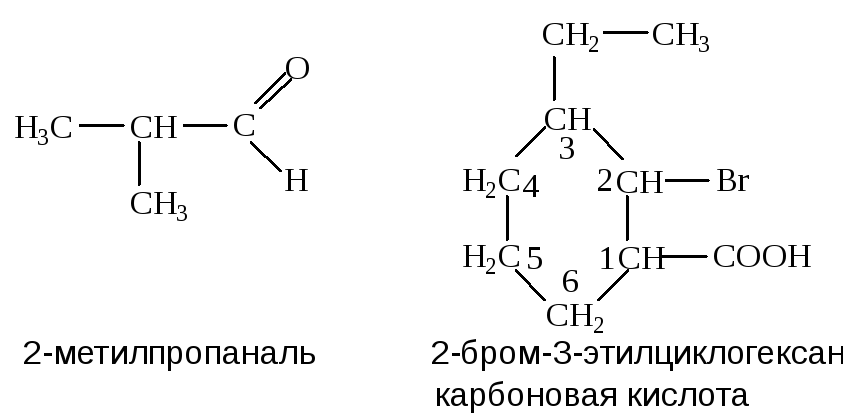
- если в соединении имеются функциональные группы, то в конце названия ставится окончание, характеризующее главную группу, и от нее ведется отсчет:
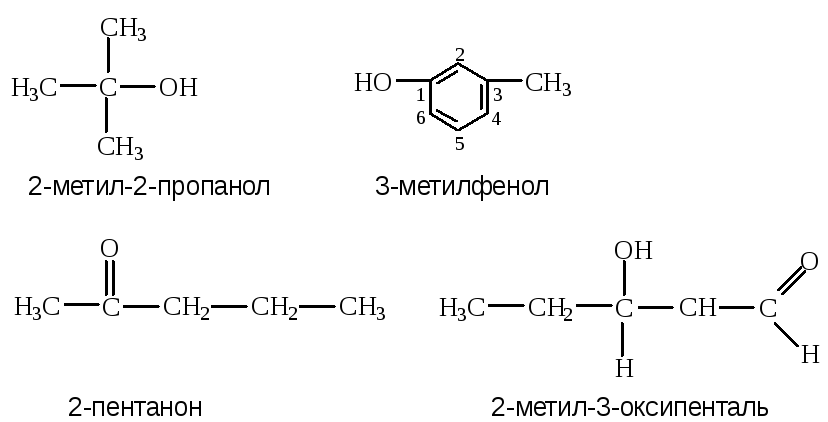
Развитие современных представлений в области органической химии связано с квантовохимическим подходом к изучению структуры соединений и их реакционной способности. Различают атомные орбитали (АО) и молекулярные орбитали (МО). Атомные орбитали имеют различную форму. s-атомные орбитали соответствуют значению орбитального квантового числа l = 0 и имеют сферическую форму. p-орбитали соответствуют значению орбитального квантового числа l = 1 и поэтому представляют собой набор из трех (2 l+1) орбиталей, главные оси которых взаимно перпендикулярны. p-орбитали имеют форму объемных восьмерок.
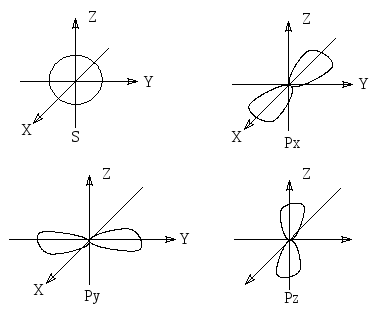
Образование химических связей осуществляется путем перекрывания атомных орбиталей. При этом из двух атомных орбиталей образуются две молекулярные орбитали: связывающая и несвязывающая (разрыхляющая) Связывающей орбитали соответствует более низкий энергетический уровень по сравнению с энергиями исходных атомных орбиталей. Несвязывающей (разрыхляющей) орбитали, наоборот, соответствует более высоки энергетический уровень, по сравнению с энергетическими уровнями исходных атомных орбиталей.
Относительные энергии орбиталей атомов А и В и молекулярных орбиталей, принадлежащих атомам А и В:
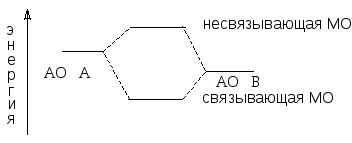
В силу более низкой энергии связывающей молекулярной орбитали, электроны с антипараллельными спинами переходят с атомных орбиталей на эту молекулярную орбиталь. Это обусловливает образование химической связи. Несвязывающая молекулярная орбиталь, в силу ее более высокой энергии по сравнению с исходными атомными орбиталями, является вакантной (не содержит электронов).
Если при перекрывании атомных орбиталей их главная ось симметрии совпадает с межъядерной осью, то образующие связи называются -связями. Они обеспечивают максимальное перекрывание, что обуславливает прочность этих связей. Примерами -связей являются связи, осуществляемые путем перекрывания s-s; s-p и p-p орбиталей, когда их главные оси симметрии совпадают.
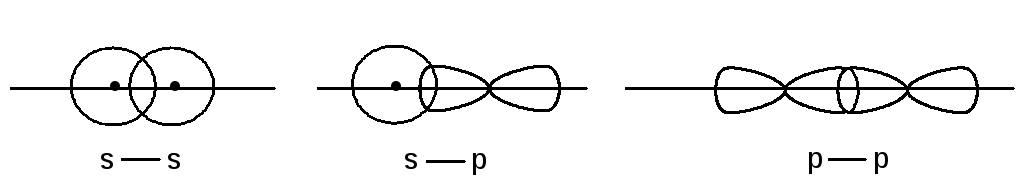
Другой тип перекрывания включает две p-орбитали, главные оси симметрии которых параллельны между собой, но перпендикулярны межъядерной оси:
Т акой
боковой способ перекрывания обуславливает
образование-связей.
Термин "гибридизация" отражает
усреднение различных (по форме и энергии)
орбиталей. Например, sp-гибридизация
соответствует усреднению одной s
и одной p-орбиталей,
sр2-
гибридизация - усреднение одной s
и двух p-орбиталей
и т.д.
акой
боковой способ перекрывания обуславливает
образование-связей.
Термин "гибридизация" отражает
усреднение различных (по форме и энергии)
орбиталей. Например, sp-гибридизация
соответствует усреднению одной s
и одной p-орбиталей,
sр2-
гибридизация - усреднение одной s
и двух p-орбиталей
и т.д.
Органические реакции сопровождаются разрывом и образование химических связей. В зависимости от типа разрыва связей различают гомолитические (радикальные) и гетеролитические (ионные) реакции.
П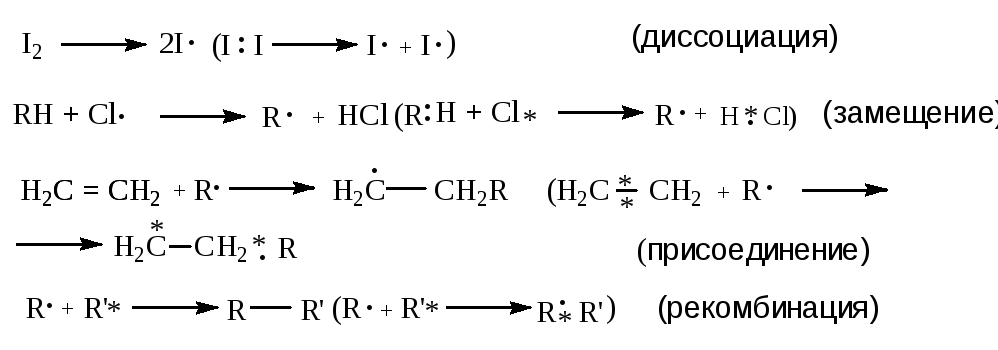 ри
реализации гомолитических реакций
происходит симметричный разрыв связей.
Образующиеся при этом неспаренные
электроны либо участвуют в образовании
новой связи, либо дают начало образованию
радикала например:
ри
реализации гомолитических реакций
происходит симметричный разрыв связей.
Образующиеся при этом неспаренные
электроны либо участвуют в образовании
новой связи, либо дают начало образованию
радикала например:
Гетеролитические реакции характеризуются несимметричным разрывом связей. При этом электронная пара, ответственная за образование связи, которая претерпевает разрыв, отходит к одному из фрагментов, который, таким образом, приобретает отрицательный заряд и становится анионом. Соответственно, другой фрагмент становится катионом. Образующиеся катион и анион в ходе гетеролитического разрыва могут взаимодействовать с присутствующими молекулами с образованием новых катионов и анионов. Взаимодействие разноименно заряженных частиц приводит к образованию нейтральной молекулы:
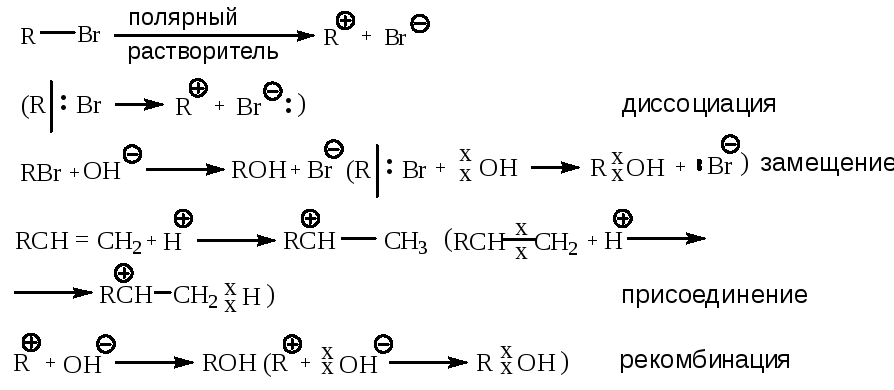
Любая химическая реакция может быть охарактеризована энергетической диаграммой
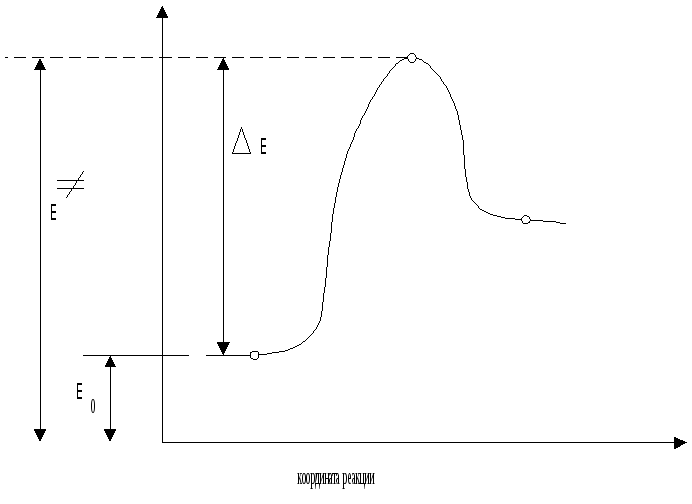
Успех реакции определяется высотой энергетического барьера Е: чем выше этот барьер, тем системе труднее его преодолеть и, соответственно, тем медленнее протекает реакция. Таким образом, скорость реакция определяется значением Е, которое, в свою очередь, зависит от энергии исходного (Ео) и переходного (Е) состояний:
![]()
Поскольку Е - энергия, определяемая энергией образующихся и рвущихся связей, очевидно, что она является функцией энергии исходных и конечных частиц. Это означает, что в конечном счете, энергетический барьер и, соответственно, скорость реакция определяется энергией исходных и конечных частиц. Энергия же частиц (молекул, ионов, радикалов), вступающих в реакцию и образующихся в результате ее, определяется электронными эффектами: индуктивным и мезомерным (эффект сопряжения).
Электронные эффекты, обусловленные различной электроотрицательностью атомов, называются индуктивными эффектами. Следствием таких эффектов является смещение электронов от менее к более электроотрицательному атому. Такие смещения обозначаются стрелкой вдоль линии связи:

Если заместитель по сравнению с водородом увеличивает электронную плотность на связанном с ним атоме, то такой индуктивный эффект оценивается как положительный (+I)-эффект. Если же заместитель по сравнению с водородом уменьшает электронную плотность на связанном с ним атоме, то такой эффект оценивается как отрицательный (-I)-эффект.
Алкильные группы обладают положительным индуктивным эффектом, который, в зависимости от их числа, при атоме углерода изменяется следующим образом:

Полагают, что такой порядок изменения индуктивного эффекта лежит в основе рядов устойчивости соответствующих радикалов и карбкатионов:
![]()
Индуктивный эффект, оказываемый полярной группой, затухает по длине углеродной цепи и не распространяется обычно дальше третьего углеродного атома.
Мезомерный эффект заключается во взаимодействии Р-электронов Р-электронной пары или -связи заместителя со свободной или занятой Р-орбиталью атома углерода в состоянии sр2- или sр-гибридизации. При таком сочетании структуры заместителя и остальной части молекулы происходит перекрывание Р- или -орбиталей заместителя с Р-орбиталями углеродных атомов остальной части молекулы. В результате заместитель оказывается дополнительно связанным с остатком молекулы, кроме обычной -связи, посредством небольшого -электронного облака. Мезомерный эффект проявляется при копланарности перекрывающихся p-орбиталей (параллельности их главных осей); мало затухает с расстоянием и приводит к существенному перераспределению электронной плотности в молекулах или других частицах.
Мезомерный эффект обозначает буквой М и различают электронодонорный (+М) и электроноакцепторный (-М) мезомерные эффекты.
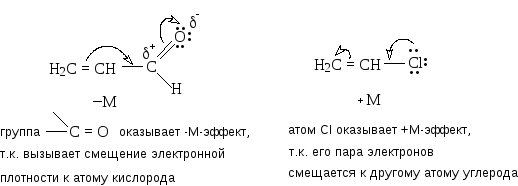
Разновидностью изомерного эффекта является эффект сверхсопряжения (гиперконьюгации) Под сверхсопряжением понимают взаимодействие -электронов связей -С-Н с вакантной или полувакантной p-орбиталью атома углерода при соседнем углеродном атоме. Так, стабилизация изопропилкарбкатиона обеспечивается за счет делокализации положительного заряда, вызванного сверхсопряжением:
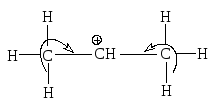
Иногда эффект сопряжения изображается как результат перекрывания молекулярной орбитали - С-Н - связи с p-орбиталью атома углерода (-р-перекрывание):
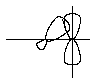
Естественно, что сила эффекта сверхсопряжения определяется числом - С-Н - связей, способных участвовать во взаимодействии с p-орбиталью углерода. Это обуславливает (вместе с индуктивным эффектом) ряды стабильности радикалов и карбатионов:
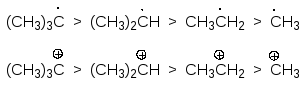
Органические реакции принято подразделять, в зависимости от стехиометрического результата на реакции присоединения (символ Аd) замещения (символ S), элиминирования (отщепления, символ Е), перегруппировки и т.д. В качестве атакующих агентов могут выступить радикал, электрофил, нуклеофил. В зависимости от характера атакующего реагента - радикал, электрофил, нуклеофил - различают реакции радикальные (R), электрофильные (Е), нуклеофильные (N). На основе этой классификации многочисленные реакции, в которые вступают органические соединения, могут быть отнесены к нескольким типам: радикального замещения (SR), электрофильного замещения (SE), нуклеофильного замещения (SN); радикального присоединения (АdR), электрофильного присоединения (АdЕ), нуклеофильного присоединения (АdN); элиминирования (Е): перегруппировки и т.д.
Реагенты, действие которых связано с приобретением электронов для образования новой ковалентной связи, называются электрофильными.
Основные электрофильные реагенты
|
Протон |
Н |
|
Ион гидроксония |
H3O+ |
|
Катионы – производные минеральных кислот |
F+, Cl+, Br+, J+, NO2+, NO+ |
|
Катионы металлов |
Hg2+, Ag+ |
|
Галогениды металлов |
SbCl5, MgBr2 |
|
Галогениды бора |
BF3, BCl3 |
|
Бораны и аналогичные соединения Al |
BH3, ВBr3, AlH3, AlBr3 |
|
Карбкатионы |
|
|
Кабены |
|
|
Ионы аммония |
|
|
Ионы диазония |
|
|
Ионы иминия |
|
|
Нитрены |
|
|
Арины |
|
Реагенты, предоставляющие электронную пару для образования новой ковалентной связи с атомными ядрами других молекул, называются нуклеофильными.
Основные нуклеофильные реагенты
Анионы
|
Гидрид-ион |
Н: |
|
Карбанионы |
|
|
Ацетиленид-ионы |
|
|
Цианид-ионы |
|
|
Еноля-ионы |
|
|
Оксанионы |
|
|
Сульфид-ионы |
|
|
Амид-ионы |
|
|
Азид-ион |
|
|
Галогенид ионы |
|
Нейтральные молекулы
|
Енамины |
|
|
Фосфораны |
|
|
Производные азота |
|
|
Производные фосфора |
|
|
Производные серы |
|
|
Кислородсодержащие соединения |
|


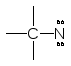

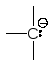 Присутствуют
в металоорганических соединениях
Присутствуют
в металоорганических соединениях