
- •Содержание
- •2. Классификация органических соединений.
- •3. Соединения с открытой цепью.
- •3.1. Углеводороды
- •3.1.1. Алканы
- •3.1.2. Алкены или олефины (соединения этиленового ряда).
- •3.1.3. Углеводороды с двумя двойными связями (алкадиены).
- •3.1.4. Алкины (ацетиленовые углеводороды).
- •3.2. Производные углеводородов.
- •3.2.1. Галогенопроизводные алканов.
- •3.2.2. Металлоорганические соединения.
- •3.2.3. Спирты.
- •3.2.4. Простые эфиры.
- •3.2.5. Нитросоединения.
- •3.2.6. Амины.
- •3.2.7. Альдегиды и кетоны.
- •3.2.8. Карбоновые кислоты.
- •4. Карбоциклические соединения.
- •4.1. Алициклические соединения.
- •4.2. Ароматические соединения.
- •4.2.1. Ароматические углеводороды ряда бензола.
- •4.2.2. Галогенопроизводные аренов.
- •4.2.3. Ароматические сульфокислоты.
- •4.2.4. Ароматические нитросоединения.
- •4.2.5. Ароматические амины.
- •4.2.6. Диазо- и азосоединения.
- •4.2.7. Фенолы.
- •4.2.8. Ароматические альдегиды и кетоны.
- •4.2.9. Ароматические карбоновые кислоты.
- •4.2.10. Ароматические соединения с конденсированными ядрами.
- •5. Полимеры.
- •5.1. Полимеры, получаемые методом поликонденсации.
- •5.2. Полимеры, получаемые методом полимеризации.
- •6. Указания к выполнению контрольных работ.
- •7. Типовые задачи и их решение.
- •8. Контрольные задания
- •8.1. Контрольная работа 1.
- •8.2. Контрольная работа 2.
- •8.3. Контрольная работа 3.
4.2.3. Ароматические сульфокислоты.
Ароматическими сульфокислотами называются соединения, содержащие сульфогруппу -SO3H в бензольном кольце или в боковой цепи. Сульфокислоты получают прямым сульфированием углеводородов или их производных. Реакция сульфирования в ядре реализуется по механизму электрофильного замещения. Электрофильными реагентами служат:
SO3
гидросульфониевый ион
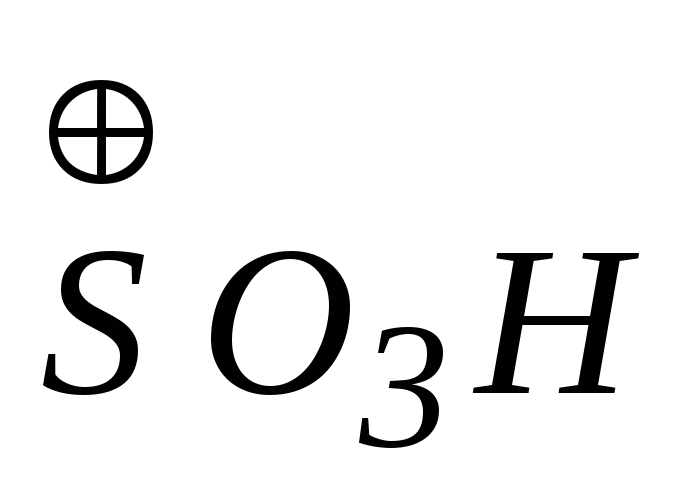 ,
образующийся в концентрированной
серной кислоте;
,
образующийся в концентрированной
серной кислоте;катион
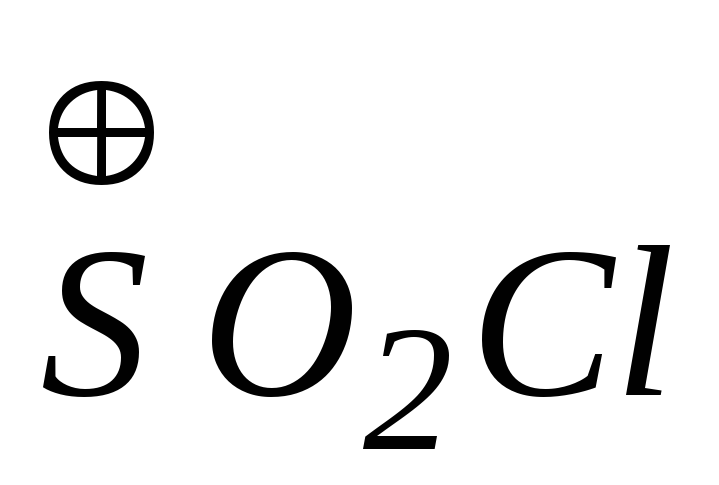 в
хлорсульфоновой кислоте.
в
хлорсульфоновой кислоте.
Реакция сульфирования бензольного кольца серной кислотой обратима, серным ангидридом - необратима. Сульфокислоты - сильные кислоты типа серной кислоты. Реакции сульфокислот делятся на три вида:
реакции сульфогруппы;
реакции нуклеофильного замещения сульфогруппы другими функциями;
реакции бензольного ядра (электрофильное замещение).
Ароматические сульфокислоты широко используют в технологии тонкого органического синтеза, в производстве синтетических красителей.
4.2.4. Ароматические нитросоединения.
Различают два типа нитросоединений:
с нитрогруппой, связанной с атомом углерода ароматического кольца;
с нитрогруппой в боковой цепи.
Для введения нитрогруппы в ароматическое кольцо наиболее широко используется прямое нитрование. Очевидно, что этот метод непригоден в тех случаях, когда ориентация, обусловленная присутствующим заместителем, не приводит к желаемому изомеру. "Тактика" синтеза состоит в использовании производных бензола с такими заместителями, которые оказывают при нитровании нужное ориентирующее действие, и последующем видоизменении этих заместителей, приводящем к желаемому конечному продукту.
Реакция нитрования ароматического кольца нитрующей смесью протекает по механизму электрофильного замещения.
Получение нитросоединений с нитрогруппой в боковой цепи осуществляется теми же методами, что и в жирном ряду.
Наиболее важным свойством нитросоединений обоих типов является их способность восстанавливаться до первичных аминов. Результат восстановления зависит от характера среды: в кислой среде сразу образуется NH2 - группа (быстрое протекание промежуточных стадий), в нейтральной и щелочной средах восстановление происходит ступенчато, с образованием промежуточных продуктов.
Обладая сильными электроноакцепторными свойствами, нитрогруппа оказывает м-ориентирующее влияние и дезактивирует кольцо в реакциях электрофильного замещения (у ароматических нитропроизводных скорость этих реакций ниже, чем у бензола). Напротив, нитрогруппа увеличивает скорость реакций нуклеофильного замещения и ориентирует нуклеофильные заместители в о- и п-положения кольца.
В результате отсутствия сопряжения нитрогруппы с м-положениями кольца (в этом положении действует, в основном, лишь слабый индукционный эффект, вызываемый атомом азота) влияние ее на нуклеофильное замещение в м-положении выражено слабо.
Ароматические нитросоединения с нитрогруппой в боковой цепи проявляют в основном свойства нитросоединений алифатического ряда.
4.2.5. Ароматические амины.
Ароматические амины являются производными аммиака. Различают:
чисто ароматические амины, когда аминогруппа непосредственно соединена с атомом углерода бензольного кольца;
амины с аминогруппой в боковой цепи, обладающие свойствами алифатических аминов.
Ароматические амины могут быть первичными, вторичными и третичными.
Вторичные и третичные ароматические амины могут быть чисто ароматическими или смешанными - жирноароматическими. Простейший ароматический амин - анилин не имеет изомеров. Его гомологи существуют в изомерных формах. Необходимо изучить способы получения первичных, вторичных и третичных аминов.
Ароматические амины имеют менее выраженный основной характер, чем жирные амины. Это объясняется взаимодействием неподеленной пары р-электронов азота с -электронной системой кольца (, р-сопряжение). Такое сопряжение приводит к делокализации неподеленной пары электронов и понижает ее способность присоединять протон.

Ароматические амины вступают в химические превращения с участием аминогруппы для ароматического ядра. В первом случае необходимо обратить внимание на реакцию с азотистой кислотой. Первичные ароматические амины при взаимодействии с азотистой кислотой образуют диaзосоединения, существующие в кислой среде в форме солей диазония:
![]()
Вторичные ароматические амины образуют с азотистой кислотой нитрозоамины, легко перегруппировывающиеся в - п-нитрозоамины, а третичные - сразу дают п-нитрозоамины. В реакциях электрофильного замещения в ароматическое ядро аминогруппа оказывает п-, о- ориентирующее действие, поскольку образующиеся п- и о- -комплексы сильно стабилизированы за счет сопряжения р-электронов амино-группы с вакантной р-орбиталью -комплексов через систему сопряженных связей ароматического ядра.
Ароматические амины легко окисляются по аминогруппе; поэтому, для проведения реакций, в которых окисление является побочным процессом, ее необходимо защитить. Обычно, это выполняется путем ацилирования аминогруппы органическими кислотами, их ангидридами или галогенангидридами. После проведения нужной реакции, защищающую группу удаляют омылением.
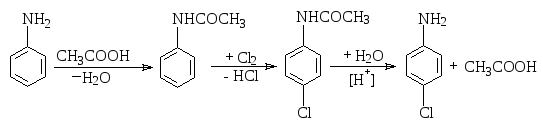
Подобная зашита необходима в случае получения монозамещенных продуктов, т.к. аминогруппа оказывает сильное активирующее действие.
