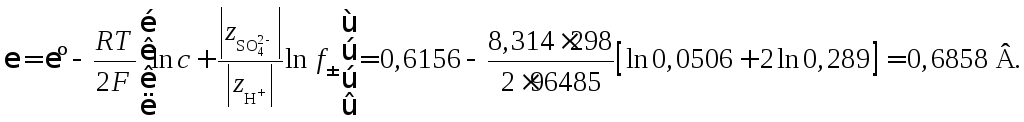- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
Электрохимическая система, представляющая собой опущенный в раствор электролита металл, называется электродом. Электроды являются конструкционными составляющими химических источников тока и электролизеров. На поверхности раздела «металл – электролит» протекают окислительные (анодные) или восстановительные (катодные) процессы. Важнейшей характеристикой таких процессов является электродный потенциал. Электродный потенциал – это Э.Д.С. гальванического элемента, составленного из стандартного водородного электрода (условно отрицательного и заданного электрода. Например, электродный потенциал кадмиевого электрода – это ЭДС цепи
![]() (8.1)
(8.1)
то есть разность потенциалов Cd и сопряженного с ним раствора, содержащего катион Cd2+, и стандартного водородного электрода.
Так как в цепях типа (8.1) левый электрод один и тот же, схему цепи записывают кратко
Cd2+|Cd.
Если активности реагентов равны единице
![]() ,
то электродный потенциал называется
стандартным. По определению электродного
потенциала потенциал стандартного
водородного электрода считается равным
нулю. Таблица стандартных электродных
потенциалов называется рядом напряжений.
Фрагмент ряда напряжений приведен в
приложении.
,
то электродный потенциал называется
стандартным. По определению электродного
потенциала потенциал стандартного
водородного электрода считается равным
нулю. Таблица стандартных электродных
потенциалов называется рядом напряжений.
Фрагмент ряда напряжений приведен в
приложении.
Зависимость равновесного электродного потенциала от температуры и активности реагентов определяется уравнением Нернста. Для процесса восстановления, протекающего на кадмиевом электроде цепи (8.1),
![]() (8.2)
(8.2)
уравнение Нернста при условии, что
![]() ,
имеет вид:
,
имеет вид:
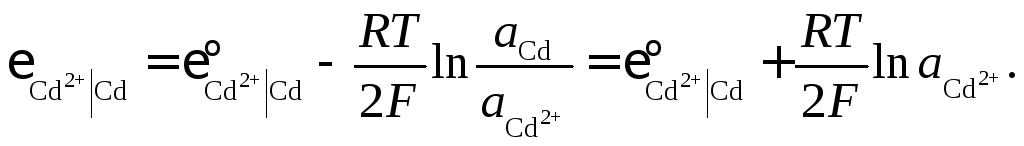 (8.3)
(8.3)
В общем случае
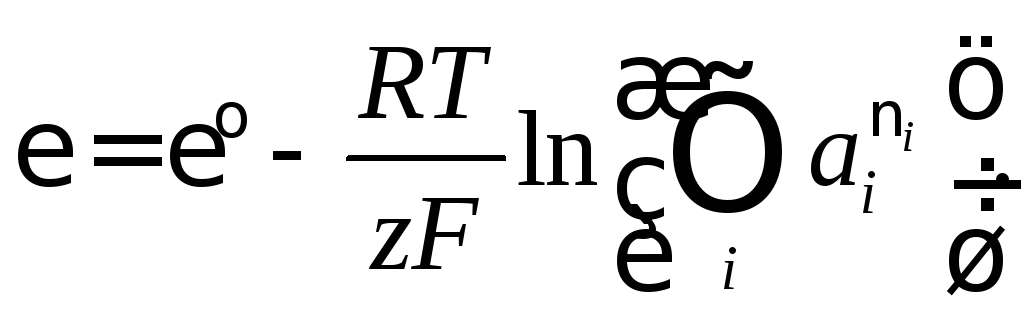 (8.4)
(8.4)
В уравнении (8.4) z–
число электронов в реакции восстановления,
а – соотношение активностей, по форме
аналогичное закону действующих масс
электродной реакции восстановления.
– соотношение активностей, по форме
аналогичное закону действующих масс
электродной реакции восстановления.
Электроды классифицируют по природе веществ, участвующих в электродном процессе. Электрод Mez+ | Me, обратимый относительно катиона, называется электродом первого рода. На таком электроде протекает электрохимический процесс
![]() , (8.5)
, (8.5)
потенциал которого
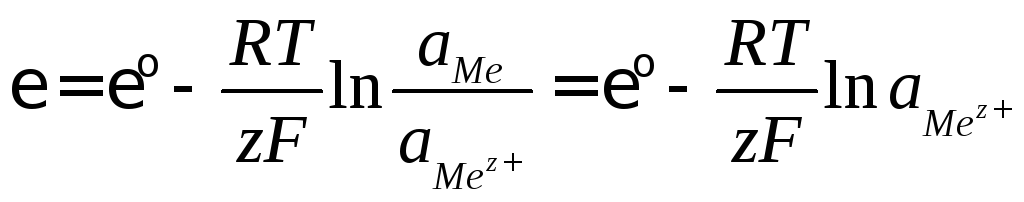 (8.6)
(8.6)
определяется природой металла и активностью ионов металла в растворе.
Электроды, обратимые относительно аниона, называются электродами второго рода. Например, хлорсеребряный электрод
Cl–AgClтв,Ag. (8.7)
Раствор такого электрода насыщен ионами Ag+труднорастворимой соли AgCl. Электродным процессом является реакция
![]() . (8.8)
. (8.8)
Потенциал электрода определяется активностью аниона Cl–:
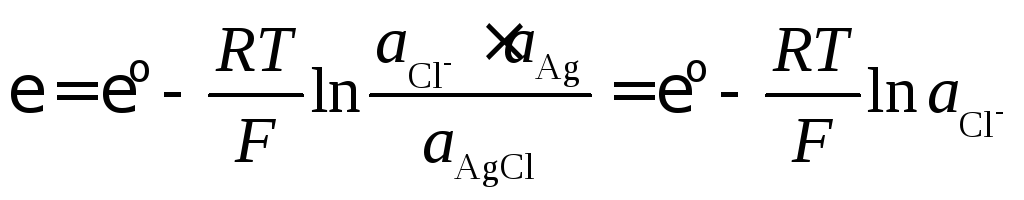 (8.9)
(8.9)
В процессе на окислительно-восстановительном электроде (редокс-электроде) участвуют находящиеся в растворе разновалентные ионы металла. Например, для электрода
Fe3+,Fe2+|Pt(8.10)
электродным процессом является реакция
![]() (8.11)
(8.11)
Источником электронов является инертный металл, погруженный в раствор электролитов. Потенциал электрода определяется отношением активностей ионов Fe3+и Fe2+в растворе:
 (8.12)
(8.12)
Если в электрохимическом прцессе участвует газ, то электрод называют газовым. Электродный потенциал такого электрода зависит не только от состава электролита, но и давления газа. Например, для водородного электрода H+| H2, Pt с процессом
![]() (8.13)
(8.13)
электродный потенциал
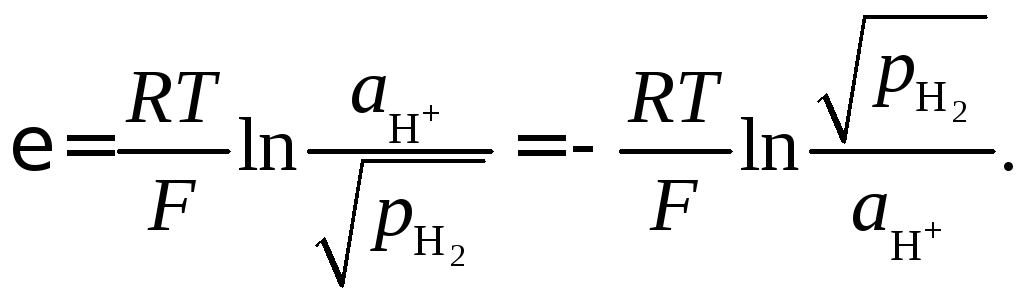 (8.14)
(8.14)
8.1.Примеры решения задач
Пример 44.Почему стандартный потенциал цинкового
электрода величина отрицательная (![]() )?
)?
Решение
Стандартный потенциал цинкового электрода – это ЭДС элемента
![]() ,
,
в котором цинковый электрод является условно положительным. При таком условии на электроде должна протекать реакция восстановления
![]()
а на стандартном водородном электроде – реакция окисления
![]() .
.
Таким образом, токообразующим процессом в таком элементе должна быть реакция восстановления цинка из раствора водородом
![]() .
.
Самопроизвольное протекание такой реакции невозможно. В действительности в этих условиях цинк восстанавливает водород, то есть потенциал цинкового электрода отрицательнее потенциала стандартного водородного электрода.
Пример 45.Напишите реакцию, которая протекает на
электроде![]() ,
и уравнение зависимости электродного
потенциала от активности иона
,
и уравнение зависимости электродного
потенциала от активности иона![]() .
.
Решение
На рассматриваемом электроде восстанавливается ртуть
![]()
Раствор насыщен ртутью и выделение
части ртути из раствора приведет к
растворению эквивалентного количества
труднорастворимой соли
![]() :
:
![]() .
.
Суммарная электродная реакция
![]() .
.
Используя уравнение Нернста, для электродного потенциала получаем
![]()
Здесь
![]() – стандартный электродный потенциал,
соответствующий активности
– стандартный электродный потенциал,
соответствующий активности![]() в растворе, равной единице.
в растворе, равной единице.
Пример 46.Рассчитайте стандартный электродный потенциал электрода I–| AgIтв,Agпри 286 К, если при этой температуре произведение растворимости иодида серебра 3,210–17(моль/л)2, а стандартный электродный потенциал серебряного электрода 0,944 В.
Решение
Потенциалообразующая реакция на указанном электроде
![]()
Согласно уравнению Нернста
![]() (а)
(а)
Электродный процесс можно представить совокупностью реакций
![]()
![]() .
.
Если потенциалообразующей считать реакцию восстановления серебра, то
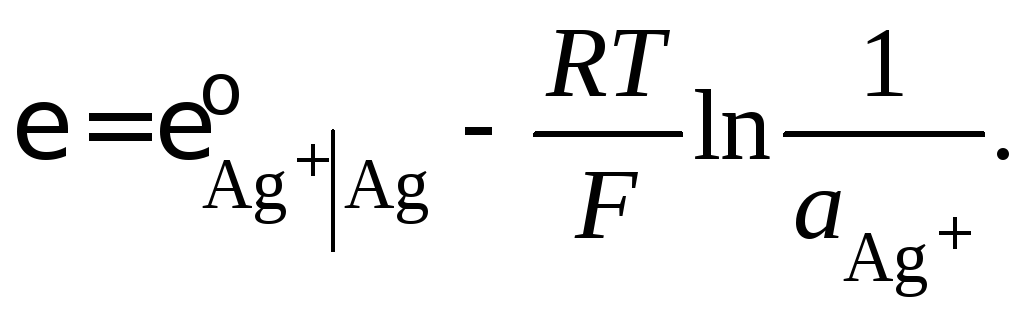 (в)
(в)
Так как электролит электрода является насыщенным раствором труднорастворимой соли AgI, то активность Ag+постоянна и связана с активностью иона I–в растворе соотношением
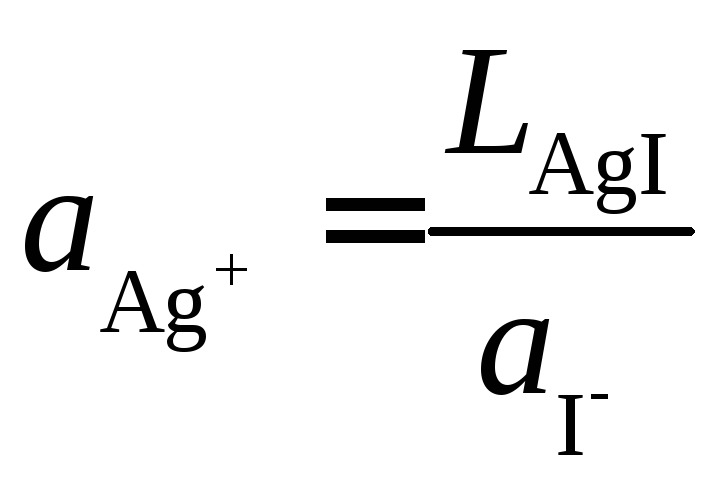 .
.
Здесь LAgI– произведение растворимости AgI. Подставляя это выражение в формулу (в), получим
![]() (с)
(с)
Из уравнений (а) и (с) следует
![]()
Пример 47. Рассчитать
электродный потенциал ртутно-сульфатного
электрода![]() при 298 К, если электролитом является
H2SO4с концентрацией 0,0506
моль/л, средний коэффициент активности
для которого 0,289. Стандартный потенциал
ртутно-сульфатного электрода 0,6156 В.
при 298 К, если электролитом является
H2SO4с концентрацией 0,0506
моль/л, средний коэффициент активности
для которого 0,289. Стандартный потенциал
ртутно-сульфатного электрода 0,6156 В.
Решение
На электроде происходит восстановление ртути по реакции
![]()
Согласно уравнению Нернста электродный потенциал
![]()
Активность иона
![]() (в предположении, что степень диссоциации
H2SO4
(в предположении, что степень диссоциации
H2SO4
![]() )
)
![]()
где с– концентрация H2SO4в растворе, моль/л. Коэффициент активности![]() определяется по величине среднего
коэффициента активности электролита
определяется по величине среднего
коэффициента активности электролита![]() из соотношений теории Дебая–Гюккеля:
из соотношений теории Дебая–Гюккеля:
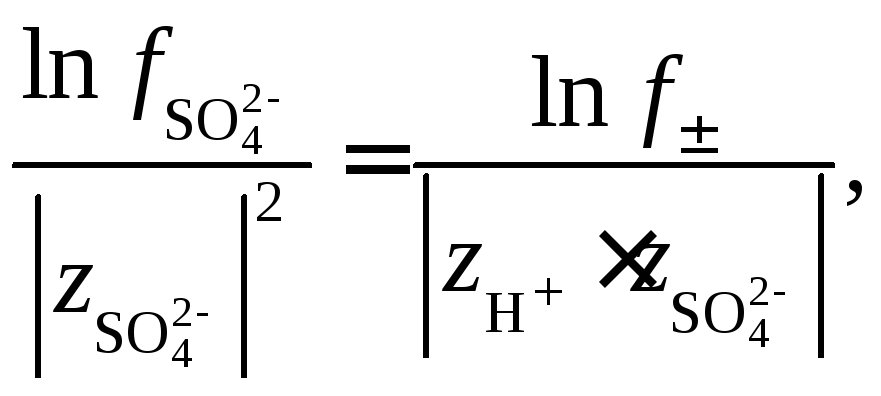

Таким образом,