
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
4.1. Примеры решения типовых задач
Пример18. Вычислить рН и степень гидролиза 0,2 М раствора ацетата натрияCH3COONa. Температура стандартная.
Решение
В разбавленном растворе считаем соль полностью диссоциированной. Ацетат-ион CH3COO-может взаимодействовать с ионамиH+, образующимися при диссоциации воды, с образованием слабого электролита – уксусной кислоты
CH3COO-+H+=CH3COOH. (4.1)
Так как ионы водорода образуются в результате диссоциации воды
H2O=H++OH-, (4.2)
то суммарную реакцию гидролиза следует записать так:
CH3COO-+H2O=CH3COOH+OH-. (4.3)
Из уравнения реакции видно, что гидролиз сводится к переходу протона H+от молекулы воды к аниону слабой кислоты. При этом концентрация ионовOH-увеличивается и среда становится щелочной. Такой процесс называется гидролизом по аниону.
Константа равновесия реакции (4.3)

В разбавленных растворах концентрацию
недиссоциированных молекул воды можно
считать постоянной. Обозначив
![]() ,
получаем
,
получаем
 (4.4)
(4.4)
где
![]() – константа гидролиза.
– константа гидролиза.
Умножаем правую часть равенства (4.4) на
дробь
![]() .
Тогда
.
Тогда

Произведение концентраций ионов водорода
и гидрооксид-ионов дает ионное произведение
воды
![]() ,
а дробь
,
а дробь является обратной величиной константы
диссоциации уксусной кислоты. Поэтому
константа гидролиза ацетата натрияCH3COONaпредставляет отношение двух констант,
значения которых известны из справочников:
является обратной величиной константы
диссоциации уксусной кислоты. Поэтому
константа гидролиза ацетата натрияCH3COONaпредставляет отношение двух констант,
значения которых известны из справочников:
 . (4.5)
. (4.5)
Чем меньше константа диссоциации кислоты (чем слабее кислота), тем больше константа гидролиза.
Степень гидролиза можно вычислить, зная константу гидролиза и молярную концентрацию соли. Введем обозначения:
|
|
CH3COO- |
+ H2O = |
CH3COOH |
+ OH- |
|
Начальное состояние |
|
|
|
|
|
Равновесное состояние |
|
|
|
|
 (4.6)
(4.6)
Если <<1, то
1 – 1 иКГ
![]() 2,
а
2,
а .
Тогда концентрация гидроксид-ионов
.
Тогда концентрация гидроксид-ионов .
Такой приближенный расчет с принятой
в химии погрешностью в 5% и менее
соответствует условию
.
Такой приближенный расчет с принятой
в химии погрешностью в 5% и менее
соответствует условию![]() ,
которое выполняется для данного раствора:
(0,2/5,410–10) >
100. Если же такое условие не выполняется,
для вычисления степени гидролиза следует
решить квадратное уравнение (4.6).
,
которое выполняется для данного раствора:
(0,2/5,410–10) >
100. Если же такое условие не выполняется,
для вычисления степени гидролиза следует
решить квадратное уравнение (4.6).
Водородный показатель раствора
![]()
Пример 19.Определить характер (основной или кислый) раствора, содержащего 0,1 мольNH4NO3в 1 л воды. Температура стандартная.
Решение
Соль образована кислотой HNO3и основаниемNH4ОН.
По табличным данным константы их
диссоциации соответственно равны![]() .
Следовательно, соль образована слабым
основанием и сильной кислотой. Поэтому
она гидролизуется по катиону
.
Следовательно, соль образована слабым
основанием и сильной кислотой. Поэтому
она гидролизуется по катиону![]() и среда должна быть кислой:
и среда должна быть кислой:
NH4+ + H2O = NH4OH + H+, (4.7)
NH4NO3+H2O=NH4OH+HNO3, (4.8)
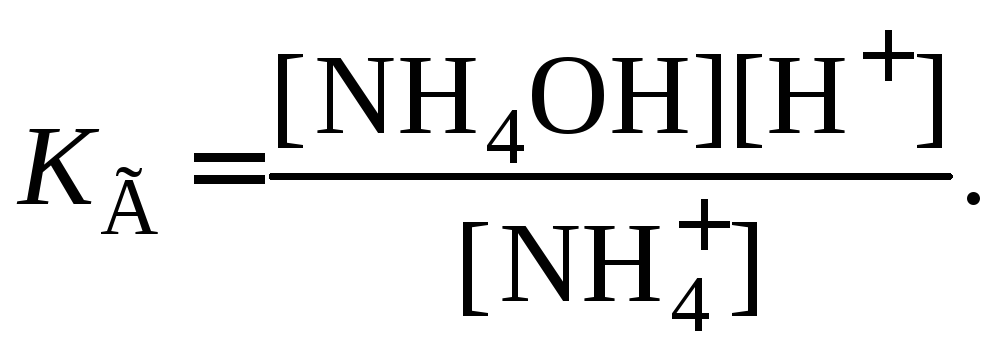 (4.9)
(4.9)
После выкладок, аналогичных проведенным в примере 1, формулу для вычисления константы гидролиза соли слабого основания и сильной кислоты можно представить следующим образом:
 . (4.10)
. (4.10)
Для нитрата аммония: КГ =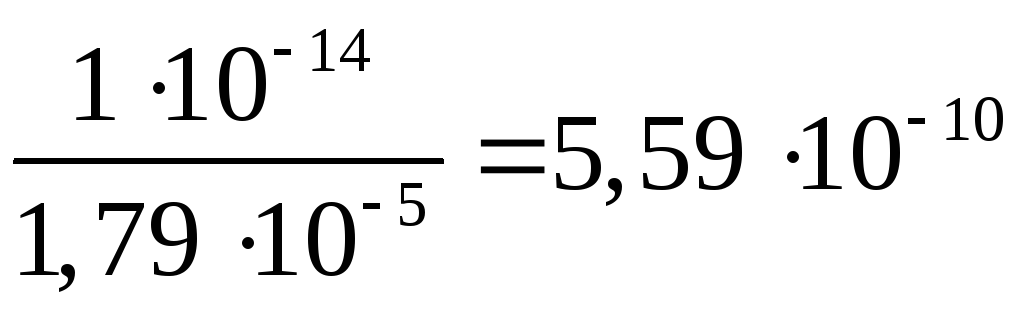 .
.
Из стехиометрических
коэффициентов уравнения реакции (4.7)
следует, что [NH4OH]
= [H+].
Концентрация ионов [NH4]
определяется начальной концентрацией
соли NH4NO3,
то есть
![]() = [NH4]
= 0,1 моль/л (в предположении полной
диссоциации соли).
= [NH4]
= 0,1 моль/л (в предположении полной
диссоциации соли).
Тогда 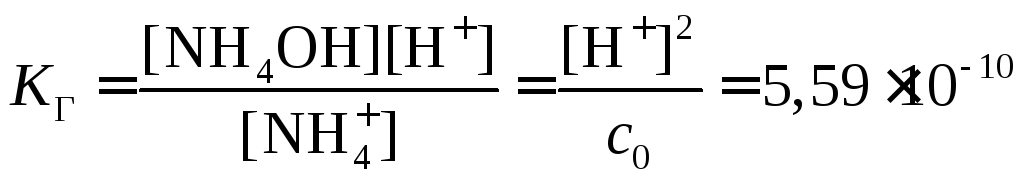 .
.
Получившаяся величина константы гидролиза реакции (4.7) одного порядка с КГреакции предыдущего примера. Поэтому вычисление концентрации[H+] возможно по выражению:
[H+] =![]() моль/л;
моль/л;
рН = –![]() = 5,13.
= 5,13.
Возможны также вычисления через степень гидролиза. В этом случае для характеристики гидролиза соли введем степень гидролиза . Тогда концентрации малодиссоциированных молекул основания и ионов в начальном (до гидролиза) и равновесном состояниях таковы:
|
|
NH4 |
+ H2O = |
NH4OH |
+ H+ |
|
Начальное состояние |
|
|
|
|
|
Равновесное состояние |
|
|
|
|
Константа гидролиза в этом случае определяется выражением
 .
.
Если <<1, то
1 – 1 иКГ
![]() 2,
а
2,
а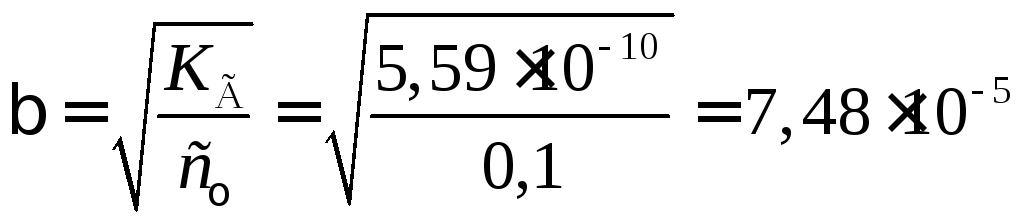 .
.
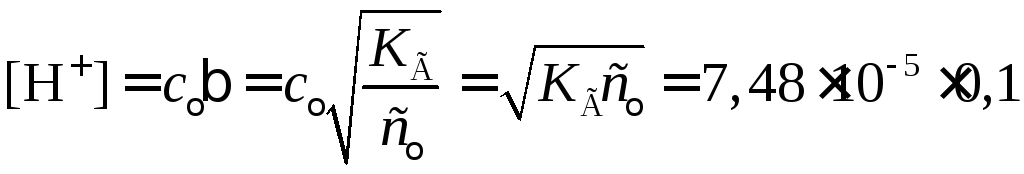 =
7,48106
моль/л.
=
7,48106
моль/л.
Как видно из результатов расчетов в примерах и , степени гидролиза солей слабого основания и сильной кислоты или слабой кислоты и сильного основания весьма малы (10–4…10–5). Существенно большей оказывается степень гидролиза по третьему варианту – для соли, образованной из слабого основания и слабой кислоты.
Пример 20. Вычислить степень гидролиза цианида аммонияNH4СN, концентрацию негидролизованной соли в 0,01 М водном раствореNH4СNи рН раствора на основе табличных данных о константах диссоциацииHCN,NH4OHи ионного произведения воды, соответственно равных 7,21010, 1,79105и 11014. Записать уравнения гидролиза в молекулярно-ионной и молекулярной формах.
Решение
Судя по величинамКД, солеобразующими компонентами являются слабое основание и слабая кислота. Поэтому гидролиз должен идти какпо катиону, так ипо аниону, а уравнения реакций гидролиза в ионно-молекулярной форме таковы:
NH4+H2O=NH4OH+H, (4.11)
CN+H2O=HCN+OH. (4.12)
Суммарная реакция с учетом реакции OH+H =H2O
|
|
NH4 |
+ CN |
+ H2O = |
NH4OH |
+ HCN. |
(4.13) |
|
получаем |
|
|
|
|
|
|
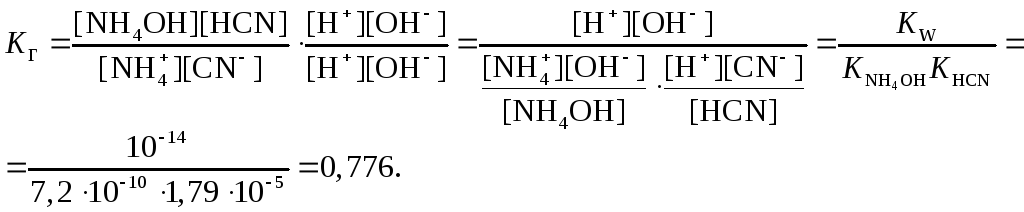 (4.14)
(4.14)С другой стороны,
 и
и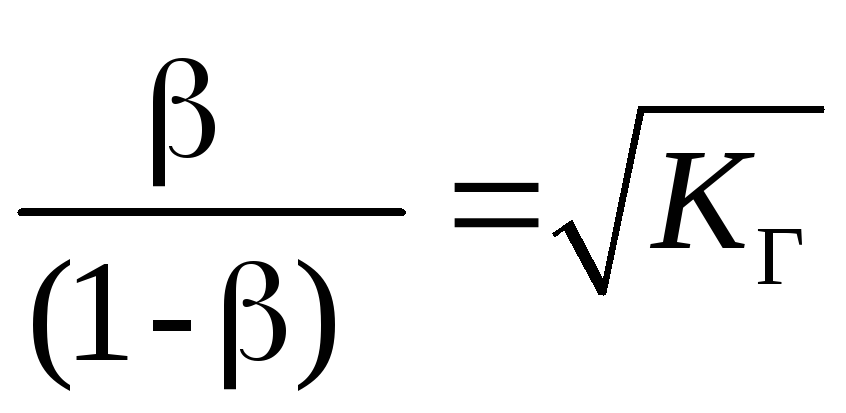 . (4.15)
. (4.15)
Тогда степень гидролиза
 (46,8%). (4.16)
(46,8%). (4.16)
Практически половина от исходного количества соли вступает во взаимодействие с водой. Гидролиз по катиону и гидролиз по аниону взаимно усиливают друг друга. Показателем этого является большая величина КГ.
Концентрация негидролизованной соли
с(1–) =0,01(1–0,468) = 5,3810–3моль/л.
Концентрацию ионов Hнаходим по уравнению:
 моль/л; (4.17)
моль/л; (4.17)
Тогда водородный показатель
рН = –lg[H] = 9,2.
Щелочной характер среды при гидролизе соли NH4CN можно объяснить существенно большим значением константы диссоциации основания NH4OH (1,7910–5) по сравнению с величиной константы диссоциации кислоты HCN (7,210–10).
Уравнение гидролиза в молекулярной форме
NH4CN+H2O=NH4OH+HCN. (4.18)
Соли, содержащие многозарядные (многовалентные) катионы или анионы, гидролизуются ступенчато. При обычных условиях взаимодействие таких солей с водой протекает лишь до образования основных или кислых солей, то есть осуществляется, как правило, только первая ступень гидролиза. Например, гидролиз азотнокислого цинка протекает с образованием основной соли (гидролиз по катиону):
Zn(NO3)2 + H2O = Zn(OH)NO3 + HNO3илиZn2 + H2O = ZnOH + H,(4.19)
а гидролиз соли Na2SO3 протекает с образованием кислой соли (гидролиз по аниону):
Na2SO3
+ H2O
= NaHSO3
+ NaOH или ![]() . (4.20)
. (4.20)
Пример 21. Вычислить степень гидролиза хлорида алюминияAlCl3в 0,1 М водном растворе. Определить рН раствора.
Решение
Соль образована трехвалентным катионом слабого основания Al(ОН)3и анионом сильной кислоты НCl. В соответствии с табличными данными по константам ступенчатой диссоциацииAl(ОН)3наименее диссоциированным (наиболее устойчивым) оказывается катион [Al(ОН)]2+, находящийся в равновесии с ионамиAl3+иOH, (равновесияIIIступени диссоциации):
[Al(ОН)]2+=Al3++OHКIII= 810-10<КII= 210-8.
Поэтому уравнение реакции гидролиза должно быть таким:
|
Al3+ |
+ H2O = |
[Al(ОН)]2+ |
+ H+ |
|
|
|
|
|
или AlCl3+ Н2О =AlОНCl2+ НCl.
Получаем для константы гидролиза
 .
.
Отношение
 ,
поэтому возможен расчет степени гидролиза
по выражению
,
поэтому возможен расчет степени гидролиза
по выражению
![]() .
.
Тогда

[H+] =![]() = 0,10,011 = 1,1103моль/л; рН = –lg[H+]
= –lg1,1103= 2,95.
= 0,10,011 = 1,1103моль/л; рН = –lg[H+]
= –lg1,1103= 2,95.
Следовательно, раствор AlCl3 имеет кислотный характер среды.
