
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
5.1. Примеры решения типовых задач
Пример 22.Вычислить растворимость СаСО3в воде при 25С.
Решение
Из уравнения диссоциации СаСО3в водном растворе
|
|
СаСО3(нас)= |
Са2++ |
СО32 |
|
равн. сост. |
– |
S |
S |
следует, что произведение растворимости СаСО3имеет вид:
![]()
По справочным данным при 298 К ПР = L= 4,8109(моль/л)2.
Тогда
растворимость
![]() моль/л,
что составляет
моль/л,
что составляет
S![]() =
6,93105100
= 6,93103
г/л = 6,93 мг/л.
=
6,93105100
= 6,93103
г/л = 6,93 мг/л.
Пример 23. Вычислить молярную растворимостьSи концентрацию ионов в насыщенном раствореAg3РO4(ПР = 1,310–20(моль/л)4).
Решение
Для четырехионного электролита, диссоциирующего по уравнению
|
|
Ag3РO4= |
3Ag++ |
|
|
равн. сост. |
|
S |
S |
произведение растворимости через растворимость выражается следующим образом:
ПР
= [Ag+]3[![]() ]
= (3S)3S
= 27S4.
]
= (3S)3S
= 27S4.
Тогда 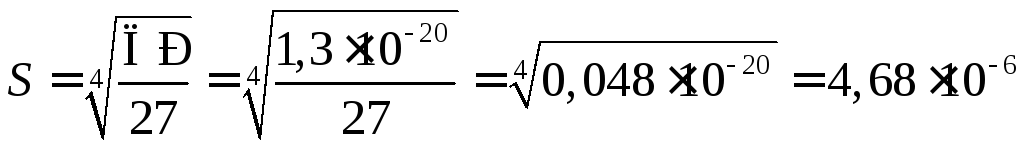 моль/л;
моль/л;
[![]() ]
= S =
]
= S =![]() моль/л;
моль/л;
[Ag+]
= 3S =
3![]() =
1,410–5
моль/л.
=
1,410–5
моль/л.
Пример 24.Произойдет ли осаждение малорастворимогоAgNO2(ПР=1,610–4(моль/л)2) образующегося по реакции
AgNO3 + КNO2 = AgNO2 + КNO3
после смешения равных объемов 0,02 М растворов AgNO3и КNO2?
Решение
После смешения равных объемов растворов AgNO3и КNO2общий объем раствора будет в 2 раза больше каждого из исходных и концентрации веществ соответственно уменьшатся в 2 раза и станут равными 0,01М. Произведение
![]()
меньше величины произведения растворимости AgNO2, поэтому образования осадка этой соли не произойдет.
Пример 25. Вычислить растворимость SrSO4. Во сколько раз уменьшится растворимость SrSO4 после добавления к 1 л насыщенного раствора этой соли 0,01 моль К2SO4? Степень диссоциации сернокислого калия считать равной единице.
Решение
Табличное значение
произведения растворимости сульфата
стронция
![]() .
Тогда растворимостьSrSO4
в воде
.
Тогда растворимостьSrSO4
в воде
![]() моль/л.
моль/л.
При добавлении 0,01 моля К2SO4 начальные и равновесные концентрации ионов выражаются следующим образом:
|
SrSO4 = |
Sr2+ + |
SO42. |
|
|
S |
|
0,01 |
– без учета диссоциации SrSO4 |
|
S |
S |
0,01+S |
– равновесное состояние |
Тогда
L
= (0,01 + S)S
0,01 S
= 3,2107,
в допущение 0,01 + S
0,01
моль/л. Отсюда
S
= 3,2105
моль/л. Таким образом, растворимость
SrSO4
в 0,01 М растворе К2SO4
меньше растворимости SrSO4
в воде в
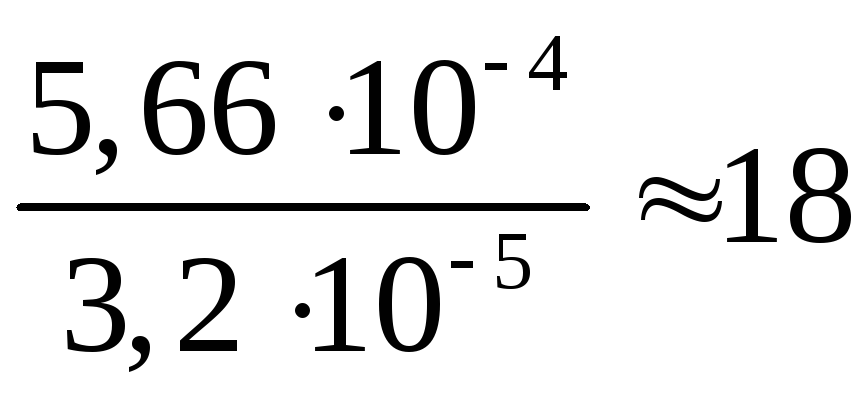 раз.
раз.
Замечание. Вышеприведенные примеры решены в предположении, что активность ионов равна их концентрации. Такое упрощение расчетов не приводит к заметным ошибкам для бинарных растворов «вода – труднорастворимая соль», которые сильно разбавлены. Однако, для растворов, содержащих кроме труднорастворимой соли сильный хорошо растворимый электролит, такое упрощение может оказаться недопустимым, особенно при заметных концентрациях. Примеры точных расчетов растворимости и произведения растворимости с использованием активностей приведены в главе 2.
5.2. Задачи для самостоятельного решения
70. Насыщенный раствор СаС2О4 при 18С содержит 5,1105 моля соли в 1 л раствора. Вычислить произведение растворимости.
Ответ: 2,6109 (моль/л)2.
71. Растворимость Со(ОН)2 при 18 С равна 4,6106 моль/л. Вычислить произведение растворимости основания.
Ответ: 3,91016 (моль/л)3.
72. Сколько серебра находится в виде ионов в 3л насыщенного раствора AgBr?
Ответ: 0,25 мг.
73. В 160 мл насыщенного раствора PbI2 содержится 0,0268 г свинца в виде ионов. Вычислить произведение растворимости PbI2.
Ответ: 2,1109 (моль/л)3.
74. В каком объеме насыщенного раствора СаСO3 содержится 1 г соли?
Ответ: 144,3 л.
75. В 6 л насыщенного раствора PbSO4 содержится в виде ионов 0,186 г свинца. Вычислить произведение растворимости PbSO4.
Ответ: 2,2108 (моль/л)2.
76. В каком объеме насыщенного раствора Ag2SO4 содержится 324 мг серебра?
Ответ: 0,19 л.
77. Во сколько раз растворимость (моль/л) Fe(ОН)2 в воде больше растворимости Fe(ОН)3 в воде при 25 С?
Ответ: 32520.
78. Вычислить растворимость (моль/л и г/л) СаF2 в воде и в 0,05 М растворе СаCl2. Во сколько раз изменилась растворимость фторида кальция и в какую сторону?
Ответ: 2,15104; 1,4105 моль/л; 0,017, 0,0011 г/л; 15,4.
79. Выпадает ли осадок РbCl2, если смешаны 1 мл 0,2 М раствора Pb(NO3)2 и 2 мл 0,01 М раствора NaCl?
Ответ: нет.
80. Вычислить растворимость AgIO3 в воде и в 0,1 М растворе NaIO3.
Ответ: 1,7104; 3107 моль/л.
81. Вычислить растворимость BaSO4 в воде и в 0,05 М растворе MgSO4.
Ответ: 1,05105; 2,2109 моль/л.
82. Сравнить концентрации ионов Са2+ в водном растворе СаСО3 и в водном растворе СаСО3 с осадителем Na2СО3, добавленным в раствор до концентрации 0,1 моль/л.
Ответ: различаются в 1440 раз.
83. Выпадет ли в осадок соль CаSO4, если к 100 мл 0,01 М раствора Са(NO3)2 прибавлено 400 мл 0,001 н раствора Н2SO4?
Ответ: нет.
84. Образуется ли осадок Fe(ОН)3, если к 1 л 0,006 н. раствора FeCl3 прибавить 0,125 л 0,0001 н раствора КОН? Вычислить растворимость (моль/л) Fe(ОН)3 в воде.
Ответ: да; 7,11010 моль/л.
85. Выпадет ли осадок Ag2Cr2O7 при смешении равных объемов 0,05 н растворов AgNO3 и K2Cr2O7?
Ответ: да.
86. Какова должна быть минимальная концентрация KBr, чтобы прибавление его к раствору равного объема 0.003 н. AgNO3 вызвало появление осадка?
Ответ: 1,941010 моль/л.
87. Насыщенный раствор Ag2Cr2O7, объем которого 5 л, содержит 0,5 моля Na2Cr2O7. Найдите концентрацию ионов Ag+ в данном растворе.
Ответ: 1,4103 моль/л.
88. В насыщенном растворе AgIO3 объемом 3 л содержится в виде ионов 56 мг серебра. Вычислить произведение растворимости AgIO3.
Ответ: 3108 (моль/л)2.
