
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
1.1. Примеры решения задач
Пример 1. Вычислить при 20С осмотическое давление водного раствора, в 6 л которого содержится 62,4 г кристаллогидратаCuSO45H2O. Кажущаяся степень диссоциации соли в растворе равна 40%.
Решение
Односторонняя диффузия молекул растворителя через полупроницаемую перегородку (ППП) называется осмосом (рис. 1). Полупроницаемая перегородка обладает свойством пропускать только молекулы растворителя. Осмос впервые обнаружил и наблюдал в эксперименте французский химик Ж. Ноле (1748 г.), впервые измерил немецкий физиолог В. Пфеффер (1877 г.), а уравнение
![]() (1.12)
(1.12)
для растворов неэлектролитов получено Я. Вант-Гоффом в 1886 году. Позднее получено точное уравнение для осмотического давления
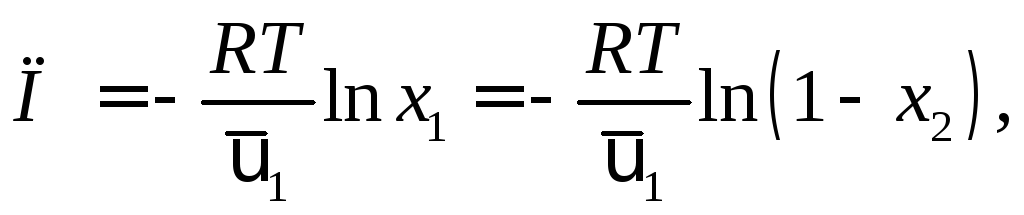 (1.13)
(1.13)
где x2– молярная
доля растворенного вещества;![]() – парциальный молярный объем растворителя
в равновесном растворе. Уравнение (1.13)
преобразуется в формулу Вант-Гоффа для
разбавленных растворов.
– парциальный молярный объем растворителя
в равновесном растворе. Уравнение (1.13)
преобразуется в формулу Вант-Гоффа для
разбавленных растворов.

Рис. 1. Диффузионные потоки при убранной перегородке и через полупроницаемую перегородку
В рассматриваемом растворе концентрация электролита
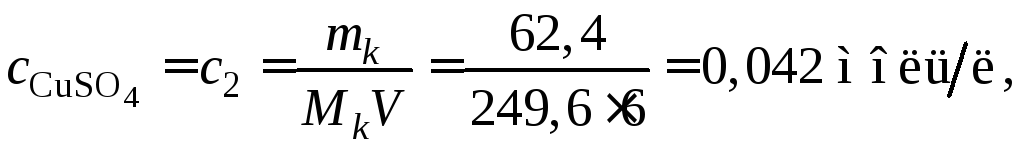
так как одна молекула кристаллогидрата содержит одну молекулу безводной соли CuSO4. ЗдесьmkиMk– масса и молекулярная масса кристаллогидрата;V– объем раствора. Изотонический коэффициент
![]()
Тогда осмотическое давление
![]()

Рис. 2. Схема, иллюстрирующая появления осмотического давления:
1 – чистый растворитель; с2– равновесная концентрация растворенного вещества
Пример 2. Давление пара над раствором, содержащим 67 г солиCa(NO3)2в 1000 г воды, при 100С равно 747 мм рт.ст. При какой температуре этот раствор закипит под нормальным давлением? Рассчитать нормальную температуру замерзания раствора. Какова кажущаяся степень диссоциации соли? Эбулиоскопическая и криоскопическая константы воды 0,52 и 1,86 Ккг/моль.
Решение
При 100 С упругость паров чистой воды 760 мм рт.ст., поэтому из закона Рауля (1.8) следует (молекулярная масса солиM2=164,1 г/моль)

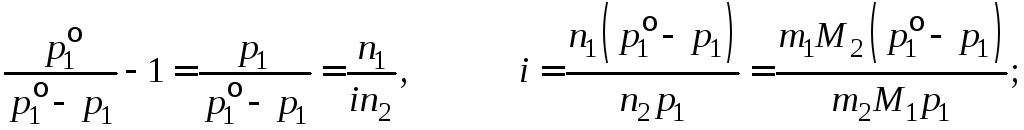

Для азотнокислого кальция Ca(NO3)2число ионов, получающихся при диссоциации молекулы,=3. Поэтому степень диссоциации этого электролита при 100С по уравнению (1.7)
![]() или 68,4%.
или 68,4%.
Нормальные температуры кипения раствора и замерзания из-за отсутствия информации о влиянии температуры на степень диссоциации могут быть вычислены с некоторой ошибкой. Эта ошибка весьма мала для температуры кипения, но может быть заметной для температуры замерзания. Получим согласно формулам (1.9) и (1.10)

Пример 3. Пользуясь табличными данными, вычислить при температуре 25С степень диссоциации цианистоводородной кислотыHCN(цианистый водород, синильная кислота) и концентрации образующихся при диссоциации ионов в 0,001 М растворе.
Решение
Согласно справочным данным (см. табл. приложения) константа диссоциации HCNравна при 25С 7,21010моль/л. Кислота является бинарным одно-однозарядным электролитом,

поэтому

Так как синильная кислота слабый
электролит (![]() <<1),
то степень диссоциации величина небольшая
(<<1) даже в
разбавленных растворах. Поэтому
<<1),
то степень диссоциации величина небольшая
(<<1) даже в
разбавленных растворах. Поэтому
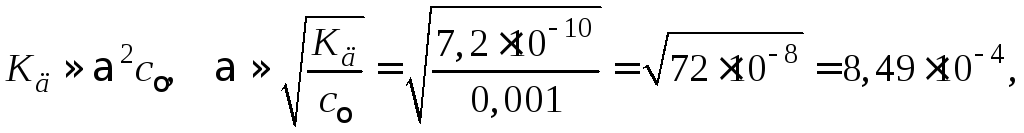
то есть степень диссоциации меньше 0,1% (0,0849%). Концентрация образующихся при диссоциации ионов
![]()
Замечания.
Точное решение квадратного уравнения
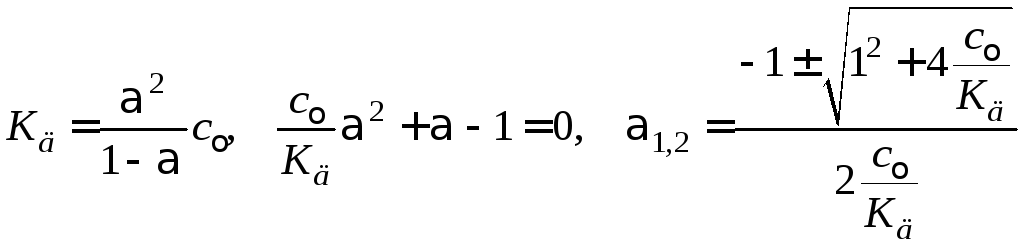 (1.14)
(1.14)
с учетом того, что отрицательное значение корня не имеет физического смысла, приводит к результату
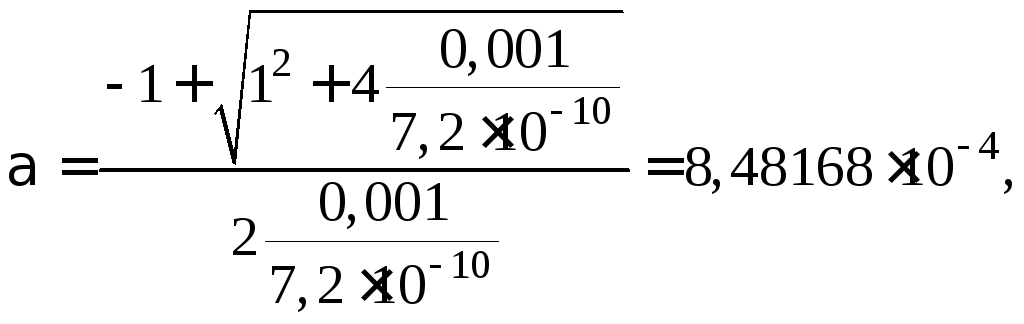
Расхождение этой цифры с величиной, полученной по приближенному уравнению

весьма незначительно и оправдывает использование такого приближенного уравнения.
Как видно из уравнения
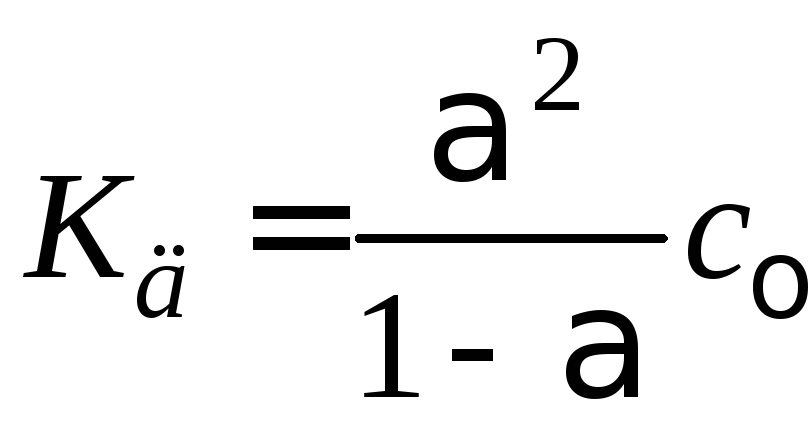
степень диссоциации при заданной
температуре зависит от концентрации
раствора и, согласно закону разбавления
Оствальда, для любых электролитов при
![]() ,
то есть для сильно разбавленных растворов
для слабых электролитов нельзя
пользоваться приближенным уравнением
,
то есть для сильно разбавленных растворов
для слабых электролитов нельзя
пользоваться приближенным уравнением![]() .
Поэтому возможность использования
приближенного уравнения рекомендуется
оценивать по неравенству
.
Поэтому возможность использования
приближенного уравнения рекомендуется
оценивать по неравенству ,
см. уравнение (1.14). В нашем примере это
неравенство выполняется:
,
см. уравнение (1.14). В нашем примере это
неравенство выполняется:
Пример 4. Рассчитать степень диссоциации уксусной кислотыCH3COOHи концентрацию ионов водорода в растворе с концентрацией 0,005 моль/л. Как изменится степень диссоциации кислоты и концентрация ионов водорода, если к 3 литрам такого раствора добавить 9 г уксуснокислого натрияCH3COONa? Соль считать полностью диссоциированной. Температура 25С.
Решение
Для бинарного раствора H2O–CH3COOHпроцесс диссоциации
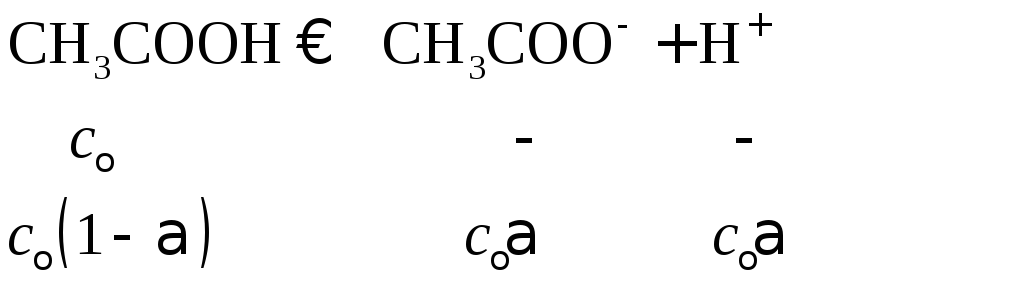
описывается уравнением

По справочным данным (см. приложение)
для уксусной кислоты
![]() .
Так как отношение (см. пример 3)
.
Так как отношение (см. пример 3)
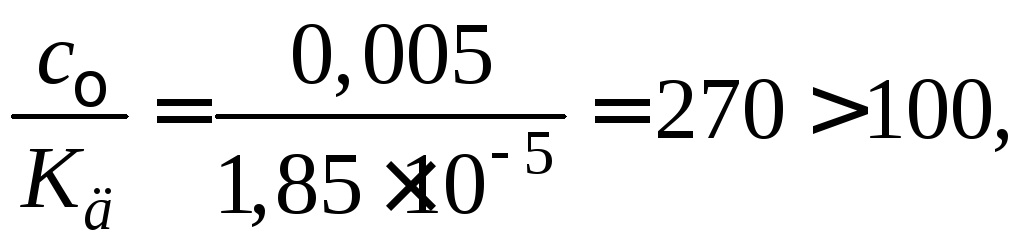
можно степень диссоциации рассчитать по приближенному уравнению
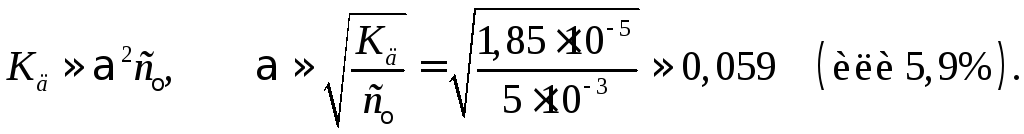
Тогда концентрация ионов водорода в бинарном растворе
![]()
В тройном растворе H2O–CH3COOH–CH3COONaконцентрация соли

поэтому с учетом полной диссоциации «вклад» соли в общую концентрацию анионов CH3COO–составляет
![]()
Процесс диссоциации кислоты в тройном растворе

описывается уравнением
 (1.15)
(1.15)
Точное решение квадратичного уравнения
![]()
дает для степени диссоциации кислоты в тройном растворе
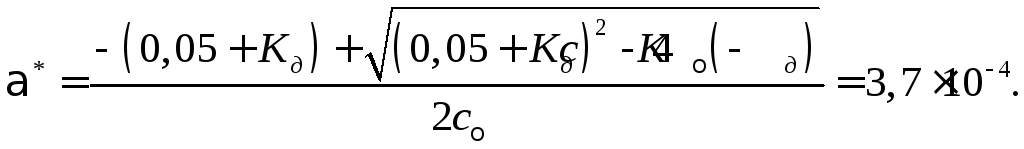
Концентрация ионов водорода в тройном растворе
![]()
Таким образом, степень диссоциации кислоты и концентрация ионов водорода в тройном растворе уменьшились в 160 раз
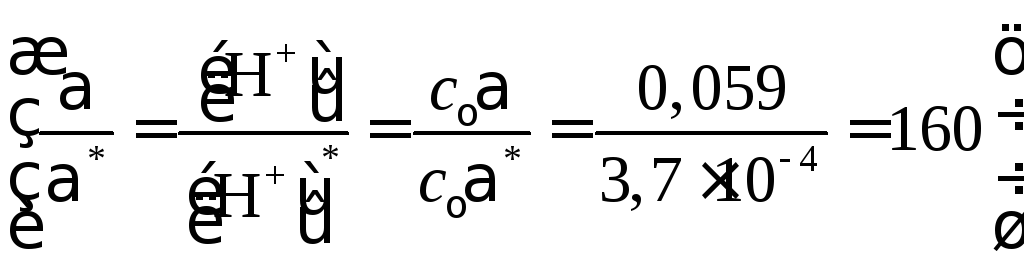
по сравнению с бинарным раствором.
Замечание. Если учесть, что в уравнении
(1.15)![]() и*<<1, можно
вместо точного расчета вычислить*по приближенному уравнению
и*<<1, можно
вместо точного расчета вычислить*по приближенному уравнению
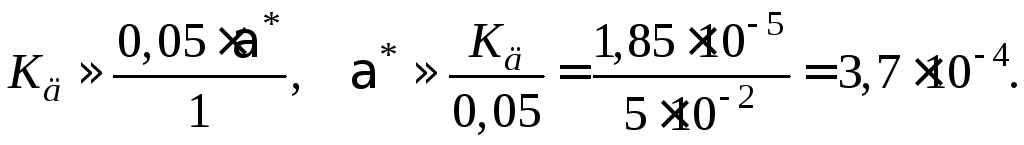
Пример 5. Рассчитать концентрацию
ионов![]() и
и![]() в водном растворе фосфорной кислотыH3PO4с концентрацией 0,1 моль/л при 25С.
в водном растворе фосфорной кислотыH3PO4с концентрацией 0,1 моль/л при 25С.
Решение
По справочным данным ступенчатая диссоциация фосфорной кислоты описывается следующими уравнениями и константами диссоциации:
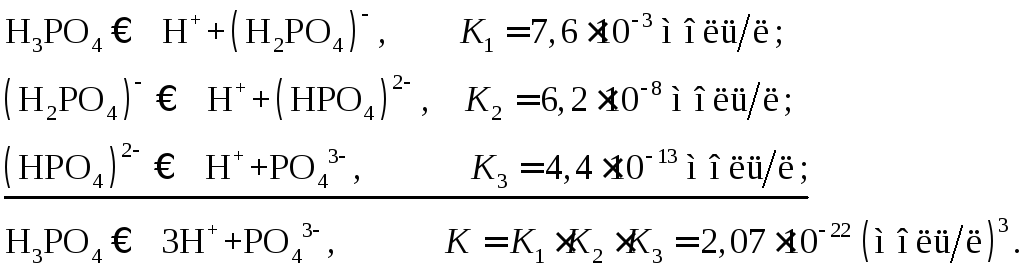
Концентрация ионов водорода в растворе определяется «вкладами» каждой ступени диссоциации
![]()
но из-за большой разницы констант диссоциации
![]()
можно считать
![]() .
Поэтому получим
.
Поэтому получим
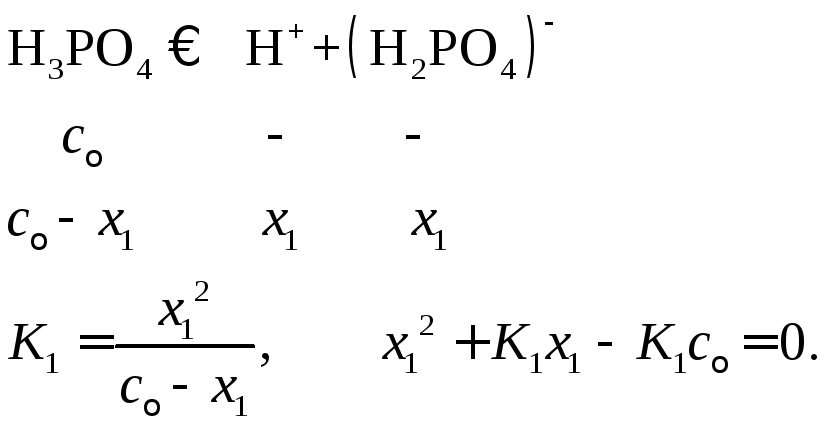
Здесь x– числа молей ионов, образующихся при диссоциации, в расчете на 1 литр раствора. Так как в рассматриваемом примере

необходимо решать квадратное уравнение
![]()
Получим
![]()
Для определения концентрации ионов
![]() необходимо решить систему трех уравнений
(с учетомx2<<x1,x3<<x2):
необходимо решить систему трех уравнений
(с учетомx2<<x1,x3<<x2):
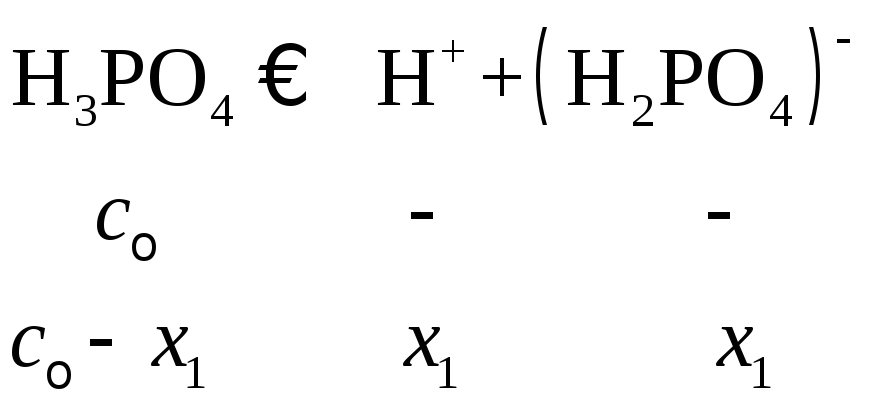
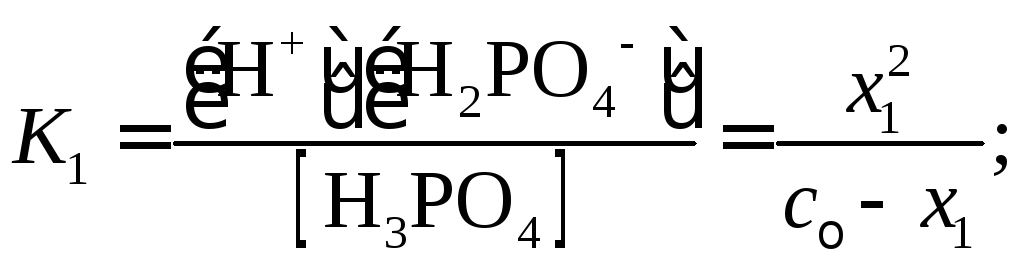

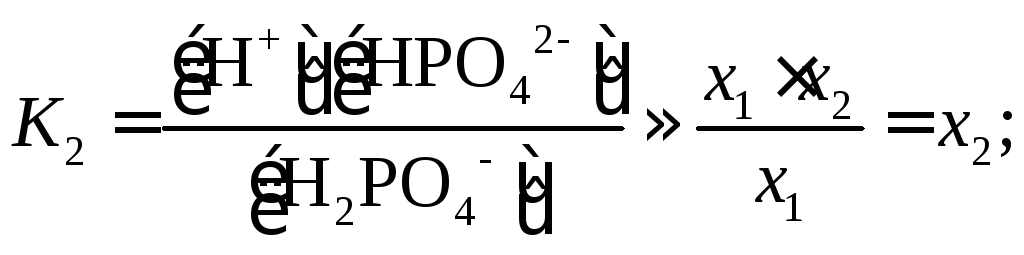
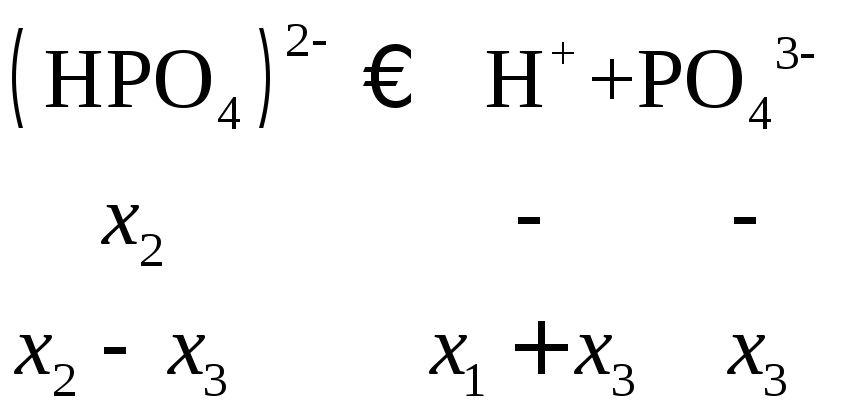
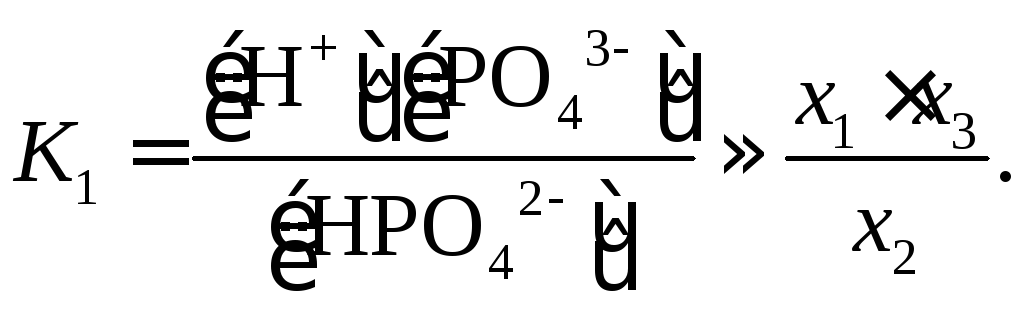
Величина x1нами уже вычислена:x1=2,410–2. Величинаx2K2=6,210–8моль/л. Наконец,
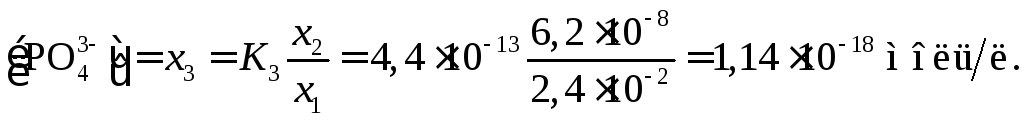
Замечание. Если не учитывать ступенчатую диссоциацию и рассчитать равновесие суммарной реакции, получим ошибочные результаты. Действительно, учитывая соотношение (x<<c), получим



Такой расчет дает концентрацию ионов
водорода на 4 порядка меньше, а
концентрация ионов![]() на 11 порядковбольшеистинной
величины.
на 11 порядковбольшеистинной
величины.
