
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
2. Растворы сильных электролитов. Активность электролитов
Согласно теории Аррениуса в любых растворах электролитов происходит электролитическая диссоциация, необходимым условием которой является наличие в растворяемом веществе ионных или полярных связей, а также достаточная полярность самого растворителя, которая оценивается величиной диэлектрической проницаемости . Вода имеет высокую диэлектрическую проницаемость (=81), что делает ее сильным ионизирующим растворителем.
Количественно процесс электролитической диссоциации оценивается двумя величинами: степенью диссоциации и константой диссоциацииKд.
Степенью диссоциации называют долю диссоциированных на ионы молекул. Степень диссоциации зависит от природы растворенного вещества и от концентрации раствора, увеличиваясь с его разбавлением. По значению для растворов молярной концентрации эквивалента 0,1 моль/л электролиты условно делят на три группы: сильные (>30%), средние (=3–30%) и слабые (<3%).
Экспериментально определяемая степень диссоциации сильных электролитов оказывается меньше истинной, поэтому ее называют кажущейся. Заниженность результатов измерений объясняется уменьшением подвижности ионов из-за наличия вокруг каждого из них ионной атмосферы, образованной противоположно заряженными ионами. Такая частичная связанность ионов как бы снижает их концентрацию, а некоторая фиктивная концентрация, определяющая свойства раствора, называется активной концентрацией или просто активностью а. Численно активность равна истинной, аналитически определяемой концентрации, умноженной на коэффициент активности.
В теории сильных электролитов приняты два способа определения активности (и коэффициента активности):
![]() (2.1)
(2.1)
где
![]() и
и![]() – разные обозначения моляльной
концентрации электролита, моль/1000 г
растворителя;
– разные обозначения моляльной
концентрации электролита, моль/1000 г
растворителя;
![]() (2.2)
(2.2)
где
![]() – молярность раствора, моль/л.
– молярность раствора, моль/л.
Коэффициенты активности иfопределяют степень отклонения реальных растворов электролитов от поведения идеальных растворов, что зависит от энергии электростатического взаимодействия заряженных частиц (ионов) в растворе. Для бесконечно разбавленных растворов эта энергия практически равна нулю и поэтому

Это обстоятельство позволяет установить соотношение между определенными разными способами коэффициентами активности.
Возьмем 1 л раствора с концентрацией
![]() ,
моль/л. Тогда моляльность этого раствора
,
моль/л. Тогда моляльность этого раствора
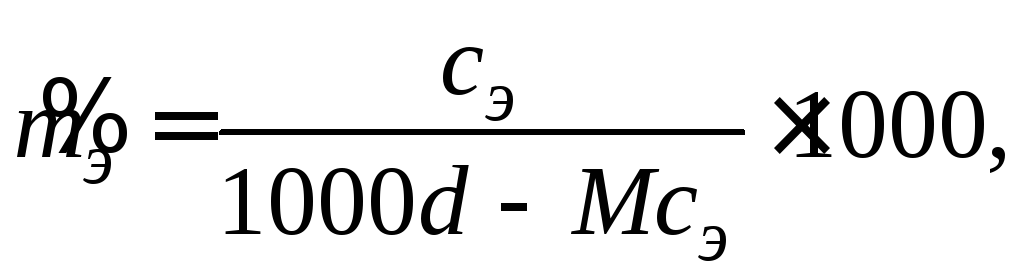 (2.3)
(2.3)
где d– плотность раствора, г/см3;M– молярная масса электролита, г/моль. После простых преобразований уравнения (2.3) получим соотношение
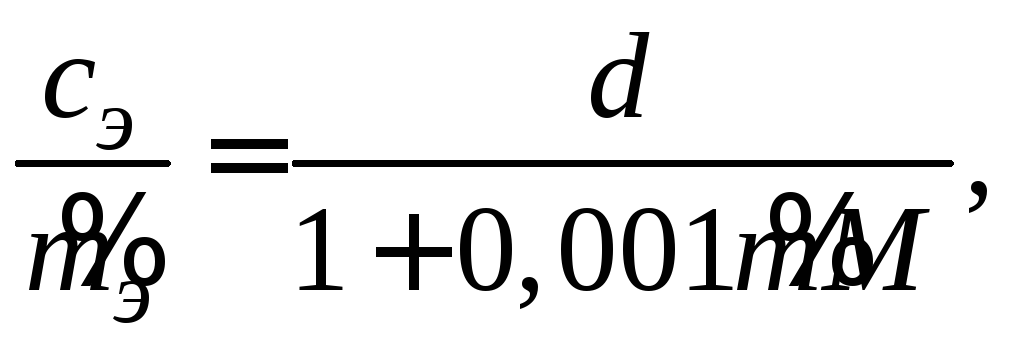 (2.4)
(2.4)
из которого следует, что лишь для
разбавленных растворов
![]() это соотношение
это соотношение
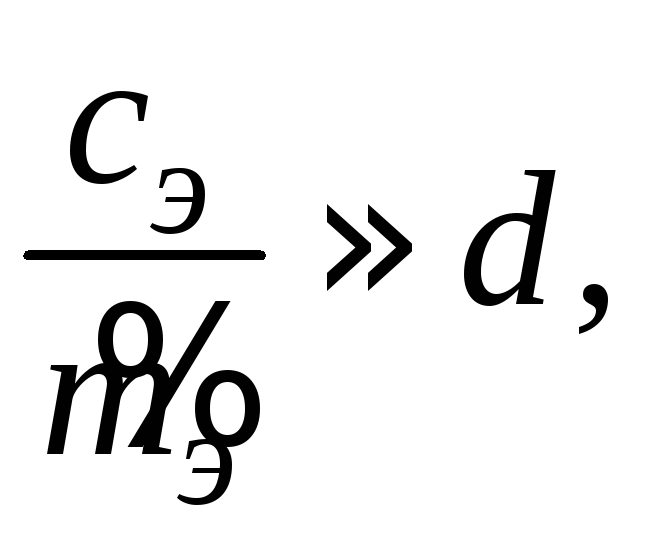
а для бесконечно разбавленных растворов (ddo)
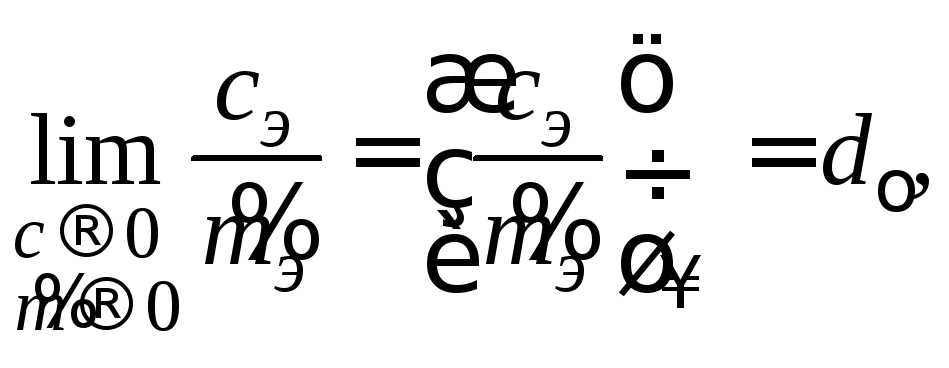
где
![]() – плотность растворителя (для воды
– плотность растворителя (для воды![]() =1
г/см3). Отношение активностей,
определенных относительно разных
стандартных состояний, есть величина
постоянная, независящая от концентрации.
Поэтому
=1
г/см3). Отношение активностей,
определенных относительно разных
стандартных состояний, есть величина
постоянная, независящая от концентрации.
Поэтому
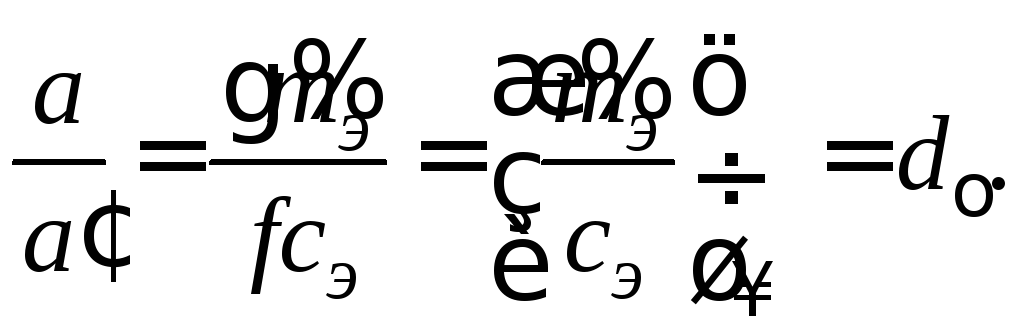 (2.5)
(2.5)
Отсюда следует
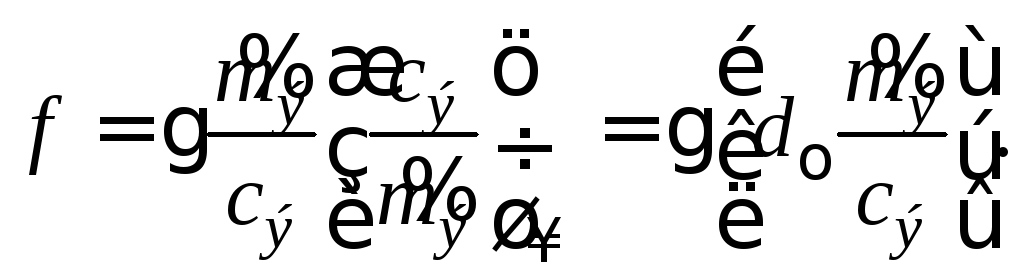
После подстановки
в последнее уравнение величины
![]() из формулы (2.4) получаем
из формулы (2.4) получаем
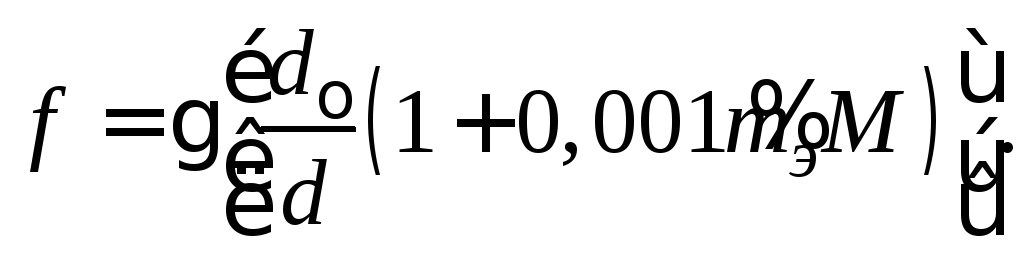 (2.6)
(2.6)
В этой формуле выражение в квадратных скобках мало отличается от единицы, поэтому в приближенных практических расчетах даже концентрированных растворов часто коэффициенты активности считаются равными. Поэтому активности, определяемые формулами (2.1) и (2.2), отличаются размерностями, а различие их численных значений определяется различиями молярности и моляльности раствора. В справочной литературе, тем не менее, приводятся величины коэффициентов активности . Это определяется тем обстоятельством, что, строго говоря, свойства любых растворов следует определять в зависимости от соотношения числа частиц компонентов.
Активность электролита можно выразить через активности ионов, используя условие ионного равновесия
![]()
![]() (2.7)
(2.7)
Активности ионов
![]() (частный случай
(частный случай![]() ),
),
![]() (частный случай
(частный случай![]() ). (2.8)
). (2.8)
Однако, определить активности (коэффициенты
активности) ионов опытным путем
невозможно, поэтому введены понятия
среднего ионного стехиометрического
коэффициента
![]() ,
средних ионного коэффициента активности
,
средних ионного коэффициента активности![]() и активности
и активности![]() ,
которые и определяются экспериментально.
Между этими величинами и характеристиками
ионов существуют следующие соотношения:
,
которые и определяются экспериментально.
Между этими величинами и характеристиками
ионов существуют следующие соотношения:
![]() (2.9)
(2.9)
где
![]() определяет число ионов, образующихся
при диссоциации молекулы электролита.
Из соотношений (2.7)–(2.9) следует
определяет число ионов, образующихся
при диссоциации молекулы электролита.
Из соотношений (2.7)–(2.9) следует
![]() (2.10)
(2.10)
Например, для водного раствора NaCl
![]()
для водного раствора CaCl2
![]()
В многокомпонентных растворах активности ионов зависят не только от их концентраций, но и от концентраций других ионов, присутствующих в растворе. Суммарное влияние ионов на активность каждого из них в растворе выражается с помощью ионной силы раствора, которая является мерой электростатического взаимодействия между всеми ионами, находящимися в растворе. Ионная сила раствора Iравна полусумме произведений концентрации каждого иона данного раствора на квадрат его заряда:
![]() (2.11)
(2.11)
Для бинарных растворов ионная сила раствора связана с концентрацией электролита простыми соотношениями, приведенными в табл. 2.1.
Таблица 2.1
Ионные силы бинарных растворов
![]()
|
Тип электролита |
Ионная сила (=1) |
|
К+А–(NaCl, NaNO3, HCl) |
|
|
К2+А2–(CuSO4,ZnSO4) |
|
|
|
|
|
|
|
|
|
|
Эту таблицу можно использовать при вычислениях ионной силы многокомпонентного раствора, считая ее аддитивной. Например, ионную силу раствора, содержащего 0,005 моль/л CuSO4и 0,01 моль/л Al(NO3)3в предположении полной диссоциации солей (=1)
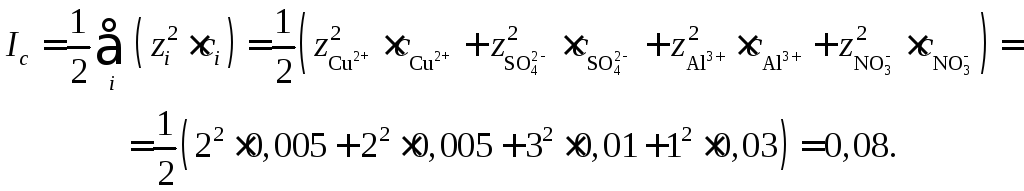
Используя таблицу, получим:
![]()
Для растворов электролитов с ионной силой I<0,02 коэффициенты активности ионов можно определить по уравнению Дебая и Гюккеля
![]() (2.12)
(2.12)
С учетом соотношений (2.9) из уравнений (2.12) можно получить формулы для расчета средних коэффициентов активности
![]() (2.13)
(2.13)
Постоянный множитель Азависит от температуры и природы растворителя. Для воды при 25СА=0,509.
Значения коэффициентов активности ионов в зависимости от величины ионной силы раствора приведены в табл. 2.2.
Таблица 2.2
Коэффициенты активности ионов в водных растворах в зависимости от ионной силы раствора и заряда иона
|
Заряд иона z |
Ионная сила раствора, I | |||||||||
|
0,0001 |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
0,05 |
0,1 |
0,2 |
0,5 | |
|
1 |
0,988 |
0,96 |
0,95 |
0,92 |
0,89 |
0,87 |
0,81 |
0,78 |
0,70 |
0,62 |
|
2 |
0,954 |
0,86 |
0,81 |
0,72 |
0,63 |
0,57 |
0,44 |
0,33 |
0,24 |
— |
|
3 |
0,900 |
0,73 |
0,64 |
0,51 |
0,39 |
0,28 |
0,15 |
0,08 |
0,04 |
— |
|
4 |
0,830 |
0,56 |
0,45 |
0,30 |
0,19 |
0,12 |
0,04 |
0,01 |
0,003 |
— |
В разбавленных
водных растворах электролитов, когда
ионная сила
![]() ,
коэффициент активности ионов принимается
равным единице и
,
коэффициент активности ионов принимается
равным единице и![]() или
или![]() .
.
