
- •1. Теория электролитической диссоциации
- •1.1. Примеры решения задач
- •2. Растворы сильных электролитов. Активность электролитов
- •2.1. Примеры решения задач
- •2.2. Задачи для самостоятельного решения
- •3. Ионное произведение воды. Водородный показатель
- •3.1. Примеры решения задач
- •3.2. Задачи для самостоятельного решения
- •4. Растворы солей в воде и их гидролиз
- •4.1. Примеры решения типовых задач
- •4.2. Задачи для самостоятельного решения
- •5. Труднорастворимые соли. Произведение растворимости
- •5.1. Примеры решения типовых задач
- •5.2. Задачи для самостоятельного решения
- •6. Окислительно-восстановительные реакции
- •6.1. Определение коэффициентов уравнений окислительно-восстановительных реакций методом электронного баланса
- •6.2. Определение коэффициентов уравнений окислительно-восстановительных реакций методом ионно-электронного баланса
- •6.3. Задачи для самостоятельного решения
- •7. Электропроводность растворов электролитов. Числа переноса
- •7.1. Примеры решения задач
- •7.2. Задачи для самостоятельного решения
- •8. Электрохимические процессы на электродах. Типы электродов. Электродный потенциал
- •8.1.Примеры решения задач
- •8.2. Задачи для самостоятельного решения
- •9. Электролиз. Законы Фарадея
- •9.1. Примеры решения задач
- •9.2. Задачи для самостоятельного решения
- •10. Химические источники тока
- •10.1. Примеры решения задач
- •10.2. Задачи для самостоятельного решения
- •Библиографический Список
- •Приложения
- •Оглавление
4.2. Задачи для самостоятельного решения
45. Какая из солей – ацетат натрия CH3COONaили цианид натрияNaCNв большей степени подвергается гидролизу?
46.Используя справочные данные, определите, водный раствор какой соли (при одинаковых температуре и молярной концентрации) будет иметь большее значение рН:
а) KBrO,KClилиKClO; д)AlCl3,FeCl3илиCrCl3;
б) NH4NO3, NH4Cl или (NH4)2SO4; е) CsNO2, CsCN или CsNO3;
в) Cu(NO3)2, Fe(NO3)2 или Ba(NO3)2; ж) MgCO3, NiCO3 или CaCO3.
г) Na2HPO4, Na3PO4 или NaH2PO4;
Составьте уравнения реакций гидролиза, протекающих в разбавленных водных растворах этих солей.
47. Вычислить рН и степень гидролиза 0,1 М раствора нитрата серебра AgNO3.
Ответ: 6,3; 4,5106.
48. Вычислить рН и степень гидролиза 0,1 М раствора фторида аммония NH4F.
Ответ: 6,2; 9,1104.
49. Вычислить рН и степень гидролиза 0,1 М раствора фторида натрия NaF.
Ответ: 8,1; 1,2105.
50. Вычислить рН и степень гидролиза 0,1 М раствора нитрита аммония NH4NO2.
Ответ: 6,3; 1103.
51. Вычислить рН и степень гидролиза 0,1 М раствора цианида аммония NH4СN.
Ответ: 9,2; 47%.
52. Вычислить рН и степень гидролиза 0,1 М раствора формиата натрия НСООNa.
Ответ: 8,4; 2,4105.
53. Вычислить рН и степень гидролиза 0,1 М раствора гипохлорита калия KClO.
Ответ: 10,2; 0,0014.
54. Вычислить рН и степень гидролиза 0,5 М раствора сульфита натрия Na2SO3.
Ответ: 10,44; 5,6104.
55. Вычислить рН и степень гидролиза 0,25 М раствора фосфата натрия Na3РO4.
Ответ: 12,8; 26%.
56. Вычислить рН и степень гидролиза 0,2 М раствора ацетата аммония СН3СООNH4.
Ответ: 7; 0,0055.
57. Вычислить рН и степень гидролиза 0,1 М раствора формиата аммония НСООNH4.
Ответ: 6,5; 0,0018.
58. Вычислить рН и степень гидролиза 0,5 М раствора фторида серебра AgF.
Ответ: 7,43; 5,4105.
59. Вычислить рН и степень гидролиза 0,1 М раствора нитрита калия КNO2.
Ответ: 8,17; 1,47105.
60. Вычислить рН и степень гидролиза 0,001 М раствора цианида калия КСN.
Ответ: 10,0; 11,1%.
61. Вычислить рН и степень гидролиза 0,2 М раствора оксалата натрия Nа2С2О4.
Ответ: 8,8; 3105.
62. Вычислить рН и степень гидролиза 0,02 М раствора карбоната натрия Nа2СО3.
Ответ: 11,3; 9,5%.
63. Вычислить рН и степень гидролиза 0,75 М раствора хлорида железа (III) FeCl3.
Ответ: 1,3; 6,7%.
64. Вычислить рН и степень гидролиза 0,75 М раствора хлорида железа (II) FeCl2.
Ответ: 5,1; 1105.
65. Вычислить рН и степень гидролиза 0,3 М раствора хлорида цинка ZnCl2.
Ответ: 2,85; 4,7103.
66. Вычислить рН и степень гидролиза 0,02 М раствора нитрата железа (III)Fe(NO3)3.
Ответ: 2,18; 33,3%.
67. Вычислить рН и степень гидролиза 0,3 М раствора сульфида аммония (NH4)2S.
Ответ:12,1; 99,8.
68. Вычислить рН и степень гидролиза 0,1 М раствора фосфата калия К3РО4.
Ответ: 12,6; 37,6%.
69. Вычислить рН и степень гидролиза 0,1 М раствора бромида магния MgBr.
Ответ: 6,7; 2 105.
5. Труднорастворимые соли. Произведение растворимости
В насыщенном растворе малорастворимого электролита соли, находящегося в равновесии с твердым осадком соли, непрерывно протекают два противоположно направленных процесса. С одной стороны, ионы из узлов кристаллической решетки переходят в раствор в виде гидратированных ионов. С другой стороны, ионы, освобождаясь от гидратной оболочки, вновь занимают места в кристаллической решетке. Для состояния равновесия, когда скорости этих процессов равны, может быть записано выражение
![]()
где Me+– катион,A–– анион (для упрощения записи указаны только знаки заряда ионов).
Для процесса диссоциации константа равновесия
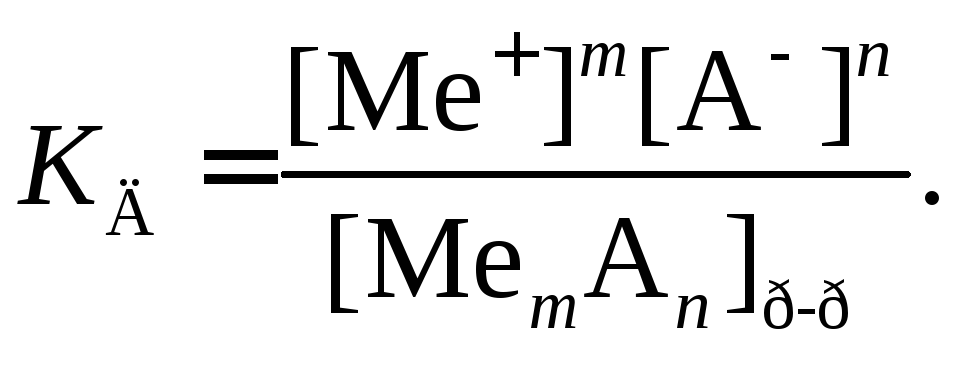 ,
,
Величина
![]() называется произведением растворимости
и обозначается
называется произведением растворимости
и обозначается![]()
![]()
и равна произведению равновесных концентраций ионов в насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам. Эта величина постоянная при данной температуре.
Зная ПР малорастворимого электролита, можно вычислить его растворимость (S) в моль/л и г/л. Для электролита МеmAnконцентрации ионовMe+иA–составляют
![]() моль/л и
моль/л и![]() моль/л,
моль/л,
а величина ПР через растворимость выразится уравнением:
![]() .
.
Если произведение фактических концентраций ионов меньше значения ПР малорастворимого электролита или равно ему, то в этих условиях осадок не образуется. Образование осадка происходит только в том случае, когда произведение концентраций ионов больше величины ПР, и прекращается, когда эти величины уравниваются, а в системе устанавливается динамическое равновесие между раствором и твердой фазой. При добавлении к насыщенному раствору труднорастворимой соли легкорастворимой соли, содержащей один из ионов малорастворимого электролита, в соответствии с постоянством величины ПР концентрация второго иона должна уменьшаться, то есть должна уменьшаться растворимость соли и происходить дополнительное выпадение осадка.
