
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
Составные части атомов, их масса и заряд. Пространственное разделение зарядов и массы в атомах: планетарная модель
Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов. Вид атомов с одинаковым зарядом ядра называют элементом.
До конца XIXвека полагали, что атом – простейшая неделимая частица, и это подтверждалось в большинстве химических реакций, т.к. вещества реагировали в строго определенных массовых отношениях.
Первые предположения о сложности строения атома появились при изучении электрохимических явлений, катодных лучей и др. явлений. В 1896 г. А.Беккерелем была открыта естественная (т.е. без внешнего воздействия) радиоактивность соединений урана – способность испускать «лучи», которые засвечивали фотографическую пленку. Позднее было установлено, что эти «лучи» представляют собой поток материальных заряженных частиц, α (ядра He2+) и β (электроны) (Э.Резерфорд), а также включает жесткое рентгеновское излучение (П.Виллар).
Таким образом, экспериментально было доказано, что атом – сложная структура, состоящая из более простых частиц (протонов, нейтронов, электронов). Масса покоя протона и нейтрона равны примерно 10–27кг, а масса покоя электрона примерно в 1000 раз меньше – 10–30 кг. Заряды протона и электрона одинаковые, равные 1,610–19Кл (относительный заряд обеих частиц принят за +1 и –1 соответственно), заряд нейтрона равен нулю.
Естественно, что далее стал вопрос о том, как положительно и отрицательно заряженные частицы распределены в атоме? С позиций электростатики противоположно заряженные частицы, вероятнее всего, должны быть равномерно перемешаны в объеме атома – именно такой была первая модель, предложенная Дж. Томсоном (1903 г.). Для экспериментального подтверждения такой модели в лаборатории Э.Резерфорда в 1911–1913 г.г. была проведена серия опытов по рассеянию потока α-частиц при бомбардировке ими тонкой фольги из различных металлов. Результат эксперимента оказался неожиданным: большая часть α-частиц проходила сквозь фольгу, как сквозь сито, не встречая какого-либо препятствия, и лишь малая их часть рассеивалась. Очевидно, что объяснение этому могло быть одно: большая часть объема атома занята частицами, с массой гораздо меньшей, чем у α-частиц (электронами), и, встречаясь с ними α-частицы не рассеивались; большая часть массы атома и весь его положительный заряд сосредоточены в малой части его объема – ядре, столкновение с которым и вызывало рассеяние α-частиц. Таким образом, положительно и отрицательно заряженные частицы в составе атома пространственно разделены, но почему вопреки законам электростатики они не «слипаются»?
Для снятия последнего противоречия Э.Резерфорд предложил модель, согласно которой электроны вращаются вокруг ядра подобно планетам вокруг Солнца, и действующая при этом центробежная сила компенсирует центростремительную силу электростатического притяжения к ядру. (На этом этапе заканчивается модель атома в рамках программы по химии в средней школе).
В то же время «планетарная модель атома» по Резерфорду не решила проблему устойчивости атома. Дело в том, что согласно законам электродинамики любая заряженная частица при движении излучает энергию (вспомните электромагнитное излучение линиями электропередач). По этой причине энергия движущихся электронов должна непрерывно уменьшаться, и результатом этого должно быть «слипание» их с ядром. На самом деле в отсутствие внешнего возбуждения атом не излучает энергию. Изменение энергии электронов происходит в результате поглощения энергии от внешнего ее источника и последующего ее излучения. При изучении спектров атомов было установлено, что при возбуждении атомов и возврате их в начальное состояние изменение энергии электронов происходит не непрерывно, а порциями («квантами»): в результате спектры атомов, и поглощения, и испускания, – линейчатые.
Объяснить эти свойства в рамках классической физики было невозможно. В то же время принципы квантования энергии были к тому времени уже известны для фотонов (М.Планк). С учетом этого Н.Бор предложил модель атома, основанную на принципе квантования энергии электронов (подробнее см. [1-3]). Однако вопрос о том, насколько обоснованно отождествлять энергетику фотонов, проявляющих двойственные свойства, волновые и корпускулярные, и электронов – мельчайших, но материальных частиц, оставался открытым в течение последующих 10 лет.
Двойственная природа микрообъектов. Гипотеза де Бройля, волновое уравнение. Экспериментальное подтверждение волновых свойств электронов. Волновое уравнение Шредингера
В 1924 г. Луи де Бройль представил к защите диссертацию, из которой следовало, что волновыми свойствами должны обладать любые движущиесяматериальные частицы, в том числе и электроны. Объединив правые части уравнений М.Планка (E=hν=hc/λ) и А.Эйнштейна (E=mc2), де Бройль вывел уравнение для расчета длины волны излучения движущейся частицы:
|
λ = h/mV, |
(2.1) |
где h– постоянная Планка (6,6310–34Джс),m– масса частицы (г),V– скорость ее движения (м/с). Впоследствии уравнение (2.1) назваливолновым уравнением де Бройля.
Применив уравнение (2.1) для электрона в атоме водорода, находящегося на 1-й, 2-й и т.д. орбитах и сопоставив рассчитанные λс радиусами этих атомных орбит (они были рассчитаны ранее Н.Бором), де Бройль получил еще одно любопытное соответствие:2πr = nλ– Из этого уравнения следует, что движение электрона в атоме представляет собой волновой колебательный процессрезонансноготипа, а тогда понятно, почему онне сопровождается излучением энергии.
К 1927 г. было экспериментально подтверждено (Англия, США, СССР), что поток электронов действительно проявляет волновые свойства (дифракция на кристаллической решетке), и таким образом гипотеза де Бройля о двойственной (корпускулярно-волновой) природе электрона правомерна. В то же время уравнение (2.1) – это уравнениеплоскойволны и оно не может быть использовано для полной характеристики электронов в трехмерном атоме. Волновое уравнение, описывающее состояние электрона в атоме, предложил Шредингер (см. [1-3]).
Свойства волнового уравнения Шредингера. Квантово-механическая (вероятностная) модель атома
В волновом уравнении Шредингера для характеристики состояния электрона используется волновая функция , которую можно рассматривать как амплитуду волнового процесса. Квадрат ее величины2характеризует вероятность нахождения электрона в данном месте пространства, а произведение2dV– вероятность его нахождения в объемеdV=dxdydz. Таким образом, уравнение Шредингера позволяет определить вероятность нахождения электрона относительно ядра атома.
Квантово-механическая модель не обладает наглядностью, к тому же ее математический аппарат ее довольно сложен для первокурсника. В связи с этим рассмотрим основные выводы, вытекающие из волнового уравнения, полезные для решения практических задач.
Из уравнения Шредингера следует, что атом будет устойчив, если квантуются:
– полная энергия электрона, пропорционально n – главному квантовому числу;
– орбитальный момент движения электрона пропорционально числу l – орбитальному квантовому числу;
– магнитный орбитальный момент движения электрона, пропорционально числу ml – магнитному орбитальному квантовому числу.
Кроме того, любой электрон, в том числе и не связанный с ядром, имеет собственный магнитный момент (спин) ms = ±1/2:
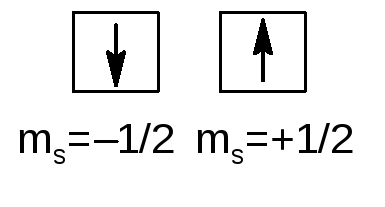
Согласно уравнению Шредингера, для главного квантового числа (n) возможны только целочисленные значения n = 1,2,3, …
Физический смысл квантовых чисел, связь их с понятиями: энергетический уровень, подуровень(s‑, p-, d‑, f-,..), орбиталь. Форма электронных орбиталей и их пространственная ориентация относительно ядра атома
Состояние электронов с определенным n называют уровнем. Если n = 1, то это первый уровень, если n = 2, то это второй уровень и т.д. Из того, что максимальная величина n не ограничена, следует, что в любом атоме – бесчисленное множество энергетических уровней.
Для орбитального квантового числа (l) возможны целочисленные значения по (n–1) включительно, а также «ноль», т.е. l = 0,1,2,3, …(n–1).
Состояние электронов с определенным l называют подуровнем. Число подуровней определяется величиной n для этого уровня:
– если n = 1 (первый уровень), то возможно только одно значение l = 0, поэтому на первом уровне – только один подуровень;
– если n = 2 (второй уровень), то возможно два значения l = 0 и 1, поэтому на втором уровне – два подуровня.
Легко убедиться, что число подуровней равно величине n: на третьем уровне (n = 3) – три подуровня, на четвертом – четыре и т.д.
Подуровни (s-, p-, d-, f- и т.д.) различаются величиной орбитального квантового числа l: подуровень с l = 0 называют s – подуровнем, l = 1 – p-подуровнем, l = 2 – d-подуровнем, l = 3 – f-подуровнем, (далее, при больших l, символы присваивают в порядке латинского алфавита).
Величина l определяется также формой электронных орбиталей (рисунок 2.1.). Орбитали с равным l, но с разным n (например, 1s и 2s) одинаковы по форме, но различаются размерами: орбитали с большим n имеют больший размер (т.к. при большем n они более удалены от ядра).
Для магнитного орбитального квантового числа (ml) возможны целочисленные значения от –l до +1, включая «ноль», т.е. всего (2l + 1) значений.
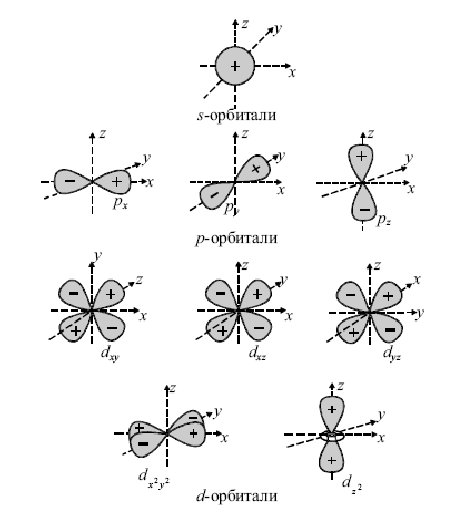
Рисунок 2.1 – Форма атомных орбиталей
Число возможных значений ml для данного подуровня определяет число вариантов ориентации орбитали в пространстве (и соответственно число этих орбиталей на подуровне). Например, для s-подуровня (l = 0) возможно только одно значение ml = 0, поэтому на s-подуровне только одна орбиталь. Для p-подуровня l = 1, и для ml возможны три значения: –1, 0, +1, поэтому на p-подуровне три орбитали, ориентированные вдоль осей XYZ декартовой системы координат (обозначаются, соответственно px, py, pz) . Легко показать, что на d-подуровне – пять орбиталей, на f- подуровне – семь и т.д. (нечетный ряд).
Еще раз подчеркнем, что изложенные принципы квантования состояний обязательны для электрона, связанного с ядром. Свободные электроны (β-частицы, например) могут иметь любую энергию, не подчиняясь правилам квантования, кроме ms = ±1/2).
Три квантовых числа (n, l, ml) однозначно определяют конкретную орбиталь в атоме. Например, если n = 3, l = 1, ml = 0, то это орбиталь третьего уровня, p-подуровня, ориентированная вдоль оси Z. Если требуется указать «адрес» конкретного электрона в атоме, то кроме «адреса» его орбитали (n, l, ml) требуется указать знак спина: ms = +1/2 или ms = – 1/2.
Принцип Паули. Электронная емкость орбитали, подуровня, уровня
Согласно принципу Паули, в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Пример: Если для одного из электронов в атоме n = 3, l = 1, ml = 0, ms = +1/2, то другие электроны должны иметь хотя бы одно квантовое число другое, а именно: или другое n, т.е. находиться на другом уровне, или другое l, т.е. находиться на другом подуровне, или другое ml, т.е. находиться на другой орбитали, или иметь те же n, l, ml, но иметь противоположный по знаку спин.
Из последнего варианта следует, что на каждой атомной орбитали, характеризующейся определёнными значениями n, l, ml, может находиться не более двух электронов, причём спины этих электронов должны быть противоположными по знаку. (Так как только в этом случае три квантовых числа, n, l, ml этих электронов будут одинаковыми, но спины – разными: у одного электрона ms = +1/2, у другого ms = –1/2).
![]()
![]()
|
Обозначение неспаренного электрона на атомной орбитали, если ms = +1/2 |
Обозначение двух спаренных электронов с противоположными спинами, находящихся на одной атомной орбитали |
Зная число орбиталей на подуровне (одна – на s-, три – на p-, пять – на d- и семь – на f-) и с учетом того, что на одной орбитали может быть не более двух электронов, легко определить, что на s-подуровне быть до двух электронов, на p-подуровне – до 6, на d-подуровне – до десяти и на f-подуровне – до четырнадцати электронов. Соответственно на первом уровне (только 1s-подуровень) может быть один или два электрона; на втором уровне (2s- и 2p- подуровни) – до 8 электронов; на третьем уровне (включающем подуровни s-, p-, d-) может быть до 18 электронов: 2 + 6 + 10.
Относительная энергия уровней и подуровней
Для одноэлектронного атома водорода относительная энергия подуровней определяется, прежде всего, величиной главного квантового числа: меньшую энергию имеет подуровень с меньшим n. В пределах одного и того же уровня энергия подуровней увеличивается в ряду Еs < Еp < Еd < Еf , и в атоме водорода относительная энергия подуровней будет следующая: 1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g6s…
В многоэлектронных атомах на энергию электронов влияет не только притяжение их к ядру, но и межэлектронное отталкивание. В результате относительная энергия некоторых подуровней меняется по сравнению с атомом водорода.
В многоэлектронных атомах меньшую энергию имеет подуровень с меньшей суммой (n + l); при равной сумме (n + l) меньшую энергию имеет подуровень с меньшим n.
Выпишем последовательность, определенную для атома водорода, и проставим для каждого подуровня сумму (n + l):
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5g 6s…
∑(n + l): 1 2 3 3 4 5 4 5 6 7 5 6 7 8 9 6
А теперь, выполнив перестановки в соответствии с приведенными выше правилами, расположим подуровни в порядке увеличения их энергии:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d…
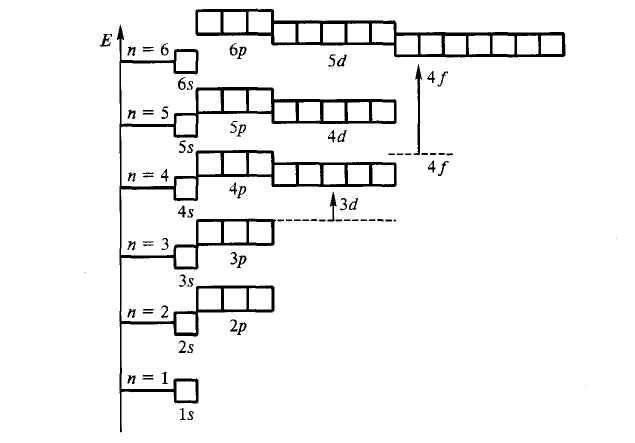 На
рисунке 2.2 показана энергетическая
диаграмма атомных орбиталей
многоэлектронного атома.
На
рисунке 2.2 показана энергетическая
диаграмма атомных орбиталей
многоэлектронного атома.
Рисунок 2.2 – Энергетическая диаграмма
атомных орбиталей многоэлектронного
атома
Порядок заполнения электронами орбиталей подуровней, уровней. Электронные и электронно-графические формулы атомов
Порядок заполнения определяется принципом наименьшей энергии: вначале заполняются орбитали, на которых энергия электрона будет меньшей.
При этом кроме приведенного выше ряда относительной энергии подуровней и принципа Паули необходимо учесть правила Гунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах подуровня, при котором абсолютное значение суммарного спина максимально.
Пример: распределить три электрона на p-подуровне в соответствии с правилом Гунда.
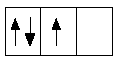

|
а |
б |
При варианте (б) абсолютная величина суммарного спина равна 3/2; при варианте (а) равна 1/2. Очевидно, что правилу Гунда соответствует вариант (б).
Правило Гунда не запрещает другого распределения электронов в пределах подуровня (на то оно и «правило», а не закон), однако другие варианты возможны при возбуждении атомов (такие варианты встретятся при рассмотрении химических связей в комплексных соединениях).
Распределение электронов по подуровням показывают электронные конфигурации (электронные формулы) атомов. Например, в атоме с зарядом ядра Z = +11 имеются 11 электронов, которые распределятся по подуровням следующим образом: 1s22s22p63s1 – это и есть электронная конфигурация (формула) атома с Z = +11.
Что получится для атома с Z = +23?: 1s2 2s2 2p6 3s2 3p6 4s2 3d3 – Эта последовательность заполнения соответствует приведенным ранее правилам, но в отличие от предыдущего примера – это пока не еще не электронная формула. Дело в том, что подуровень 3d выше по энергии, чем 4s до тех пор, пока он вакантный. При появлении на 3d первого же электрона энергия его понижается по сравнению с 4s. В результате действительной электронной формулой атома с Z = +23 будет 1s22s22p63s23p63d34s2.
Подобные перестановки приходится делать во всех случаях, когда при распределении электронов «последние» оказываются на d- или f-подуровне. По этой причине в таких атомах всех элементов внешние электроны – на s-подуровне.
«Проскок» электрона
«Проскок» проявляется в том, что при заполнении d- или f-подуровней возможен переход на них электрона с внешнего s- подуровня: ns (n – 1)d.
«Проскок» чаще наблюдается в тех случаях, когда при распределении электронов в атоме на (n–1)d-подуровне оказывается четыре или девять электронов (т.е. не хватает одного электрона до завершения подуровня наполовину или полностью). В результате «проскока» электронные формулы атомов с зарядами ядер, например Z = +24 (Сr) и Z = 29 (Cu) оказываются не 1s22s22p63s23p63d44s2 и 1s22s22p63s23p63d94s2, а 1s22s22p63s23p63d54s1 и 1s22s22p63s23p63d104s1 соответственно. Особенно часто «проскок» наблюдается у атомов пятого периода; в атоме палладия – двойной «проскок», и на внешнем 5s-подуровне нет ни одного электрона. Для f-подуровней закономерности более сложные.
Физический смысл Периодического закона Д.И.Менделеева. Cтруктура таблицы элементов
Физический смысл периодического закона заключается в том, что с изменением зарядов ядер атомов (и соответственно общего числа электронов в атоме) периодически повторяется электронное строение внешнего (валентного) уровня атомов, а вследствие этого периодически повторяются химические свойства элементов и их соединений.
Поэтому свойства атомов элементов, образуемых ими простых веществ и других химических соединений находятся в периодической зависимости от зарядов ядер атомов (современная формулировка Периодического закона).
Периодическая таблица элементов является графическим изображением периодического закона. Из многих форм такого изображения наиболее широко используются три: а) короткая (8‑клеточная), б) полудлинная (18-клеточная), в) длиннопериодная (32-клеточная).
В вариантах (а) и (б) элементы – лантаноиды и актиноиды вынесены в нижнюю часть таблицы или в отдельные группы.
Физической основой структуры таблицы элементов (объединения элементов в периоды, группы, подгруппы) является периодичность в формировании электронных структур атомов по мере увеличения величины заряда их ядер. Так, если написать электронные формулы атомов в порядке увеличения заряда ядра, начиная сZ= +1, то проявится четкая закономерность:в периоды объединены элементы, в атомах которых внешние валентные электроны в невозбужденных атомах находятся на одном и том же энергетическом уровне, номер которого (величина главного квантового числа, n, для внешних электронов) равен номеру периода.
Например, у элементов 3 периода(от Na до Ar) внешние валентные электроны находятсяна 3-мэнергетическом уровне, а у элементов6 периода(от Cs до Rn) –на 6-м. Поэтому элементы со структурами валентного уровня6s1,6s26p3, 5d76s2, 4f36s2 находятся вшестомпериоде.
В группы объединены элементы, атомы которых имеют одинаковое число валентных электронов.
Например, атомы элементов четвертой (IV)группы имеют почетыре валентных электрона, а атомыседьмойгруппы –по семь.
Группы элементов А или В («главные» или «побочные») объединяют элементы с одинаковым распределением валентных электронов по подуровням.
Если все валентные электроны занимают орбитали внешнего уровня (s-,p-подуровни), то подгруппа главная (А); если часть валентных электронов на внешнемs-подуровне, а остальные на предвнешнихd-илиf-, то подгруппа побочная (В).
Например, элементы со структурой валентного уровня атомов 3s1, 4s2, 3s23p1, 6s26p4 находятся в главных подгруппах (в первой, второй, третьей и шестой группах соответственно); элементы со структурой валентного уровня атомов 3d14s2, 4d35s2, 4f76s2– в побочных подгруппах (третьей, пятой и третьей групп соответственно).
Обратите внимание, что для элементов VIII группы (так называемых «триад»: Fe, Co, Ni; Ru, Rh, Pd; Os, Ir, Pt) число валентных электронов, равное номеру группы, т.е. по 8, имеют только первые элементы «триад»: Fe (3d64s2), Ru (4d75s1), Os(5d66s2). Атомы каждого последующего элемента «триады» имеют на один электрон больше. Атомы элементов, у которых часть валентных электронов занимаютf-подуровень, относятся кIIIгруппе, «лантаноидам и «актиноидам».
В химических превращениях участвуют только валентныеэлектроны и орбитали атомов, поэтому для решения практических задач достаточно показать электронное строение только валентного уровня атома. Электронные конфигурации (формулы) атомов, показывающие распределение по подуровням только валентных электронов, называют сокращенными электронными формулами. Электронно-графические формулыатомов показывают распределение электронов по уровням, подуровнями орбиталям.
Зная физические принципы построения периодической таблицы, сокращенную электронную формулу атома можно написать, минуя написание полной формулы, по «адресу» элемента в периодической таблице (период, группа, подгруппа).
Например, если элемент расположен в 4-м периоде, V группе, главной подгруппе (А), то внешние валентные электроны в его атоме занимают 4-й энергетический уровень (т.к. период 4-й). Из того, что подгруппа – главная, следует, что валентные электроны – все на внешнем уровне и занимают s- и p‑ подуровни (4s4p). Из того, что группа пятая, следует, что валентных электронов пять; с учетом электронной емкости подуровней (см. принцип Паули) получим следующую сокращенную электронную формулу: 4s24p3, а также и соответствующую ей сокращенную электронно-графическую формулу:
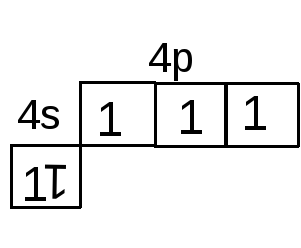
Аналогично для элемента того же 4-го периода и той же V группы, но побочной подгруппы (В) получим сокращенную электронную формулу 3d34s2, т.к. из пяти валентных электронов только два – на внешнем четвертом уровне (4s-подуровне), а остальные три – на предвнешнем 3d-подуровне. Такому распределению электронов соответствует следующая сокращенная электронно-графическая формула:

Обратите внимание, что для металлов групп В к валентным относятся d-орбитали как предвнешнего, так и внешнего уровня.
Семейства элементов
Семейство элемента (s-, p-, d-или f-) определяется тем подуровнем (s-, p-, d-или f-), который заполнялся последним. Элементы со строением валентного уровня атомов 3s1, 5s2относятся кs‑семейству(s‑элементам); 4s24p1, 5s25p5– кp-семейству, 3d34s2, 4d105s2– кd‑семейству;4f116s2– кf‑семейству.
Элементы s-, p-семейств в периодической таблице составляют главные подгруппы (или группы А), а элементы d- , f-семейств – побочные подгруппы (или группы В).
В заключение этого раздела отметим, что наиболее простой и надежный способ определения главных и побочных подгрупп в короткой (8-клеточной) форме периодической таблицы основан на том, что во втором периоде все элементы – в главных подгруппах (т.к. на втором уровне нет d-подуровня). Поэтому все элементы, расположенные под ними – тоже в главных подгруппах.
Свойства атомов. Периодичность в изменении свойств атомов как следствие периодичности в изменении их электронных структур. Свойства атомов и свойства элементов
При анализе химических свойств элементов существенными являются следующие характеристики атомов:
– орбитальный радиус, r (условная величина) – расстояние от ядра до максимума плотности внешнего электронного облака; измеряется в метрах (СИ), чаще – в нанометрах (1нм = 10–9 м) или в ангстремах (1А = 10–10 м). Радиус атома примерно в 105 раз больше радиуса его ядра;
– энергия(или потенциал)ионизацииатома,I, характеризует способность атомаотдаватьэлектроны, превращаясь в катион: АА++ e–; измеряется в кДж/моль (СИ), иногда в эВ/атом (1 эВ/атом = 96 кДж/моль);
– сродство к электрону,Е, характеризует способность атомаприсоединятьдополнительный электрон, превращаясь в анион:
А + e– А–, кДж/моль
– электроотрицательность,, – условная величина, характеризует способность атомасмещатьк себе электронную плотность связи с другим атомом. На практике чаще применяют шкалу не абсолютных, а относительных электроотрицательностей (ОЭО), в которой самым электроотрицательным является атом фтора, а наименее – атом франция.
Периодичность в изменении свойств атомов определяется периодичностью в формировании их электронных оболочек. Так, у атомов элементов одного периода внешние электроны находятся на одном и том же энергетическом уровне (т.е. примерно на одинаковом расстоянии от ядра), поэтомуr атомов элементов одного периода примерно равны(уменьшаясь слева направо с увеличением заряда ядра из-за увеличения притяжения электронов к ядру).
В главныхподгруппах с увеличением номера периода валентные электроны атомов располагаются на все более удаленном от ядра энергетическом уровне, и поэтому rувеличиваются. Однако в побочных подгруппахрадиусы меняются мало, т.к. в атомах элементов побочных подгрупп электронами заполняютсявнутренниеd‑или f‑подуровни (атомы «сжимаются»).
Периодичность в изменении I, Е, ЭОявляется следствием периодичности в изменениирадиусоватомов. Учитывая, что природа сил притяжения электронов к ядру – электростатическое их взаимодействие описывается законом Кулона, F =q1∙q2/r2, очевидно:чем больше r или чем меньше заряд ядра атома, тем меньшими должны быть его I, Е, ЭО.
Примеры:Сравнитьr, I, Е, ЭО ()атомов:
а) Са и Ва; б) Са и Ge; в) Cu и Au.
Решение:а) Са и Ва – элементы однойглавнойподгруппы II группы, следовательно,rBa>rCa, а тогдаICa>IBa,ЕCa>ЕBa,Ca>Ba;
б) Ca и Ge – элементы одного периода, следовательно,rCarGe, причем, ZCa< ZGe, а тогдаICa<IGe,ЕCa<ЕGe иCa<Ge;
в) Cu и Au – элементы одной, побочной, подгруппы, следовательно:
rСu rAu, но т.к. ZCu < ZAu, то ICu < IAu, ECu < EAu, Cu < Au.
Примечание: при анализе справочных данных по свойствам атомов можно заметить, что в периодах и группах они меняются не всегда однозначно, как описано выше. Некоторые из этих «несоответствий» закономерны, например, при переходе к атомам с наполовину или полностью завершенными np- или (n – 1)d-подуровнями валентного уровня. Другие объяснить гораздо сложнее (см. следующую тему).
Металлы и неметаллы в таблице элементов. Периодичность в изменении свойств элементов и их соединений
В рамках химических представлений элементы делятся на металлы и неметаллы, исходя из способности их атомов отдавать и принимать электроны: для металлов более характерно отдавать, а для неметаллов – принимать электроны. Учитывая, что эти свойства атомов характеризуются величинами I, E, , можно предположить, что чем меньше I и для атомов элементов, тем большие металлические и меньшие неметаллические свойства для них характерны.
На самом деле связь отдельных свойств атомов с металлическими (неметаллическими) своствами простых вещест не такая простая. Например, сродство к электрону у атомов бериллия и магния равное, а для атомов всех (кроме лития) элементов 2 периода оно меньше, чем у расположенных ниже элементов 3 периода, хотя неметаллические свойства более выражены у элементов, расположенных в подгруппах выше. Еще более неожиданно сравнение элементов одного периода лития и азота:сродство к электрону щелочного металла лития не просто больше, чем у азота, а отличается и по знаку: превращениеLiLi–сопровождается выделением энергии, а превращениеNN–требует затрат энергии.
Учитывая изложенное выше, сравнение металлических или неметаллических свойств элементов проще и обычно надежнее делать, исходя из их положения в периодической таблице.
Так, для элементов одного периода(радиусы которых меняется мало) с увеличением заряда ядра атомов увеличиваются неметаллические и уменьшаются металлические свойства (по этой причине каждый период начинается с металла и заканчивается неметаллом).
В группах металлические свойства элементов увеличиваются с увеличением номера периодав главныхподгруппах (вследствие увеличения r) и уменьшаютсяв побочных(вследствие увеличения зарядов ядер при малых изменениях радиуса).
Таким образом, с помощью периодической таблицы легко выделить элементы–металлы и элементы–неметаллы:
– все элементы s-семейства(кроме Н и Не) – металлы – это элементы главных подгрупп I и II групп; к металлам относятся также все, без исключений, элементы d-, f-семейств, т.е. все элементыпобочных подгрупп;
– из элементов p-семейства (главные подгруппы III–VIII групп) к металлам относятся те, которые расположены ниже диагонали, проведенной через B – Si – As – Te – At. На этой диагонали и выше нее, в правом верхнем углу периодической таблицы, в главных подгруппах, расположены неметаллы (к ним же следует отнести и германий, Ge).
Пример:определить с помощью периодической таблицы, какие из заданных элементов относятся к металлам, а какие – к неметаллам; какой из металлов более металличен, а из неметаллов – более неметалличен: Ca, Cr, As, W, Br.
Решение:из заданных элементов относятся к металлам Са (как элемент II группы, s‑семейства), а также Cr и W (как элементы побочной подгруппы, d‑семейства); к неметаллам относятся As и Br, как элементы p‑семейства (см. «диагональ»). Далее, Ca, Cr, As, Br – элементы одного периода, следовательно, самый металличный из них – кальций, а самый неметалличный – бром; из Cr и W более металличен хром, т.к. в побочных подгруппах металлические свойства уменьшаются с увеличением заряда ядра. Таким образом, из заданных элементов наиболее металличным является кальций, а более неметалличным – бром.
В соответствии с периодичностью изменения металлических и неметаллических свойств элементов периодически меняются химические свойства их соединений: при равных степенях окисления атомов более металличные элементы образуют более основные оксиды и более сильные основания. Более неметалличные элементы образуют более кислотные оксиды и более сильные оксокислоты.
Примеры:сравнить кислотно-основные свойства:
1) BaO и MgO; Ba(OH)2 и Mg(OH)2 4) SO2 и SeO2; H2SO3 и H2SeO3
2) NiO и PdO 5) CoO и Co2O3; Co(OH)2 и Co(OH)3
3) Mn(OH)2 и Ni(OH)2; 6) SO2 и SO3; H2SO3 и H2SO4
Решение
1) Барий и магний – металлы. Барий расположен ниже магния в главнойподгруппе, поэтому барий более металличен. Вследствие этого оксидBaO– более основной, чем оксидMgO, и основаниеBa(OH)2сильнее основанияMg(OH)2.
2) Никель и палладий – металлы (т.к. подгруппа побочная); более металличен никель, т. к. в побочной подгруппе расположен выше. Вследствие этого NiO – более основной, чем PdO;
3) Марганец и никель – металлы (т. к. подгруппы побочные); марганец более металличен, т.к. расположен в периоде левее никеля. Вследствие этого Mn(OH)2 – основание более сильное, чем Ni(OH)2;
4) Сера и селен – неметаллы (т.к. расположены в главной подгруппе правее «диагонали» B-Si-As-Te-At); сера более неметаллична, т.к. расположена выше селена. Вследствие этого SO2 более кислотный, чем SeO2, и H2SO3 – кислота более сильная, чем H2SeO3;
В вариантах (5), (6) следует учесть зависимость кислотно-основных свойств оксидов и гидроксидов элементов от степени окисления их атомов:
Чем больше степень окисления атома элемента, тем меньшие основные и более кислотные свойства проявляют их оксиды и гидроксиды.
5) Степень окисления атома кобальта в CoOменьше, чем вCo2O3, поэтомуCoO– более основной оксид, чемCo2O3и соответственноCo(OH)2– основание более сильное, чемCo(OH)3;
6) SO2иSO3 – кислотные оксиды. ВSO3степень окисления атома серы больше, чем вSO2, поэтомуSO3 – более кислотный оксид, чемSO2. СоответственноH2SO4 – кислота более сильная, чемH2SO3.
