
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
4.4 Основы химической кинетики
Химическая кинетика – учение о химическом процессе, его механизме и закономерностях протекания во времени.
Химическая кинетика наряду с химической термодинамикой – теоретическая основа химической технологии, поскольку позволяет оптимизировать и интенсифицировать промышленно важные реакции. Тепловой эффект реакции, преимущественное направление и глубина ее протекания определяются законами термодинамики; однако из них совсем не следует возможность прогнозирования скоростиперехода из начального в конечное состояние, а также через какие промежуточные стадии проходит это превращение.
Пример:H2(г) + 1/2O2(г)H2O(г)![]() H0= – 242 кДж/моль
H0= – 242 кДж/моль
NO(г)+ 1/2O2(г)NO2(г) ![]() H0= – 56 кДж/моль
H0= – 56 кДж/моль
Первая реакция энергетически более выгодна, однако скорость ее несравнимо меньше, чем второй реакции.
Основные понятия и определения
Механизм химической реакции – совокупностьэлементарных стадий, из которых складывается химическая реакция.
Элементарной называют реакцию, которая осуществляется превращением реагентов в продукты реакцииводну стадию.
Молекулярность реакции – число частиц (молекул, атомов, радикалов, ионов), участвующих в элементарном акте химической реакции. Различают мономолекулярные реакции (в элементарном акте участвует одна молекула), например, реакции изомеризации или разложения:
2N2O5(г)= 4NO2(г)+O2(г)
– бимолекулярныереакции, в которых две молекулы участвуют в образовании одного или нескольких веществ, например, реакции соединения или обмена (А +B= С,AB+CD=AD+BC):C2H4+HI=C2H5I
– тримолекулярные реакции, которые протекают при одновременном столкновении трех молекул (встречаются довольно редко):
2NO+Cl2= 2NOCl
Реакции более чем тримолекулярные практически не встречаются.
Скорость химической реакции – это
число элементарных актов химического
взаимодействия, протекающих в единицу
времени в единице объема (для гомогенных
реакций) или на единице поверхности
(для гетерогенных реакций) – этоабсолютная скорость. Для реакций,
даже очень медленных, абсолютная скорость
огромна. Например, если и
А В
Мгновенная скорость– это скорость на определенное время (короткое мгновение):V= ±dС/dt
(если скорость контролируется по образующемуся продукту, то знак «+», если по расходу исходного реагента, то «–»)
Среднюю скоростьопределяют по
изменению количества (![]() n)
или концентрации (
n)
или концентрации (![]() C)
вещества за определенный временной
интервал (
C)
вещества за определенный временной
интервал (![]() t):
t):
Vср. = ±![]() С/
С/![]() t
t
П о
результатам измерений концентраций во
времени строят так называемыекинетические
кривые. Например, в ходе реакцииА
Вконцентрация
реагентаАуменьшается, а реагентаВ– увеличивается (рисунок
4.4.1).
о
результатам измерений концентраций во
времени строят так называемыекинетические
кривые. Например, в ходе реакцииА
Вконцентрация
реагентаАуменьшается, а реагентаВ– увеличивается (рисунок
4.4.1).

Рисунок 4.4.1 – Типичные кинетические кривые для исходного веществаАи продукта реакцииВ
С помощью кинетической кривой можно графически определить мгновенную скорость, в момент времениtх: для этого потребуется восстановить перпендикуляр от оси абсцисс в т.txдо пересечения его с кинетической кривой и провести касательную к точке пересечения. Тангенс угла наклона касательной и есть мгновенная скорость (V=dс/dt).
Влияние концентраций реагирующих веществ на скорость химической реакции. Закон действующих масс
Зависимость скорости реакции от концентрации реагирующих веществ показывает кинетическое уравнение(уравнение кинетической кривой).
Например, для условной реакции aA+bB![]() dD+fFкинетическое уравнение можно представить
в следующем виде:
dD+fFкинетическое уравнение можно представить
в следующем виде:
|
V = kСx(A)Сy(B) |
(4.4.1) |
Уравнение (4.4.1) часто называют законом действующих масс, который для элементарных реакций сформулировали К.Гульдберг и П.Вааге.
Коэффициент k,входящий в уравнение (4.4.1), называютконстантой скорости реакции. Константа скорости реакции зависит от природы реагирующих веществ и температуры. Посколькуk=Vпри С = 1 моль/л, то ее иногда называютудельной скоростью.
Обратите внимание на то, что в большинстве случаев стехиометрические коэффициенты в уравнении реакции не отражают истинного механизма реакции. По этой причине показатели степеней (x, y) при концентрациях в уравнении (4.4.1) очень редко соответствуют стехиометрическим коэффициентам (в отличие от закона действующих масс применительно к химическому равновесию).
Показатели степеней x, yпри концентрациях реагентовАиВв уравнении (4.4.1) называютпорядком реакции по веществу Аи веществуВ,соответственно, асумму (x + y) называют общим порядком реакции.
Порядок химической реакции, как по отдельным реагентам, так и общий, определяют экспериментально. По этим данным составляют кинетические уравнения. В зависимости от суммы (x + y) различают реакциинулевого,первого, второго или третьего порядка. (Реакции более высоких порядков не встречаются; поэтому в случае, если сумма стехиометрических коэффициентов в уравнении реакции превышает три, то это заведомо многостадийная реакция).
Скорость большей части реакций описывается кинетическим уравнением первого порядка: dС/dt=ktили в интегральной форме:
|
С = С0exp(–kt) |
(4.4.2) |
Если интересен расчет не концентрации на определенное время t, а изменение концентрации, то уравнение (4.4.2) преобразуют в более удобное:
|
ln(С0/С) = kt |
(4.4.3) |
Время полуреакции (t½) – это время, за которое количество вещества (или число его частиц, или масса, или его молярная концентрация) уменьшается вдвое. Из уравнения (5) легко вывести, что при с0/c= 2
|
t½ = ln2/k = 0,693/k |
(4.4.4) |
Определение времени полуреакции – это один из способов определения порядка реакции: если реакция протекает наполовину за время, соответствующее уравнению (4.4.4), то это реакция первого порядка (другие варианты определения порядка реакции будут рассмотрены при изучении физической химии).
К числу реакций первого порядка относятся и реакции радиоактивного распада.Для них время полуреакции обычно называютпериодом полураспада.Это время, за которое распадается половина вещества (по химическому количеству, массе или активности). Периоды полураспада (t½) различных радиоизотопов приведены в справочниках. Знаяt½, по уравнению (4.4.4), легко рассчитать константу скорости распада, а затем по уравнениям (4.4.2) или (4.4.3) – изменение количества вещества или егоактивности (А):
|
A = A0 ∙exp(– k∙t), |
(4.4.5) |
где А0 – это начальная активность вещества,А– активность на времяt.
За единицу «активности» традиционно принимают 1Кюри = = 3,81010 распадов/с; в СИ активность измеряют в Беккерелях (Бк): 1Ku= = 3,371010Бк.
Пример: период полураспада изотопа14С равен 5730 лет. При археологических раскопках нашли дерево, в котором содержание14С составило 56 % от нормального. Каков возраст дерева (с)?
Решение
Поскольку в условии дано соотношение масс углерода, то кинетическое уравнение удобнее выразить через массы веществ:
![]()
1) Рассчитаем k=ln2/t½ = 3,810–12
2) Рассчитаем t=ln(1/0,56)/3,810–12= 1,521011
Ответ: с = 4800 лет.
Влияние температуры на скорость химической реакции. Уравнение Аррениуса
Согласно эмпирическому правилу Вант-Гоффа, скорость большинства химических реакций увеличивается в 2÷4 раза при повышении температуры на каждые 10 градусов:
VT2/VT1 = γ(T+10)/T, где γ = 2÷4 – температурный коэффициент реакции.
Довольно часто, особенно в учебной литературе по химии для средней школы, влияние температуры на скорость химической реакции объясняют тем, что при увеличении температуры увеличивается скорость движения частиц, вследствие этого увеличивается вероятность их столкновения и вероятность реакции между ними. Вроде бы логично.
Однако из молекулярно-кинетической теории газов известно, что средняя скорость движения молекул пропорциональна корню квадратному из абсолютной температуры. Так, если температуру увеличить с T1 = 298KдоT2 = = 398K, то увеличение средней скорости движения молекул составит:
![]() =
1,15, т.е. всего 15 %.
=
1,15, т.е. всего 15 %.
Если реакция между этими молекулами характеризуется температурным коэффициентом γ = 2, то при том же увеличении температуры на 100 градусов скорость реакции должна увеличиться: V398/V298 = 210 = 1024 раза.
Как видно, при увеличении температуры скорость реакции увеличилась многократно больше по сравнению с увеличением скорости движения молекул. Из этого следует очевидный вывод: увеличение скорости движения молекул – не единственная и совсем не основная причина увеличения скорости реакции; здесь действует еще какой-то важный фактор.
Зависимость скорости реакции от природы реагирующих частиц. Понятие об активных частицах, активных соударениях и энергии активации
В приведенных выше расчетах сравнивались средние скороститеплового движения молекул в зависимости от температуры. В то же время, если число частиц велико, то по законам статистики реальное распределение частиц по скоростям в зависимости от температуры будет другим (рисунок 4.4.2).

Рисунок 4.4.2 – Распределение частиц по кинетической энергии при различных температурах: 1 – при Т1, 2 – при Т2, 3 – прим Т3; Т1< Т2< Т3; Е1– наиболее вероятная энергия при температуре Т1
В молекулярно-кинетической теории газов распределение частиц по энергии в зависимости от температуры описывается уравнением Больцмана: N=N0exp(–Ea/RT), гдеN– число частиц с энергией, равной и большей, чем Еа.
Общее число частиц в системе (N0) равно площади под кривой. При температуре Т1 максимальной энергией Е1обладаютN1частиц. Общее число частиц с энергией меньше, чем Е1, равно площади левее от вертикали Е1, а частиц с энергией большей, чем Е1– правее этой вертикали.
Из рисунка 4.4.2 видно, что при увеличении температуры распределение частиц по энергии меняется так, что увеличивается доля частиц с большей энергией (кривая распределения смещается вправо, в область больших Е).
Если для химического взаимодействиячастиц необходимо, чтобы они имели энергиюЕа и более, то из рисунке 4.4.2 видно, что при температуре Т1доля таких частиц незначительна, а при температуре Т3таких частиц примерно 30 %.
В 1889 г. С.Аррениус показал, что уравнением, аналогичным (4.4.5), можно связать с абсолютной температурой константу скорости химической реакции:
|
k = A∙exp(– Ea/RT) |
(4.4.6) |
Из уравнения Аррениусаследует, что скорость реакции определяется не общим числом столкновений частиц, а только столкновением частиц с энергией, равной и превышающей Еа.
Почему не всякое столкновение ведет к химической реакции? Для ответа на этот вопрос вспомним, что образование новых химических связей – результат перераспределения электронной плотности между атомами, а для этого необходимо перекрывание электронных (одноименно заряженных) оболочек. Чем более «жестки» электронные оболочки сталкивающихся частиц, тем больший энергетический барьер потребуется преодолеть частицам для химического взаимодействия. Именно по этой причине при низких температурах малы скорости реакций с участием молекулярных кислорода и азота.
Кроме того, в химических реакциях, например, в растворах электролитов, в реакциях могут участвовать ионы, в том числе и одноименно заряженные. С рассмотренных выше позиций становится понятным, почему реакции ионного обмена с участием противоположно заряженных частиц протекают практически мгновенно, а окислительно-восстановительная реакция между анионами MnO4–иC2O42–без нагревания идет очень медленно.
Энергию, которой должны обладать частицы при столкновении, чтобы оно привело к химической реакции, называютэнергией активации (Еа в уравнении (4.4.6).
Частицы, обладающие такой энергией, называют активными.Зависимость скорости химической реакцииот природыреагирующих частиц отражается через величину энергии активации: чем меньше энергия активации, тем больше константа и тем больше скорость реакции. Для реакций, протекающих с заметной скоростью, энергия активации не превышает 50 кДж/моль (для реакций ионного обменаEa 0); еслиEa > 100 кДж/моль, то скорость реакции неизмеримо мала.
Увеличение числа активных частиц при повышении температуры и является основной причиной увеличения скорости химической реакции. Количественно эту зависимость можно вывести из уравнения Аррениуса:
|
ln(kT2/kT1) = Ea(1/T1 – 1/T2)/R |
(4.4.7) |
Катализ. Понятие об активированном комплексе
Катализ – это ускорение химической реакции за счет введенного дополнительно вещества – катализатора, которое по окончании реакции остается в исходном состоянии и количестве.
Если уравнения (4.4.1) и (4.4.6) объединить в одно, то получим уравнение, отражающее зависимость скорости реакции от всех факторов:
|
V = Aexp(– Ea/RT)Cx(A)Cy(B) |
(4.4.8) |
– от природы реагирующих веществ – через Ea;
– от концентрации реагирующих веществ;
– от температуры.
За счет чего катализатор может изменить (иногда – в тысячи раз) скорость реакции? Если учесть, что его добавляют в очень незначительных количествах, по сравнению с основными реагентами, то, очевидно, что за счет изменения концентрации реагентов или их температуры катализатор не может влиять на скорость реакции. Остается один вариант – при введении катализатора уменьшается энергия активации.
Энергия активации зависит от природы реагирующих веществ, следовательно, катализатор изменяет путь реакции, ее промежуточные стадии, образуя какие-то новые промежуточные продукты с меньшей энергией активации (рисунок 4.4.3).
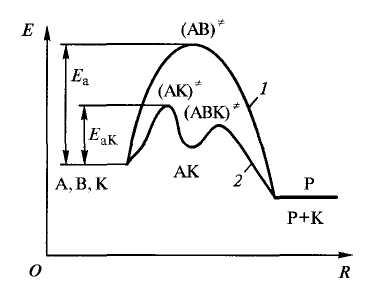
Рисунок 4.4.3 – Изменение пути химической реакции в присутствии катализатора: 1 – путь реакции без катализатора; 2 – путь реакции с атализатором; А, В – исходные вещества, К – катализатор, АК, АВК – «активированные комплексы», АК – промежуточный продукт, Р – конечный продукт.
Схему катализа можно представить следующим образом: если без катализатора продукт Dобразуется из веществАиВв соответствии с уравнением А + В =D, то при введении катализатораК путь реакции меняется:
A + B + K AK + B AKB D + K
Хорошо известен пример окисления сернистого ангидрида в серный, катализируемого оксидом азота(II). Без катализатора окислениеSO2идет очень медленно (особенности молекулярного кислорода как окислителя обсуждались нами ранее).
При введении в реакционную смесь NOокисление протекает в две стадии: сначала кислородом окисляетсяNO: 2NO+O2 = 2NO2,
далее NO2 реагирует с SO2: NO2 + SO2 = SO3 + NO
В примере NO2выполняет роль промежуточного продукта; на второй стадии реакции из него «регенерируется» в исходной форме катализаторNO.
Примечание:на самом деле первая реакция, образованиеNO2, не одно-, а двустадийная. В ней участвуют не две изолированные молекулыNO, а димер:
2NON2O2,
далее димер окисляется молекулярным кислородом: N2O2 +O2 = 2NO2.
Таким образом, окисление NOмолекулярным кислородом – не одностадийная тримолекулярная реакция, а комбинация двух последовательных бимолекулярных реакций. Без этого уточнения был бы необъясним известный факт, чтоскорость окисления NO кислородом уменьшается с увеличением температуры.
В качестве другого примера катализа, применяемого в промышленности, можно рассмотреть синтез ацетальдегида. Пример особо интересен тем, что процесс был сначала сконструирован «на кончике пера». Так, еще в 1894 г. было установлено, что этилен восстанавливает влажный PdCl2до металлического палладия, при этом среди продуктов обнаружили ацетальдегид:
|
PdCl2 + C2H4 + H2O = Pd + CH3CHO + 2HCl |
(а) |
С другой стороны, было известно, что металлический палладий окисляется катионами Cu2+:
|
2CuCl2+Pd= 2CuCl+PdCl2 |
(б) |
И, наконец, известно, что CuClв кислых растворах легко окисляется кислородом:
|
2CuCl + 0,5O2 + 2HCl = 2CuCl2 + H2O |
(в) |
В результате (а) + (б) + (в) получили:
PdCl2 + C2H4 + H2O + 2HCl + 2CuCl2 + 0,5O2 =
= PdCl2 + CH3CHO + H2O + 2HCl + 2CuCl2
PdCl2/CuCl2
C2H4+ 0,5O2—CH3CHO–изящный каталитическийпроцесс
Сейчас эта реакция, «сконструированная» в МИТХТ им. М. В. Ломоносова, является лучшим промышленным способом получения ацетальдегида (Вакер–процесс).
Автокатализ – это ускорение химической реакции продуктами этой реакции. В качестве примера можно рассмотреть окисление оксалатов перманганат-ионами в кислой среде. С точки зрения кинетики протекание реакции на первый взгляд неожиданно: по мере расходования реагентов скорость реакции не уменьшается, а увеличивается (до определенной величины). Причина в том, что эта реакция катализируется ионамиMn2+– одним из продуктов этой реакции:
2MnO4- + C2O42- + 8H+ = 2Mn2+ + 2CO2 + 4H2O
Если к раствору оксалата изначально добавить небольшое количество соли Mn2+, то скорость реакции будет заметно больше уже «со старта».
Окисление молекулярным кислородом гидроксидов некоторых d-металлов (Fe2+,Mn2+,Co2+и др.) интересно тем, что эти гидроксиды сами катализируют собственное окисление.
Гомогенный и гетерогенный катализразличаются по фазовому состоянию реагентов и катализатора. Если катализатор образует единую фазу с реагентами, то это гомогенный катализ (см. выше примеры катализа окисленияSO2 в газовой фазе и оксалатов в водном растворе). Если катализ протекает на границе раздела фаз – то это гетерогенный катализ.
Важнейшей характеристикой катализатора является его селективность (избирательность).Это свойство катализатора ускорять не все реакции, а только определенные, в идеале – одну единственную. Такие варианты катализа чаще всего реализуются в живых системах с помощью так называемыхбиокатализаторов.
