
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Влияние давления на равновесие
Давление в замкнутой реакционной системе обусловлено наличием в ней газообразных веществ: чем их больше, тем больше давление. Поэтому изменение внешнего давления повлияет на равновесие только в тех случаях, когда в нем участвуют газообразные вещества, причем количество их в прямой и обратной реакциях разное.
Если в системе, находящейся в состоянии химического равновесия, увеличить давление, то преимущественно будет протекать реакция, в результате которой уменьшается количество газообразных веществ; при уменьшении давления преимущественно протекает реакция, в результате которой увеличивается количество газообразных продуктов.
Пример 1. Можно ли изменением давления увеличить выход продуктов в реакцииCO2(г)+H2(г) CO(г)+H2O(г)?
Решение: реакционная смесь включаетгазообразныереагенты, ноколичество их в реакции не меняется: из одного моляCO2(г)и одного моляH2(г) получаются по одному молюCO(г)иH2O(г).По этой причине изменение давления на состояние равновесия не влияет.
Пример 2. Как изменятся равновесные концентрации реагентов при увеличении давления в системе 2SO2(г)+O2(г)2SO3(г)?
Решение: реакционная смесь включаетгазообразные вещества,иколичество их в реакции меняется: из трех моль исходных (двух мольSO2(г)и одного моляO2(г)) образуются два моляSO3(г).
При увеличении давления должна преимущественно протекать реакция, в результате которой давление уменьшится, т.е. уменьшится количество газообразных веществ, а это происходит в прямой реакции. Следовательно, концентрации исходных веществ уменьшатся, а продукта – увеличатся.
К аналогичному выводу можно прийти,
анализируя закон действующих масс
(з.д.м.) для этого равновесия: 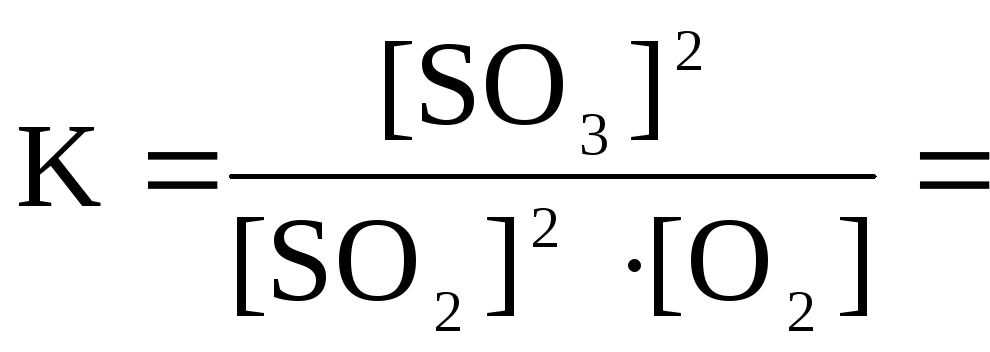
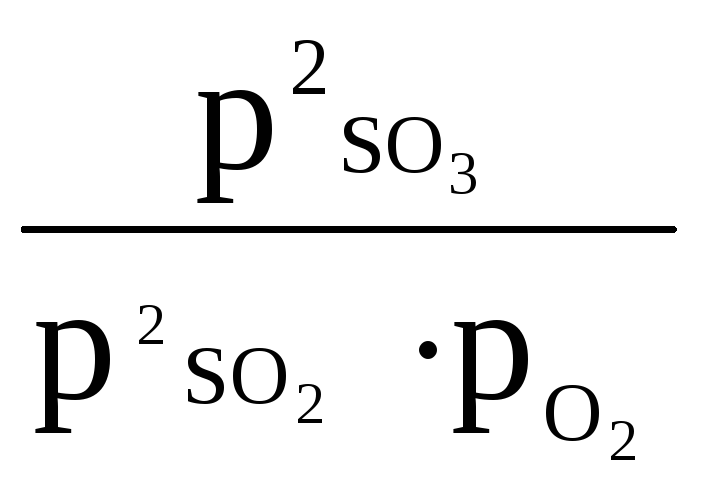
При увеличении давления, например, в два раза, числитель дроби увеличится в четыре раза (22), а знаменатель дроби увеличится в восемь раз (22∙2). Равновесие нарушится, и для того, чтобы соотношение реагентов соответствовало з.д.м. (т.е. константа осталась прежней), концентрацииSO2 иO2 должны уменьшаться, а концентрацияSO3 – увеличиваться, а для этого должна преимущественно протекать прямая реакция.
Пример 3. Как изменится состояние равновесия в системе
2SO2(г)+O2(г)2SO3(г), если в неедобавитьинертныйгаз?
Решение: влияние инертного газа на равновесия с участием газообразных веществ следует рассматривать в двух вариантах.
1) Если при добавлении инертного газа объем системы не изменился, и поэтому давление увеличилось.
Поскольку объем не изменился, то не изменились и концентрации реагентов, следовательно, равновесие не нарушится.
2) Если при добавлении газа давление в системе не изменилось, т.к. увеличился объем смеси.
В этом случае добавка газа повлияет на равновесие как эффект уменьшения в равное число раз концентраций (и парциальных давлений) всех реагентов, поэтому равновесие может нарушиться, если до реакции и после количество газов разное (как в нашем случае). Например, при увеличении объема вдвое концентрации (и парциальные давления) всех реагентов уменьшатся в два раза. Для того чтобы соотношение реагентов соответствовало з.д.м., преимущественно должна протекать обратная реакция, и равновесие сместится влево.
Влияние изменения температуры на химическое равновесие
Большинство химических реакций протекают с выделением или поглощением тепла. В первом случае температура смеси увеличивается, во втором – уменьшается.
Если реакционную смесь, находящуюся в состоянии химического равновесия, нагреть, то в соответствии с принципом Ле Шателье должна протекать преимущественно реакция, в результате которой тепло будет поглощаться, т.е. эндотермическая реакция; при охлаждении смеси должна протекать преимущественно реакция, в результате которой тепло будет выделяться, т.е. эндотермическая реакция.
Если в системе, находящейся в состоянии химического равновесия, увеличить температуру, то равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
Пример: 2N2+ 3H22NH3,![]() H0= – 92 кДж
H0= – 92 кДж
Реакция экзотермическая, поэтому при увеличении температуры равновесие сдвигается влево, а при понижении температуры – вправо.
Из этого следует, что для увеличения выхода аммиака температуру необходимо понижать. (Почему же тогда синтез аммиака ведут при температуре 5000С? – см. раздел «Химическая кинетика»).
