
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
5 Общие свойства растворов. Идеальные растворы. Законы Рауля
Идеальнымназывают раствор, образованный веществами, имеющими строго равные размеры частиц и строго одинаковую энергию взаимодействия между ними. Все растворы обладают некоторыми свойствами, которые зависят практически только от соотношения частиц в растворе. Например, во всех растворах наблюдается явление, называемое диффузией.
Д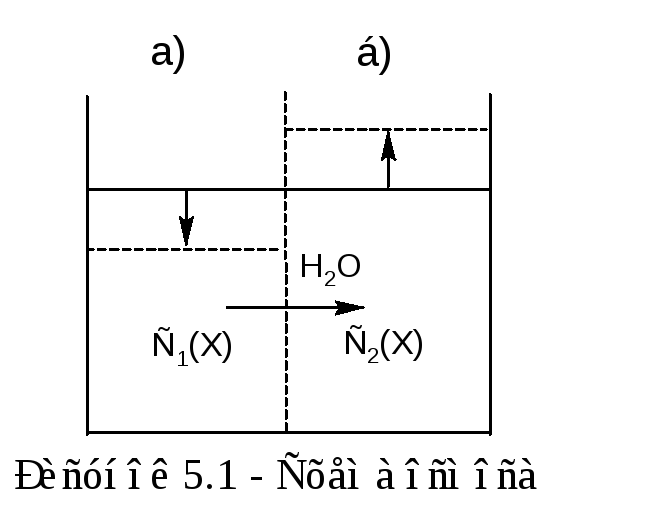 иффузиейназывают свойство вещества равномерно
распределяться по всему предоставленному
ему объему. Например, если в склянку
налить раствор какого-то вещества, а
затем поверх этого раствора – чистый
растворитель, то диффузия будет
двусторонней: частицы растворителя
будут диффундировать в раствор, а им
навстречу будут диффундировать частицы
растворенного вещества. В результате
концентрация растворенного вещества
станет одинаковой по всему объему
раствора.
иффузиейназывают свойство вещества равномерно
распределяться по всему предоставленному
ему объему. Например, если в склянку
налить раствор какого-то вещества, а
затем поверх этого раствора – чистый
растворитель, то диффузия будет
двусторонней: частицы растворителя
будут диффундировать в раствор, а им
навстречу будут диффундировать частицы
растворенного вещества. В результате
концентрация растворенного вещества
станет одинаковой по всему объему
раствора.
Предыдущий эксперимент можно организовать так, что диффузия будет протекать только в одном направлении (рисунок 5.1).
Разделим склянку на две части полупроницаемой перегородкой, например, целлофановой пленкой, способной пропускать молекулы растворителя, но не пропускающей частицы растворенного вещества (на рисунке 5.1 она показана пунктиром). В обе части нальем растворы с разной молярностью (один из растворов может быть и чистым растворителем).
Если С1(Х)С2(Х), то концентрации будут выравниваться вследствие движения растворителя слева направо.
Одностороннюю диффузию растворителя через полупроницаемую перегородку называют осмосом.
Если к правой части (к раствору) приложить внешнее давление, то осмос можно уменьшить, предотвратить и даже сделать обратным. Давление, необходимое для предотвращения осмоса, называют осмотическим давлением.
Уравнение для расчета осмотического давления было предложено Вант-Гоффом, который преобразовал уравнение для идеальных газов PV=nRTв следующее:
|
Pосм = СRТ, |
(5.1) |
где Pосм – осмотическое давление;C– молярная концентрация растворенного вещества;R– универсальная газовая постоянная;T– абсолютная температура.
Таким образом, осмотическое давление разбавленных идеальных растворов численно равно тому давлению, которое оказывало бы растворенное вещество, если бы при данной температуре оно в виде газа занимало объем, равный объему раствора.
Например, если С = 1 моль/л, то его осмотическое давление будет равно 2,24106Па (22,4 атм).
Следующим общим свойством растворов является понижение давления насыщенного пара растворителя над растворомпо сравнению с чистым растворителем. Количественную связь между концентрацией летучего компонента раствора и давлением его пара установил Рауль.
Первый закон Рауля: при постоянной температуре относительное понижение давления насыщенного пара над раствором по сравнению с чистым растворителем прямо пропорционально мольной доле растворенного вещества:
|
(P0 – P)/P0 = n(X)/[n(X) + n(S)], |
(5.2) |
где P0 – давление насыщенного пара растворителя (S);
P– давление насыщенного пара над раствором;
n(X) – количество растворенного вещества, моль;
n(S) – количество растворителя, моль.
Понижение давление насыщенного пара растворителя над раствором является причиной повышения температуры кипения растворапо сравнению с чистым растворителем.
Второй закон Рауля:Повышение температуры кипения раствора по сравнению с чистым растворителем прямо пропорционально моляльности раствора:
|
|
(5.3) |
где T0– температура кипения растворителя;
Tкип– температура кипения раствора;
m(X) – масса растворенного вещества, г;
M(X) – молярная масса растворенного вещества, г/моль;
m(S) – масса растворителя, г;
Kкип– эбуллиоскопическая постоянная (константа) растворителя.
Если моляльность раствора равна 1
моль/кг, то Kкип=![]() Ткип,
поэтому эбуллиоскопическую константу
называют также молярным повышением
температуры кипения.
Ткип,
поэтому эбуллиоскопическую константу
называют также молярным повышением
температуры кипения.
Также вследствие понижения давления пара над раствором понижаетсятемпература замерзания растворапо сравнению с чистым растворителем.
Третийзакон Рауля:Понижение температуры замерзания раствора по сравнению с чистым растворителем прямо пропорционально моляльности раствора:
|
|
(5.4) |
гдеT0– температура замерзания растворителя;
Tзам– температура замерзания раствора;
m(X) – масса растворенного вещества, г;
M(X) – молярная масса растворенного вещества, г/моль;
m(S) – масса растворителя, г;
Kзам – криоскопическая постоянная (константа) растворителя.
Если моляльность раствора равна 1
моль/кг, то Kзам=![]() Тзам,
поэтому криоскопическую константу
называют также молярным понижениемтемпературы кипения.
Тзам,
поэтому криоскопическую константу
называют также молярным понижениемтемпературы кипения.
Постоянные растворителя (Ккипи
Кзам) определяют экспериментально
или рассчитывают по уравнениюK=![]() ,
,
где Т – температура кипения (замерзания)
растворителя;
![]() H– удельная скрытая теплотаиспаренияили удельная теплотаплавления (Дж/г)
растворителя, соответственно.
H– удельная скрытая теплотаиспаренияили удельная теплотаплавления (Дж/г)
растворителя, соответственно.
Эбуллиоскопические и криоскопические постоянные многих растворителей приводятся в справочниках. В таблице 6.1 приведены температуры кипения, замерзания и эбуллиоскопические (криоскопические) константы некоторых из них.
Таблица 6.1 – Температуры кипения, замерзания и эбуллиоскопические (криоскопические) константы некоторых растворителей
|
Вещество |
Вода |
Бензол |
Диэтиловый эфир |
Хлороформ |
|
Tкип.0C |
100,0 |
80,1 |
35,6 |
61,2 |
|
Ккип.0C |
0,512 |
2,67 |
2,11 |
3,89 |
|
Tзам. 0C |
0,0 |
5,5 |
– 116,3 |
– 63,5 |
|
Кзам.0C |
1,86 |
5,12 |
1,79 |
4,90 |
Законы Рауля применяют для определения молярной массы растворенного вещества.
Пример: раствор, содержащий 0,512 г серы в 10 г сероуглерода, кипит при температуреTкип= 46,670C. Температура кипенияCS2равнаT0= 46,20С;KCS2= 2,34 град. Из скольких атомов состоят молекулы серы в этом растворе?
Решение:из![]() Tкип
=Tкип–T0=Kкип
Tкип
=Tкип–T0=Kкип![]()
M(Sx)
=Kкип![]() = 2,340,5121000/(46,67
– 46,2)10= 256 г/моль,
= 2,340,5121000/(46,67
– 46,2)10= 256 г/моль,
следовательно, х = 8 (S8).
Применяя законы Рауля в лабораторном практикуме по «Физхимии полимеров», вы будете определять молярные массы и степень полимеризации ваших образцов.
