
- •Теоретические основы химии
- •Введение
- •1 Количество вещества в химических и инженерных расчетах. Концентрация растворов
- •Основные понятия и определения
- •Основные типы задач
- •Тогда в полученном растворе
- •2 Строение атома. Периодический закон и таблица элементов д.И.Менделеева
- •3 Химическая связь
- •Из таблицы 3.1 видно, что:
- •Кратность химической связи
- •Направленность ковалентной связи. Гибридизация орбиталей
- •Насыщаемость ковалентной связи
- •Поляризуемость ковалентной связи
- •Межмолекулярное взаимодействие
- •4 Общие закономерности протекания химических реакций
- •4.1 Тепловой эффект химической реакции. Понятие об энтальпии
- •Тогда для изобарного процесса
- •Закон Гесса: тепловой эффект реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от пути перехода (т.Е. От числа промежуточных стадий).
- •4.3 Химическое равновесие
- •Влияние давления на равновесие
- •Расчет материального баланса в состоянии химического равновесия
- •4.4 Основы химической кинетики
- •5 Общие свойства растворов. Идеальные растворы. Законы Рауля
- •6 Растворы электролитов. Электролитическая диссоциация.
- •Если в раствор добавить, например гидроксид натрия
- •7 Гидролиз солей
- •8 Гетерогенные равновесия в растворах электролитов. Произведение растворимости
- •Влияние pH на растворимость электролитов
- •9 Комплексные соединения
- •10 Ионно-молекулярные (обменные) реакции в водных растворах электролитов
- •Примеры
- •Преимущественное направление ионно-молекулярных реакций
- •Получение заданного вещества реакцией обмена
- •11 Окислительно-восстановительные свойства веществ.
- •Определение возможности окислительно-восстановительных реакций по степеням окисления элементов
- •Окислители –пероксиды
- •Восстановители-металлы (простые вещества)
- •Составление материального баланса в полуреакциях
- •Примеры
- •Примеры
- •Примеры
- •Комплексные соединения в окислительно-восстановительных реакциях Примеры
- •Электронный баланс в полуреакциях
- •12 Электрохимические реакции
- •Уравнение Нернста для металлического электрода
- •Электрохимический ряд металлов
- •13 Коррозия металлов
- •Электролиз
- •Материальный баланс электрохимических реакций. Законы Фарадея
- •Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
- •Список литературы
- •Теоретические основы химии
- •212027, Могилев, пр-т Шмидта, 3
Материальный баланс электрохимических реакций. Законы Фарадея
Законы Фарадея – это частный случай применения закона эквивалентов к электрохимическими реакциям, в которых одним из «реагентов» оказываются электроны. В общем виде этот закон можно описать следующим уравнением:
|
|
(14.1) |
где Х – вещество, окисленное или восстановленное при электролизе;
m(X) – масса этого вещества в граммах;
M(X) – молярная масса этого вещества;
fэкв– фактор эквивалентности вещества (определяется по уравнению реакции);
I– сила тока (в Амперах или Кулон/с);
Ze– заряд электрона (1,6·10–19 Кулон);
NA – число Авогадро (6,02·1023 моль–1);
τ– время электролиза (в секундах).
Таким образом, закон эквивалентов применительно к электрохимическим реакциям можно сформулировать следующим образом: сколько моль электронов участвовало в реакции, столько же моль эквивалента вещества окислится на аноде и восстановится на катоде.
В числителе правой части уравнения
(14.1) произведение I·τ– это величина заряда (Кл), пропущенного
через электролит, а в знаменателеZe·NA– это заряд одного моля электронов:
1,6·10–19·6,02·1023= 96484![]() 96500
Кл/моль –число Фарадея.
96500
Кл/моль –число Фарадея.
Если в реакции восстанавливаются (окисляются) металлы, то уравнение (14.1) преобразуется в следующее:
|
|
(14.2) |
Если в реакции окисляются или восстанавливаются газообразные вещества, то получим уравнение:
|
|
(14.3) |
V(X) – объем газа, л;
Vm – молярный объем.
Пример 1. Рассчитать массу меди, выделившуюся на катоде при электролизе раствора сульфата меди в течение 2 часов при силе тока в 100 А.
Решение: Cu2++ 2e Cu,fэкв = ½
Согласно уравнению (14.2)
![]() =
=
![]() ,
,
тогда m(Cu)
=![]() = 118,4 г
= 118,4 г
Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
Решение: 2Cl–Cl2+ 2e,fэкв = 1/2
Согласно уравнению (3)
![]() =
=
![]() ,
,
тогда
![]() сек.
сек.
Химические источники электрической энергии (ХИЭЭ)
Все ХИЭЭ подразделяются на источники однократного действия –«элементы» – и многократного действия – «аккумуляторы».
Разработано довольно много вариантов элементов; из них наиболее распространенными являются маргацево-цинковые элементы, схема устройства которых показана на рисунке 15.1.
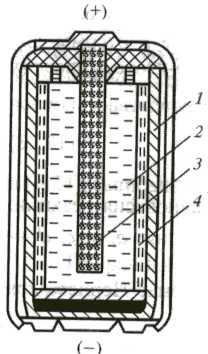
Рисунок 15.1 – Схема марганцево-цинкового элемента:
1 – анод (корпус, изготовленный из цинка);
2 – катод (диоксид марганца в смеси с графитовым порошком, для увеличения электропроводности);
3 – токоотвод из графита;
4 – электролит (паста из хлорида аммония в смеси с загустителем (крахмал или др.).
Анод (–):Zn=Zn2++ 2e, далееZn2++ 4NH4+= [Zn(NH3)4]2++ 4H+
Катод (+): MnO2 + H+ + e = MnO(OH)
________________________________________________________
![]() : 2Zn
+ 4MnO2
+ 4NH4Cl
= [Zn(NH3)4]Cl2
+ZnCl2
+ 4MnO(OH)
: 2Zn
+ 4MnO2
+ 4NH4Cl
= [Zn(NH3)4]Cl2
+ZnCl2
+ 4MnO(OH)
Аккумуляторы
Аккумуляторами называют устройства, позволяющие многократное повторение операций их зарядки-разрядки. В принципе регенерировать можно любое электрохимическое устройство, но при этом восстановленная емкость обычно невелика. В аккумуляторах эти операции можно повторять многократно. Наиболее распространены кислотные свинцовые, щелочные никель-кадмиевые и серебряно-цинковые аккумуляторы.
Свинцовый аккумулятор
Электроды свинцового аккумулятора выполнены в виде ячеистых пластин из свинцового сплава; ячейки заполнены смесью свинцового глета (PbO) с глицерином. После заполнения аккумулятора электролитом (H2SO4) оксид свинца превращается в сульфат.
Зарядка аккумулятора (преобразование электрической энергии в энергию химической реакции): при подключении электродов к внешнему источнику постоянного тока одни из них поляризуются катодно (–) и на нем протекает реакция восстановления свинца (II), другой – анодно (+), и на нем свинец (II) окисляется:
Катод (–): PbSO4 + 2e = Pb + SO42-
Анод (+): PbSO4 + 2H2O = PbO2 + SO42- + 4H+ + 2e
______________________________________________________________________
![]() :
2PbSO4+ 2H2O=Pb+PbO2+ 2H2SO4
:
2PbSO4+ 2H2O=Pb+PbO2+ 2H2SO4
ЭДС заряженного аккумулятора – около 2 В. Из суммарного уравнения реакции видно, что одним из продуктов реакции является серная кислота, поэтому при зарядке аккумулятора концентрация электролита увеличивается (по изменению плотности электролита контролируют степень заряженности аккумулятора).
Разрядка аккумулятора – это превращение энергии окислительно-восстановительной реакции в электрическую энергию. При замыкании внешней цепи электроны с анода (Pb) переходят на электроды, заполненыеPbO2(катод):
Катод (–): PbO2 + SO42– + 4H+ + 2e = PbSO4 + 2H2O
Анод (+): Pb + SO42- = PbSO4 + 2e
______________________________________________
![]() :Pb+PbO2+ 2H2SO4= 2PbSO4+ 2H2O
:Pb+PbO2+ 2H2SO4= 2PbSO4+ 2H2O
Из полученного уравнения видно, что при разрядке аккумулятора плотность электролита уменьшается (на этом основан один из простых методов контроля заряда аккумулятора).
К основным преимуществам свинцового аккумулятора относятся большая электрическая емкость (А∙час/кг) и устойчивость в работе при многократных циклах перезарядки. Основные недостатки – массивность и негерметичность.
Кадмиево-никелевый аккумулятор
Схема его работы может быть показана следующими превращениями:
разряд
2NiO(OH) +Cd2Ni(OH)2+Cd(OH)2, ЭДС = 1,4 В
заряд
Серебряно-цинковый (СЦ) аккумулятор
Вследствие большой удельной емкости и большой ЭДС эти аккумуляторы чаще всего применяются для питания различных микроэлектронных устройств. Их работа основана на следующих окислительно-восстановительных реакциях:
разряд
AgO+Zn+H2OAg+Zn(OH)2
заряд
Применение электролиза
Электрохимическое получение металлов (алюминий, щелочные и щелочноземельные металлы и др.); рафинирование (очистка) металлов; гальванопластика и гальваностегия; электрохимическая обработка поверхностей металлов.
Химические источники электрической энергии
Устройства непрерывного действия, в которых энергия химического окисления топлива непосредственно превращается в электрическую энергию, называют химическими источниками электрического тока или топливными элементами.
В качестве восстановителя (топлива) в таких элементах используют водород, окись углерода, метан и др. органические вещества, а в качестве окислителя, чаще всего, – чистый кислород, иногда воздух. В настоящее время наиболее изучен водородно-кислородный топливный элемент, схема которого показана на рисунке 15.2.

Рисунок 15.2 – Схема водородно-кислородного топливного элемента:
1 – анод; 2 – электролит; 3 – катод
Катод и анод такого элемента изготовлены из пористого графита и катализатора – металла платиновой группы. На катоде восстанавливается кислород, а водород окисляется на аноде. В зависимости от выбранного электролита (щелочи или кислоты) электрохимические реакции можно описать следующими уравнениями:
В щелочной среде(электролит – гидроксид калия):
Анод:2H2+ 4OH–= 4H2O+ 4e
Катод:O2+ 2H2O+ 2e= 4OH–
_____________________________________________
![]() : 2H2+O2= 2H2O
: 2H2+O2= 2H2O
В кислой среде(электролит – фосфорная кислота):
Анод:2H2= 4H++ 4e
Катод:O2+ 4H++ 4e= 2H2O
_______________________________________________
![]() : 2H2+O2= 2H2O
: 2H2+O2= 2H2O
ЭДС такого элемента не зависит от pH:
![]()
П Р И Л О Ж Е Н И Е А
(справочное)
Таблица А.1 – Константы ионизации некоторых кислот и оснований
|
Название |
Формула |
Ступень ионизации |
К |
|
Азотистая кислота |
HNO2 |
|
6,9.10–4 |
|
Борная (орто) кислота |
H3BO3 |
I II III |
7,1.10–10 1,8.10–13 1,6.10–14 |
|
Бромноватистая кислота |
HBrO |
|
2,2.10–9 |
|
Иодноватистая кислота |
HIO |
|
2,3.10–11 |
|
Дихромовая кислота |
Н2Сr2O7 |
II |
2,3.10–2 |
|
Кремниевая (орто) кислота |
H4SiO4 |
I II |
1,3.10–10 1,6.10–12 |
|
Муравьиная кислота |
HCOOH |
|
1,8.10–4 |
|
Пероксид водорода |
H2O2 |
|
2,0.10–12 |
|
Селенистая кислота |
H2SeO3 |
I II |
1,8.10–3 3,2.10–9 |
|
Селеноводородная кислота |
H2Se |
I II |
1,3.10–4 1,0.10–11 |
|
Серная кислота |
H2SO4 |
II |
1,15.10–2 |
|
Сернистая кислота |
H2SO3 |
I II |
1,4.10–2 6,2.10–8 |
|
Сероводородная кислота |
H2S |
I II |
1,0.10–7 2,5.10–13 |
|
Синильная кислота |
HCN |
|
5,0.10–10 |
|
Угольная кислота |
H2CO3 |
I II |
4,5.10–7 4,8.10–11 |
|
Уксусная кислота |
CH3COOH |
|
1,7.10–5 |
|
Фосфористая кислота |
H3PO3 |
I II |
37,1.10–2 1,6.10–7 |
|
Фосфорная (орто) кислота |
H3PO4 |
I II III |
7,1.10–3 6,2.10–8 5,0.10–13 |
|
Фосфорноватистая кислота |
H3PO2 |
|
5,9.10–2 |
|
Фтороводородная кислота |
HF |
|
6,2.10–4 |
|
Хлорноватистая кислота |
HClO |
|
2,95.10–8 |
|
Хромовая кислота |
H2CrO4 |
I II |
1,6.10–1 3,2.10–7 |
|
Щавелевая кислота |
H2C2O4 |
I II |
5,6.10–2 5,4.10–5 |
|
Гидрат аммиака |
NH3∙H2O |
|
1,8.10–5 |
Таблица А.2 – Произведение растворимости ПР некоторых малорастворимых соединений
|
Соединение |
ПР |
Соединение |
ПР |
|
AgBr |
5,3.10–13 |
FeS2 |
6,3.10–31 |
|
Ag3PO4 |
1,3.10–20 |
Hg2Cl2 |
1,3.10–18 |
|
AgI |
8,3.10–17 |
HgS черн. |
1,6.10–52 |
|
Ag2SO4 |
1,6.10–5 |
Mg(OH)2 |
6,0.10–10 |
|
Ag2S |
6,3.10–50 |
MgCO3 |
8,8.10–5 |
|
AgCl |
1,8.10–10 |
Mg3(PO4)2 |
1,0.10–13 |
|
Ag2CrO4 |
1,1.10–12 |
MnCO3 |
2,0.10–11 |
|
Al(OH)3 |
1,0.10–32 |
Mn(OH)2 |
1,9.10–13 |
|
AlPO4 |
5,75.10–19 |
BiOCl |
7,0.10–9 |
|
BaF2 |
1,1.10–6 |
CaF2 |
4,0.10–11 |
|
BaSO4 |
1,1.10–10 |
CaCO3 |
4,8.10–9 |
|
BaCO3 |
5,1.10–9 |
CaC2O4 |
2,6.10–9 |
|
BaC2O4 |
1,1.10–7 |
CaSO4 |
9,1.10–6 |
|
Ba3(PO4)2 |
6,0.10–39 |
Ca3(PO4)2 |
2,0.10–29 |
|
BaCrO4 |
1,2.10–10 |
Ca(OH)2 |
5,5.10–6 |
|
Be(OH)2 |
6,3.10–22 |
CdCO3 |
1,0.10–12 |
|
Bi2S3 |
1,0.10–97 |
CdS |
7,93.10–27 |
|
Cu2S |
2,5.10–48 |
Cd(OH)2 |
2,2.10–14 |
|
FeC2O4 |
2,0.10–7 |
CoCO3 |
1,0.10–10 |
|
FeCO3 |
3,5.10–11 |
Co(OH)2 |
6,3.10–15 |
|
FePO4 |
1,3.10–22 |
Co(OH)3 |
4,0.10–45 |
|
Fe(OH)2 |
1,0.10–15 |
CoS |
4,0.10–21 |
|
Fe(OH)3 |
3,2.10–38 |
Cr(OH)3 |
6,3.10–31 |
|
FeS |
5,0.10–18 |
CrPO4 |
1,0.10–17 |
|
CuI |
1,1.10–12 |
PbCrO4 |
1,8.10–14 |
|
CuCO3 |
2,5.10–10 |
PbCO3 |
7,5.10–14 |
|
Cu(OH)2 |
2,2.10–20 |
PbCl2 |
1,6.10–5 |
|
(CuOH)2CO3 |
1,7.10–34 |
Pb(OH)2 |
5,0.10–16 |
|
CuS |
6,3.10–36 |
Sb2S3 |
1,0.10–30 |
|
Ni(C4H7O2N2)2 |
2,3.10–25 |
SbO(OH) |
1,0.10–17 |
|
Ni(OH)2 |
2,0.10–15 |
SnS |
1,0.10–27 |
|
NiCO3 |
1,7.10–7 |
Sn(OH)2 |
6,3.10–27 |
|
NiS |
1,0.10–24 |
ZnCO3 |
1,5.10–11 |
|
NiC2O4 |
4,0.10–10 |
Zn(OH)2 |
7,1.10–18 |
|
PbS |
2,5.10–27 |
ZnS сфалерит |
1,6.10–24 |
|
PbSO4 |
1,6.10–8 |
ZnS вюрцит |
2,5.10–22 |
|
PbI2 |
1,1.10–9 |
Zn3(PO4)2 |
9,1.10–33 |
Таблица А.3 – Нормальные электродные потенциалы (Е0) по отношению к потенциалу водородного электрода при 250С
|
Элемент |
Электродный процесс |
Ео, В |
|
Азот |
NO3– + 4H+ + 3ē ® NO + 2H2O |
+0,96 |
|
NO3– + 3H+ + 2ē ® HNO2 + H2O |
+0,94 | |
|
NO3– + 10H+ + 8ē ® NH4+ + 3H2O |
+0,87 | |
|
NO3– + 2H+ + ē ® NO2 + H2O |
+0,80 | |
|
NO3– + H2O + 2ē ® NO2– + 2OH– |
-0,01 | |
|
HNO2 + H+ + ē ® NO + H2O |
+0,98 | |
|
2HNO2 + 4H+ + 4ē ® N2O + 3H2O |
+1,29 | |
|
Алюминий |
Al3+ + 3ē ® Al |
-1,66 |
|
Бор |
H3BO3 + 3H+ + 3ē ® B +3H2O |
-0,87 |
|
Бром |
Br2 + 2ē ® 2Br– |
+1,09 |
|
HBrO + H+ + 2ē ® Br– + H2O |
+1,34 | |
|
BrO– + H2O + 2ē ® Br– + 2OH– |
+0,76 | |
|
2BrO3– + 12H+ + 10ē ® Br2 + 6H2O |
+1,52 | |
|
BrO3– + 6H+ + 6ē ® Br– + 3H2O |
+1,45 | |
|
2BrO3– + 6H2O + 10ē ® Br2+12OH– |
+0,50 | |
|
BrO3– + 3H2O + 6ē ® Br– + 6OH– |
+0,61 | |
|
Ванадий |
V3+ + ē ® V2+ |
-0.26 |
|
V2+ + 2ē ® V |
-1,18 | |
|
V3+ + 3ē ® V |
-0,87 | |
|
Висмут
|
BiO+ + 2H+ + 3ē ® Bi + H2O |
+0,32 |
|
Bi3+ + 3ē ® Bi |
+0,22 | |
|
BiO3– + 4H+ + 2ē ® BiO+ + 2H2O |
>+1,80 | |
|
Водород |
2Н++ 2ē®Н2 |
0,00 |
|
2Н2О + 2ē®Н2+ 2ОН– |
-0,83 | |
|
Железо |
Fe2++ 2ē®Fe |
-0,47 |
|
Fe3+ + ē ® Fe2+ |
+0,77 | |
|
Fe3+ + 3ē ® Fe |
-0,06 | |
|
Fe3O4 + 8H+ + 2ē ® 3Fe2+ + 4H2O |
+1,21 | |
|
Золото |
Au3+ + 3ē ® Au |
+1,50 |
|
Au3+ + 3ē ® Au+ |
+1,41 | |
|
[AuCl]4– + 3ē ® Au + 4Cl– |
+1,00 | |
|
Иод |
I2 + 2ē ® 2I– |
+0,54 |
|
2HIO + 2H+ + 2ē ® I2 + 2H2O |
+1,45 | |
|
IO3– + 6H+ + 6ē ® I- + 3H2O |
+1,08 | |
|
2IO– + 2H2O + 2ē ® I2 + 4OH– |
+0,45 | |
|
IO3– + 3H2O + 6ē ® I– + 6OH– |
+0,26 | |
|
2IO3– + 12H+ + 10ē ® I2 + 6H2O |
+1,19 | |
|
2IO3– + 6H2O +10ē ® I2 + 12OH– |
+0,21 | |
|
Кадмий |
Сd2+ + 2ē®Сd |
-0,40 |
|
Кислород |
H2O2 + 2ē ® 2OH– |
+0,87 |
|
H2O2 + 2H+ + 2ē ® 2H2O |
+1,77 | |
|
O2 + 4H+ + 4ē ® 2H2O |
+1,23 | |
|
O2 + 2H2O + 4ē ® 4OH– |
+0,40 | |
|
O2 + 2H+ + 2ē ® H2O2 |
+0,68 | |
|
O2 + 2H2O + 2ē ® H2O2 + 2OH– |
-0,10 | |
|
O3 + 2H+ + 2ē ® H2O + O2 |
+2,07 | |
|
Кобальт |
Co3+ + ē ® Co2+ |
+1,95 |
|
Co(OH)3 + ē ® Co(OH)2 + OH– |
+0,17 | |
|
Марганец
|
Mn2+ + 2ē ® Mn |
-1,17 |
|
MnO4– + 8H+ + 5ē ® Mn2+ + 4H2O |
+1,51 | |
|
MnO4– + ē ® MnO42- |
+0,56 | |
|
MnO4– + 2H2O + 3ē ® MnO2¯ + 4OH– |
+0,60 | |
|
MnO4– + 4H+ + 3ē ® MnO2¯ + 2H2O |
+1,69 | |
|
MnO2 + 4H+ + 2ē ® Mn2+ + 2H2O |
+1,23 | |
|
MnO42– + 4H+ + 2ē ® MnO2¯ + 2H2O |
+2,26 | |
|
MnO42– + 2H2O + 2ē ® MnO2¯ + 4OH– |
+0,60 | |
|
Медь |
Cu2+ + 2ē ® Cu |
+0,34 |
|
Cu2+ + ē ® Cu+ |
+0,16 | |
|
Cu2+ + I– + ē ® CuI |
+0,86 | |
|
Cu2+ + Cl– + ē ® CuCl |
+0,54 | |
|
Cu2+ + Br– + ē ® CuBr |
+0,64 | |
|
Никель |
Ni2+ + 2ē ® Ni |
-0,23 |
|
Олово |
Sn2+ + 2ē ® Sn |
-0,14 |
|
Sn4++ 2ē ® Sn2+ |
+0,15 | |
|
Платина |
Pt2+ + 2ē ® Pt |
≈+1,2 |
|
|
[PtCl4]2– + 2ē ® Pt + 4Cl– |
+0,73 |
|
[PtCl6]2– + 2ē ® PtCl42– + 2Cl– |
+0,72 | |
|
Ртуть |
Hg2+ + 2ē ® Hg |
+0,85 |
|
2Hg2+ + 2ē ® Hg22+ |
+0,91 | |
|
Свинец |
Pb2+ + 2ē ® Pb |
-0,13 |
|
Pb4+ + 2ē ® Pb2+ |
+1,66 | |
|
PbO2¯ + 4H+ + 2ē ® Pb2++ 2H2O |
+1,46 | |
|
Сера
|
SO42– + 10H+ + 8ē ® H2S + 4H2O |
+0,31 |
|
S + 2ē ® S2– |
-0,46 | |
|
S + 2H+ + 2ē ® H2S |
+0,14 | |
|
SO42– + 4H+ + 2ē ® H2SO3 + H2O |
+0,17 | |
|
SO42– + 8H+ + 6ē ® S + 4H2O |
+0,36 | |
|
S4O62–- + 2ē ® 2S2O32– |
+0,09 | |
|
S2O82– + 2ē ® 2SO42– |
+2,00 | |
|
Серебро |
Ag+ + 2ē ®Ag |
+0,80 |
|
Сурьма |
Sb3+ + 3ē ® Sb |
+0.20 |
|
Фтор |
F2+ 2ē®2F– |
+2,77 |
|
Хлор |
Cl2+ 2ē®2Cl– |
+1,36 |
|
2HClO + 2H+ + 2ē ® Cl2 + 2H2O |
+1,63 | |
|
HClO + H+ + 2ē ® Cl– + H2O |
+1,50 | |
|
2ClO3– + 12H+ +10ē ® Cl2 + 6H2O |
+1,47 | |
|
ClO3– + 3H2O + 6ē ® Cl– + 6OH– |
+0,62 | |
|
ClO3– + 6H+ + 6ē ® Cl– + 3H2O |
+1,45 | |
|
2ClO– + 2H2O + 2ē ® Cl2 + 4OH– |
+0,40 | |
|
ClO– + H2O + 2ē ® Cl– + 2OH– |
+0,88 | |
|
Хром
|
Cr3+ + ē ® Cr2+ |
-0,41 |
|
Cr3+ + ē ® Cr |
-0.74 | |
|
Cr2+ + ē ® Cr |
-0.91 | |
|
Cr2O72– + 14H+ + 6ē ® 2Cr3+ + 7H2O |
+1,33 | |
|
CrO42– + 4H2O + 3ē ® Cr(OH)3 + 4OH– |
-0,13 | |
|
Цинк |
Zn2+ + 2ē ® Zn |
-1,22 |
Таблица А.4 – Константы нестойкости (рК) комплексных ионов
|
Лиганды |
NH3 |
F– |
Cl– |
Br– |
I– |
OH– |
NO2– |
SCN– |
S2O32– |
CN– |
C2O42– |
|
Металл |
|
|
|
|
|
|
|
|
|
|
|
|
Ag+ (pK1—2) |
7 |
– |
5 |
7 |
12 |
4 |
3 |
8 |
13 |
20 |
– |
|
Co2+ (pK1—6) |
5 |
– |
– |
– |
– |
101—3 |
– |
21—3 |
– |
19 |
101—3 |
|
Co3+ (pK1—6) |
35 |
– |
– |
– |
– |
– |
? |
– |
– |
64 |
– |
|
Cu2+ (pK1—4) |
12 |
– |
– |
– |
– |
15 |
– |
7 |
121—2 |
– |
101—2 |
|
Fe2+ (pK1—6) |
– |
– |
– |
– |
– |
101—2 |
– |
– |
– |
37 |
51—3 |
|
Fe3+ (pK1—6) |
– |
16 |
– |
– |
– |
311—2 |
– |
51—4 |
– |
44 |
201—3 |
|
Hg2+ (pK1—4) |
19 |
– |
15 |
21 |
– |
– |
14 |
5 |
321—3 |
411—6 |
– |
|
Mn2+ (pK1—6) |
9 |
– |
– |
– |
– |
— |
– |
– |
– |
– |
51—2 |
|
Ni2+ (pK1—6) |
8 |
– |
– |
– |
– |
111—3 |
– |
– |
– |
311—4 |
– |
|
Zn2+ (pK1—4) |
9 |
– |
– |
– |
– |
18 |
– |
3 |
51—2 |
20 |
81—3 |
|
Pb2+ (pK1—3) |
– |
– |
2 |
3 |
4 |
14 |
– |
2 |
– |
– |
71—2 |
|
Sn2+ (pK1—3) |
– |
– |
2 |
2 |
– |
25 |
– |
– |
– |
– |
– |
|
Cr3+ (pK1—4) |
? |
– |
– |
– |
– |
30 |
– |
6 |
– |
– |
151—3 |
|
Al3+ (pK1—6) |
– |
21 |
– |
– |
– |
331—4 |
– |
– |
– |
– |
– |
|
Be2+ (pK1—4) |
– |
– |
– |
– |
– |
15 |
– |
– |
– |
– |
– |
|
Bi3+ (pK1—6) |
– |
– |
6 |
9 |
19 |
– |
– |
4 |
– |
– |
– |
