
- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
2.1.2.2 Глицерин
Из ряда трёхатомных спиртов, алкантриолов, практически важное применение находит лишь глицерин (пропантриол-1,2,3). Получают глицерин почти исключительно омылением жиров или синтезом из пропилена.
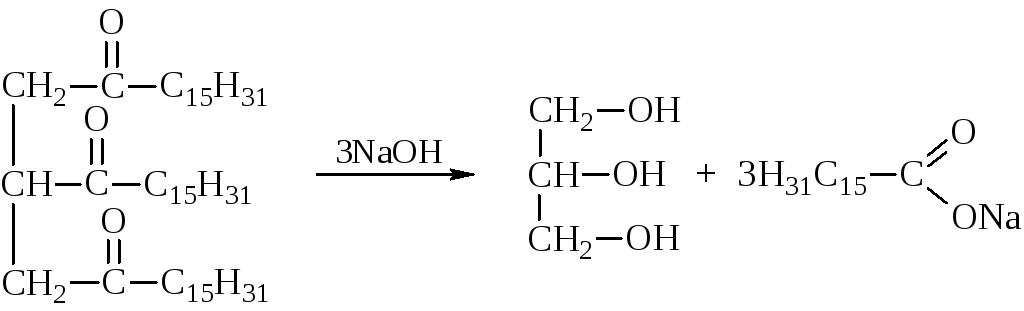
При обработке жиров щёлочью получаются натриевые соли жирных кислот – мыла. Отсюда и название процесса щелочного гидролиза сложных эфиров – омыление.
Разработка процесса промышленного синтеза глицерина из пропилена позволила значительно сократить расход пищевых жиров на технические цели. Процесс протекает по следующей схеме:
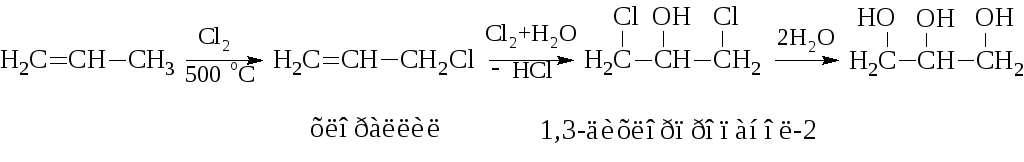
Глицерин – вязкая, бесцветная, сладкая на вкус жидкость. Очень гигроскопичен. tплав = 17,9 °C, tкип = 190 °C с разложением. Растворим в воде в любых соотношениях.
Химические свойства глицерина
– Из-за взаимного влияния гидроксильных групп кислотность их несколько повышается, и водородные атомы гидроксильных групп глицерина замещаются на металл при действии щелочных металлов, гидроксидов железа, меди, кальция, бария и других металлов. Получающиеся соединения называются глицератами.

– В связи с повышенной кислотностью гидроксилов при взаимодействии с HCl и HBr в реакцию вступают не все гидроксильные группы. Образуются только моно- и дигалогенгидрины глицерина.

Лишь с помощью галогенидов фосфора можно заместить все три гидроксила.

– Взаимодействие глицерина с органическими и неорганическими кислотами даёт полные и неполные сложные эфиры. Образующийся при обработке глицерина азотной кислотой полный эфир глицеринтринитрат под названием «нитроглицерин» идёт на изготовление динамита.

Аналогично получаются эфиры органических кислот.

Большое практическое значение имеют полиэфиры глицерина и фталевой кислоты – глифтали.

Глифтали используются для изготовления лаков.
– Внутримолекулярная дегидратация глицерина приводит к образованию акролеина.
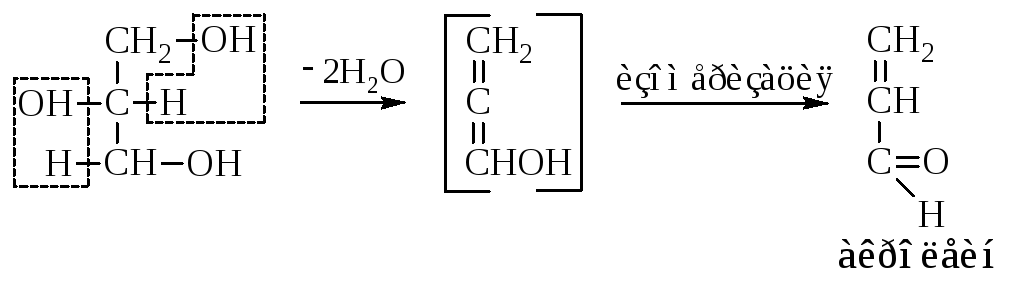
– Являясь одновременно первичным и вторичным спиртом, при окислении глицерин даёт смесь соответствующего гидрокси-альдегида и гидроксикетона.

Глицерин сильно гигроскопичен и поэтому широко употребляется как мягчительное средство в медицине и парфюмерии, в текстильной и полиграфической промышленности – для предохранения печатных красок от высыхания, в пищевой промышленности – для изготовления кондитерских изделий, ликёров, прохладительных напитков. Большие количества глицерина идут на получение нитроглицерина, эпоксидных и глифталевых смол.
Спирты с четырьмя, пятью, шестью и т.д. гидроксильными группами встречаются в природе. Многие из них получены синтетически. Свойства и строение некоторых многоатомных спиртов будут рассмотрены в теме «Углеводы».
2.2 Фенолы и ароматические спирты
Ароматические гидроксисоединения делятся на две группы: фенолы и ароматические спирты. В фенолах гидроксильная группа непосредственно связана с ядром. Ароматические спирты содержат гидроксил в боковой цепи ароматического соединения.
2.2.1 Фенолы
В зависимости от числа гидроксильных групп различают одноатомные, двухатомные и т.д. фенолы. Называться фенолы могут по различным номенклатурам. Например:

Одноатомные фенолы
Источники и методы получения
Важным источником фенола и крезолов является каменноугольная смола. Причём выход фенолов тем выше, чем ниже температура коксования. Дополнительное количество фенола получают из бензола несколькими методами.
– Щелочное плавление солей бензолсульфокислот. Это старый метод и в промышленности используется всё реже.

Выход фенола 60 %…70 %.
– Некоторое количество фенола получают гидролизом хлорбензола, перегретым до температуры 450 °C…500 °C паром.
Катализатор – силикагель, промотированный ионами Cu+2.

– Кумольный метод (разложение гидроперекиси изопропил-бензола (кумола)).
Процесс состоит в следующем:

– Замещение диазогруппы. Этот метод неэкономичен для получения фенола, но с успехом используется для синтеза индивидуальных о-, м- и п-крезолов.

– Гомологи фенола получают его алкилированием.
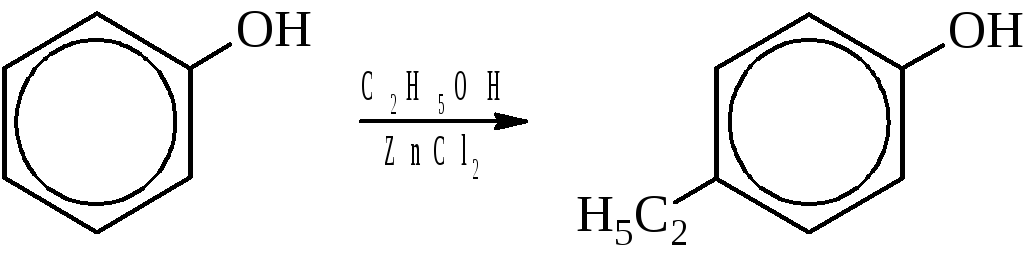
Физические свойства
Фенолы – обычно кристаллические вещества, плохо растворимые в воде. Имеют характерный запах. Являются антисептиками, ядовиты, вызывают ожоги при попадании на кожу.
Фенол: tплав. = 41 °C; tкип = 182 °C; d420 = 1,072;
Крезолы: о- 30 °C; 191,5 °C; 1,0465;
м- 11 °C; 202,8 °C; 1,034;
п- 36 °C; 202,5 °C; 1,035.
Химические свойства
Фенолы обладают весьма реакционноспособной гидроксильной группой и ароматическим ядром.
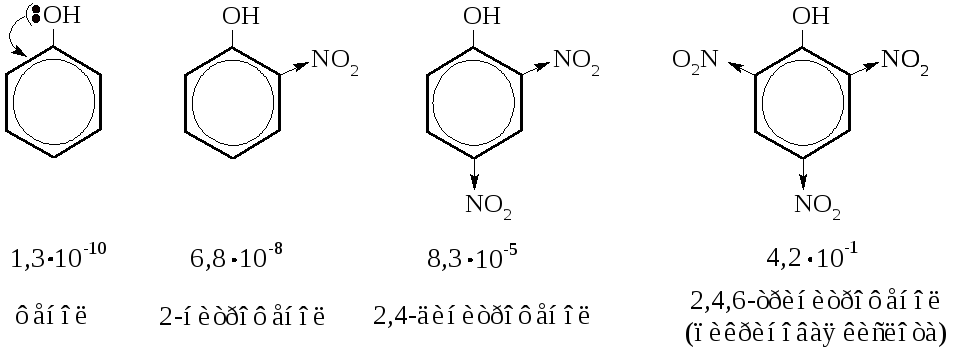
– Фенолы – слабые кислоты. Кислотность их выше, чем у спир-тов и воды, но как кислоты они слабее угольной кислоты и карбоновых кислот. Так, константы диссоциации уксусной кислоты 1,8·10-5, угольной кислоты 4,9·10-7, фенола 1,3·10-10 и воды 1,8·10-16. Кислотные свойства фенольного гидроксила вызваны мезомерным взаимодействием с ароматическим ядром. Валентные электроны атома кислорода вступают в систему сопряжения бензольного кольца, а водородный атом гидроксила протонизируется и становится активным.

Кислотность фенола можно проиллюстрировать, например, следующими фактами. Фенолы хорошо растворяются в щелочах с образованием фенолятов (одноатомные насыщенные спирты со щелочами не реагируют).
![]()
Однако они не вытесняют CO2 из карбоната натрия (Na2CO3). Более того, фенолы выделяют из растворов фенолятов обработкой CO2.
![]()
Две эти реакции используются для выделения фенолов из смесей их со спиртами или карбоновыми кислотами.
Кислотность фенольного гидроксила может быть значительно повышена при введении в ядро сильных электроноакцепторных групп (под формулами указаны величины констант диссоциации):
– Образование простых эфиров фенолов алкилированием фенолятов.
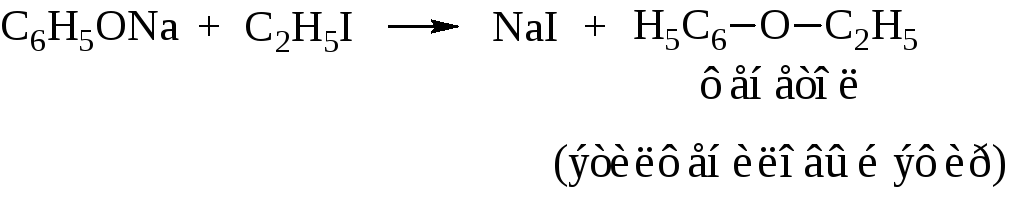
– Сложные эфиры при действии на фенолы карбоновых кислот не образуются. Они получаются в реакции фенолятов с ангидридами или галоидангидридами кислот.

– Обычные реакции замещения гидроксила на галоген из-за кислотности фенольного гидроксила даже при действии PCl5 не идут.
– При перегонке с цинковой пылью фенолы восстанавли-ваются до углеводородов.
![]()
– Гидроксил – один из сильнейших, а в щелочной среде сильнейший орто-пара-ориентант. Поэтому фенолы легко вступают в реакции электрофильного замещения в ядре. Нужно ещё учесть, что гидроксил повышает электронную плотность в ядре и облегчает электрофильную атаку.
Галоидирование фенолов действием растворов галогенидов или галогенирующих средств (например, SOCl2, PCl5) идёт с большой скоростью до образования тригалогенфенолов.

Нитрование фенолов. Мононитрофенолы получают нитрова-нием фенолов на холоду ~30 %-ной азотной кислотой. В согласии с правилами ориентации получается смесь о- и п-нитрофенолов. При дальнейшем нитровании концентрированной азотной кислотой получается 2,4,6-тринитрофенол (пикриновая кислота).
– Гидрирование водородом в присутствии катализаторов (Pt, Pd, Ni) даёт циклогексановые спирты.

– Реакция конденсации
При нагревании фенола с муравьиным альдегидом в присутствии серной кислоты образуется растворимый в спиртах, ацетоне и т.д. полимер линейного строения, так называемый «новолак».
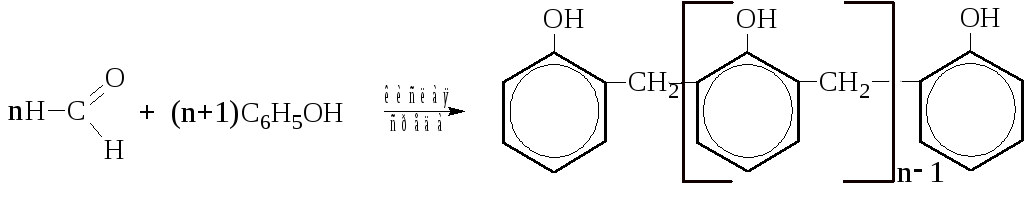
В щелочной среде получаются фенолоспирты, а из них – легкоплавкий низкомолекулярный полимер «резол», хорошо растворимый в органических растворителях.
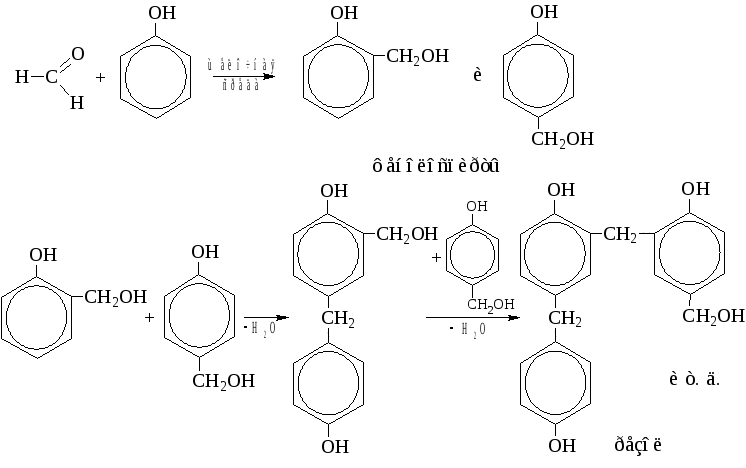
При дальнейшей конденсации резола (нагрев) образуется трёхмерный, сетчатый (пространственный) нерастворимый полимер – резит, бакелит (с наполнителем). Резит – неплавкий, нерастворимый, химически устойчивый полимер, который можно нагревать до температуры ~ 300 °C. Фенол-формальдегидные полимеры имеют очень широкое применение в народном хозяйстве.
Фенол – кристаллическое вещество с tплав. = 43 °C и tкип = 181 °C. Плохо растворим в воде и даёт с ней гидрат, называемый карболовой кислотой. Фенол вызывает ожоги кожи. Антисептик. Фенол широко используется промышленностью для получения фенолформ-альдегидных пластических масс, лекарственных препаратов (например, салициловая кислота и её производные), красителей, взрывчатых веществ (пикриновая кислота – меленит).
Метиловый эфир фенола – анизол – используется для получения пахучих веществ и красителей.
Крезолы. Крезолы применяются в производствах пластических масс, красителей, дезинфицирующих средств.
Двухатомные фенолы

Химические свойства одно- и двухатомных фенолов сходны. Однако в реакциях диоксибензолов имеются некоторые особенности. Двухатомные фенолы проявляют более сильные кислотные свойства, реакции замещения водорода бензольного ядра протекают ещё легче, двухатомные фенолы очень легко окисляются с образованием соответствующих хинонов и поэтому являются сильными восстановителями.
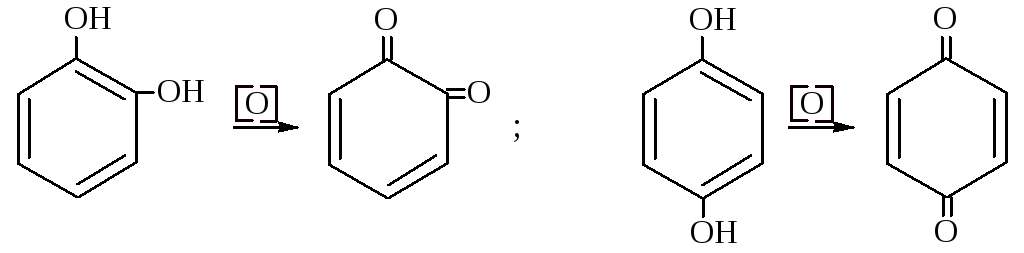
Пирокатехин (1,2-дигидроксибензол с хлорным железом даёт зеленое окрашивание). Встречается во многих растениях, в основном в виде его метилового эфира – гваякола, который находит фармацевтическое и пищевое применение.

Резорцин (1,3-дигидроксибензол), tплав = 118 °C, tкип = 276 °C. С хлорным железом даёт фиолетовую окраску. Применяется для получения красителей и как дезинфицирующее средство.
Гидрохинон (1,4-дигидроксибензол), tплав = 170 °C, tкип = 286 °C. Гидрохинон очень легко окисляется до хинона. Гидрохинон используется в фотографии как проявитель. Из его производных получают термостойкие поликонденсационные смолы.
