- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
1.6 Ароматические углеводороды
Ароматические углеводороды представляют собой большую группу веществ, содержащих в своей структуре чаще всего бензольный цикл или систему нескольких бензольных циклов. В рассмотренной ранее схеме последовательного дегидрирования циклогексана до циклегексена, циклогексадиена и циклегексатриена (бензола) первые две стадии эндотермичны, а стадия дегидрирования циклогексадиена с образованием бензола протекает с выделением энергии, что указывает на необычайно высокую энергетическую устойчивость бензола по отношению к другим участникам реакции и обуславливает специфические химические и физические свойства соединения, его так называемый ароматичеcкий характер.
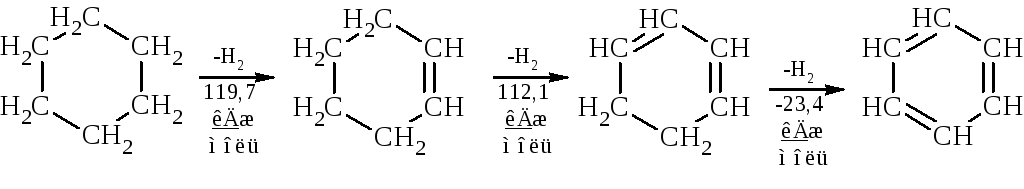
Ароматический ряд объединяет соединения различных классов: углеводороды, галоген-, гидроксил-, карбонилпроизводные, карбоновые кислоты, амины и т.д. Вещества всех этих классов являются производными ароматических углеводородов.
Изомерия и номенклатура
Первый член ряда углеводородов с одним бензольным циклом – бензол, второй – метилбензол или толуол. Третий член ряда – ксилол – имеет три структурных изомера: орто-, мета- и пара-.
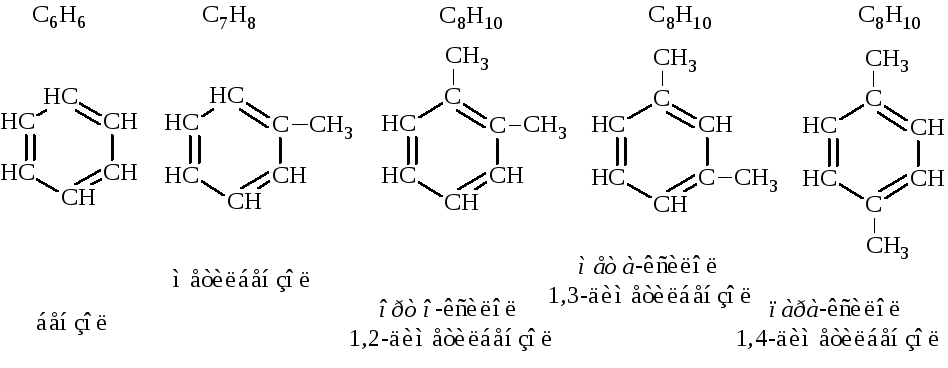
Изомерия производных бензола зависит как от величины и числа заместителей, так и от их относительного расположения. Так, при одинаковых заместителях бензол и однозамещённый бензол не имеют изомеров, ди- и тризамещённый – имеют по три изомера.
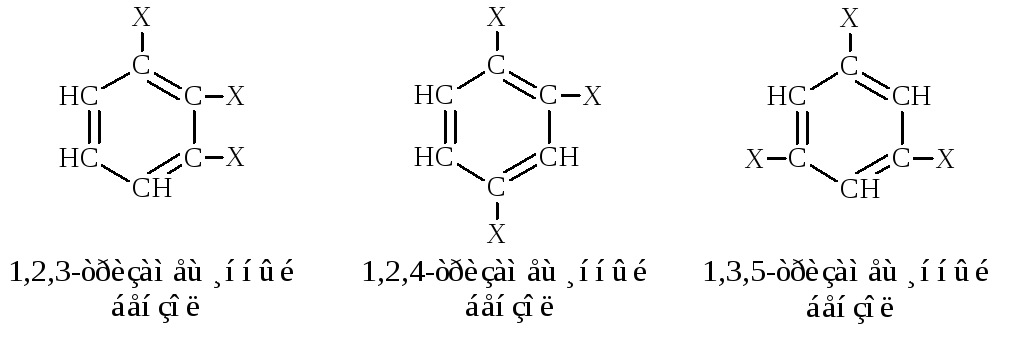
Если заместители разные, число изомеров, начиная с тризамещённого бензола, резко возрастает.
Кроме того, источником изомерии может явиться сам заместитель.
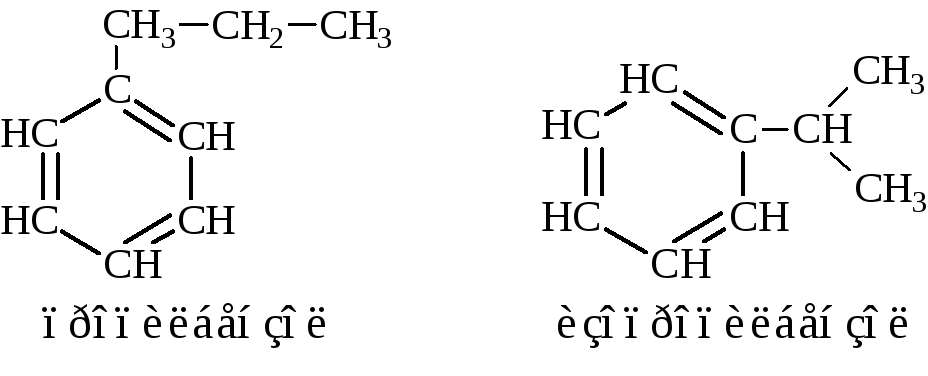
Для названия углеводородов ароматического ряда и их производных применяются тривиальная, радикально-функциональная и ИЮПАК номенклатуры. В радикально-функциональной номенкла-туре используются названия следующих радикалов:
|
C6H5– |
– фенил |
| |
|
C |
– фенилен |
|
|
|
CH3 –C6H4– |
– толил |
|
Например: |
|
C6H5CH2– |
– бензил |
C6H5CH2Cl |
– хлористый бензил |
|
C |
– бензилиден |
C6H5CHCl2 |
–хлористый бензилиден |
В номенклатуре ИЮПАК перед названием углеводорода проставляются названия заместителей с номерами углеродных атомов, которые несут эти заместители. Например:

При двух заместителях в бензольном цикле их взаимное расположение в цикле обозначается не только цифрами (счет идет по кратчайшему пути от одного к другому), но и с помощью приставок орто-, мета-, пара-, обозначающих соответственно 1,2-, 1,3- и 1,4- относительные положения.
Источники ароматических соединений
Основными источниками ароматических соединений являются каменноугольная смола, нефть, ацетилен и некоторые эфирные масла.
Каменноугольная смола получается при коксовании угля. Основными продуктами коксования являются коксовый газ, каменноугольная смола и кокс. По выходе из коксовой батареи газы коксования промываются водой. При этом поглощается аммиак и конденсируются продукты, составляющие каменноугольную смолу. Несконденсированные ароматические углеводороды адсорбируются затем тяжёлым поглотительным маслом и выделяются.
Каменноугольную смолу разделяют перегонкой на 5 фракций: углеводородную, фенольную, нафталиновую, антраценовую и пёк. Для выделения индивидуальных соединений каждую фракцию разгоняют дополнительно. Выход смолы ~ 3 %, но при современных масштабах коксового производства промышленность получает огромное количество ароматического сырья.
Содержание ароматических углеводородов в нефти колеблется примерно от 20 % до 40 %. Поэтому нефть является важным поставщиком бензола и его производных.
Кроме того, ароматические углеводороды образуются при деструктивной переработке нефти. Процесс ароматизации нефти, который называют риформингом, протекает при температуре ~ 500 °С, давлении 15–40 атм на платиновом катализаторе (Pt/Al2O3). При этом углеводороды нефти подвергаются дегидроциклизации, дегидрированию, частичной дециклизации с образованием ароматических углеводородов.
Методы получения
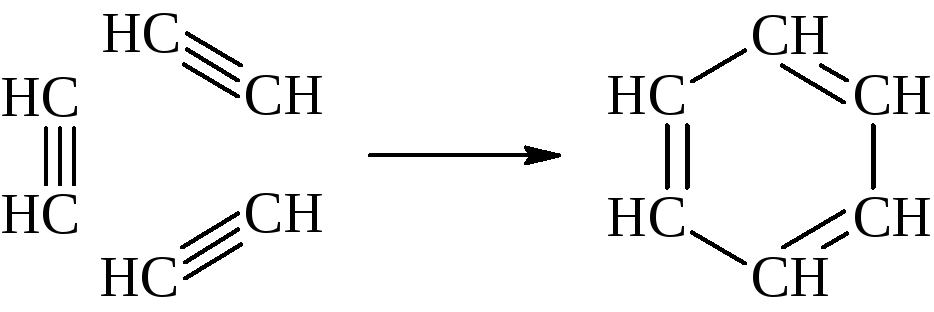
– Ацетилен превращается в бензол при значительном нагревании и воздействии активированного угля как катализатора.
– Наиболее распространённым способом синтеза гомологов бензола является реакция алкилирования бензола галогеналканами, спиртами или олефинами в присутствии катализаторов (например, галогенидов алюминия).
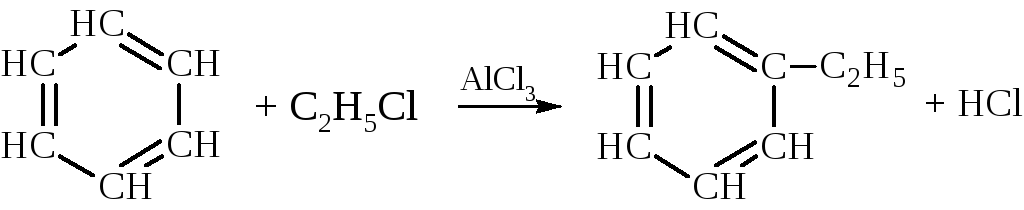
Алкилированием бензола этиленом и пропиленом получают этилбензол и изопропилбензол.
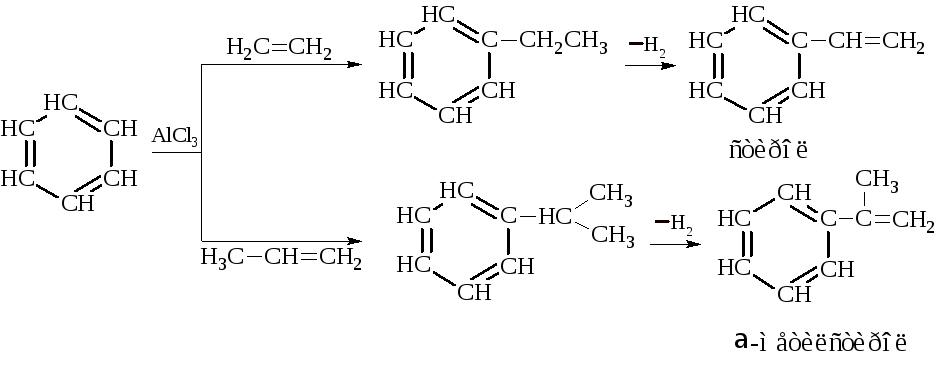
Дегидрирование этих продуктов даёт стирол и α-метилстирол – ценные мономеры для получения синтетического каучука и полимерных материалов.
Строение молекулы бензола
В 1865 г. Август Кекуле (Боннский университет) предложил формулу бензола с чередующимися двойными связями, которая использовалась до сих пор и в некоторых случаях будет использоваться далее. Эта формула находится в согласии со многими свойствами бензола: цикличностью структуры, равноценностью всех углеродных и водородных атомов, возможностью присоединения. Она объяснила существование лишь одного монозамещённого и трёх изомеров (орто-, мета- и пара-) дизамещённого бензола.
Однако бензол более склонен к реакциям замещения, нежели присоединения, бензольное кольцо устойчиво к окислителям, хотя по формуле в нём три двойные связи.Бензол не дает реакций с бромной водой и раствором перманганата калия, характерных для непредельных соединений. Все эти факты формула Кекуле объяснить не могла.
Решающую роль в установлении строения бензола сыграли физические методы исследования вещества, преимущественно разработанные в прошлом веке. Молекула бензола неполярна. Бензол имеет ось симметрии 6-го порядка. Это означает, что ядра атомов и электроны в нём расположены совершенно симметрично. На основании рентгено- и электронограмм было установлено, что молекула бензола плоская и расстояния между центрами углеродных атомов одинаковы и равны 0,139 нм. Это почти средняя величина между длинами простой (0,154 нм) и двойной (0,134 нм) связей. Весьма интересные сведения дают термодинамические исследования. Например, образование двойной связи из простой С–С-связи, как это было показано в начале лекции, требует затраты энергии. В то же время дегидрирование 1,3-циклогексадиена с образованием бензола идет с выделением тепла.
Все эти физические и химические особенности строения и свойств бензола объяснимы с точки зрения современных представлений о строении бензола. Шесть углеродных атомов бензола находятся в состоянии sр2-гибридизации. Оси всех sр2-орбит лежат в одной плоскости под углом 120° друг к другу. Перекрывание электронных sр2-облаков соседних атомов углерода создает σ-связи С–С. Все шесть σ-связей С–С одинаковы, лежат в одной плоскости. Молекула бензола, в которой углы между связями составляют 120°, не напряжена. Оси негибридизованных р-электронов шести атомов углерода перпендикулярны плоскости кольца. При боковом перекрывании р-орбиталей образуется круговая молекулярная электронная орбита, по которой свободно, не связываясь с каким-либо атомом двигаются электроны.
|
|
|
.При этом достигается почти идеально равномерное распределение электронной плотности в системе сопряжения, которое приводит к энергетической стабилизации молекулы бензола на ~150 кДж∙моль-1 и появлению необычных свойств, совокупность которых объединяется термином «ароматичность». Ароматичность не имеет непосредственного отношения к запаху органических соединений. Термин «ароматичность» был предложен потому, что первые представители этого класса веществ обладали приятным запахом. Наиболее важными признаками ароматичности являются повышенная устойчивость ненасыщенной циклической структуры и большая склонность ароматических соединений к реакциям замещения, сохраняющим стабилизирующую их систему сопряженных связей в цикле, а не к реакциям присоединения, разрушающим эту систему и дестабилизирующим молекулу.
Необходимым условием сопряжения в ароматических системах является параллельность осей всех р-электроных орбиталей. Циклооктатетраен, например, лишён ароматических свойств, поскольку из-за большого углового напряжения при угле 135° между связями (вместо 120°, характерных для sр2 –гибридизации) он не может сохранить плоской структуры, и оси р-орбиталей не параллельны.
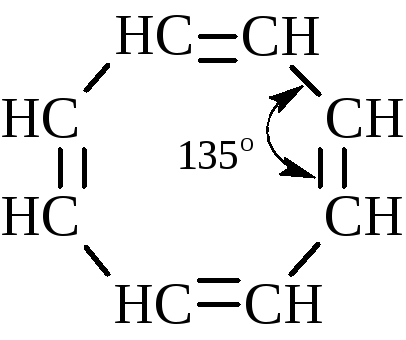
Существуют несколько критериев, объединенных правилом Хюккеля, по которым молекула может быть отнесена к ароматической: для того чтобы соединение было ароматическим, в его молекуле должна содержаться циклическая система делокализованных -электронов выше или ниже плоскости молекулы; облако -электронов должно насчитывать (4n+2) -электронов. Здесь n – любое целое число (0, 1, 2, 3, 4, ….)
Ароматические соединения встречаются в различных классах органических веществ.
Для изображения бензольного кольца используют формулы нескольких видов.
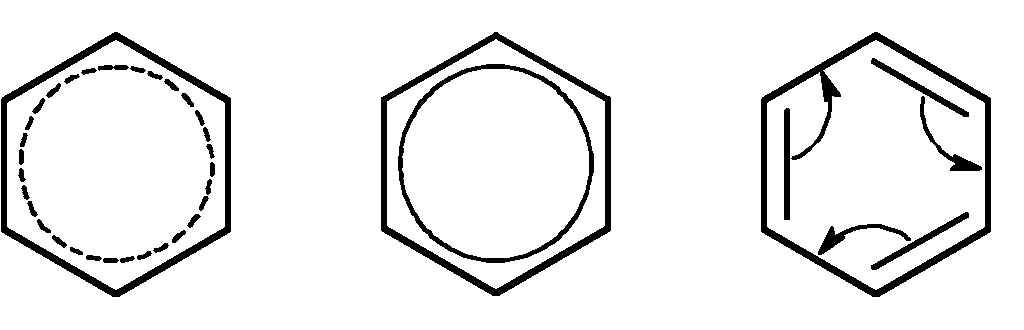
Формула Кекуле используется условно, в основном для написания уравнений реакций присоединения.
Физические свойства
Ароматические углеводороды бензольного ряда – это жидкие и твердые вещества, обладающие сильным запахом. Температура кипения бензола (C6H6), 80,1 °C, выше температуры кипения гексана (C6H14), 68,8 °C. Температуры кипения изомерных соединений различаются мало. Бензольные углеводороды практически не растворимы в воде.
Химические свойства
Для ароматических углеводородов характерны реакции присоединения и замещения. Причем наибольшая склонность к реакциям замещения.
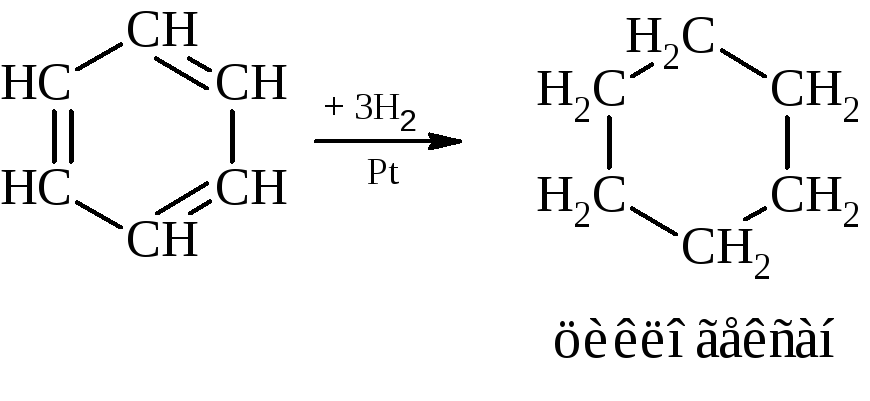
Реакции присоединения, характеризующие бензол как ненасыщенное соединение:
– водород присоединяется к ароматическим углеводородам только в присутствии катализатора и при повышенной температуре.
– под влиянием жесткого ультрафиолетового облучения бензол присоединяет хлор и бром с образованием гексагалогенциклогексана, который при нагревании переходит в тригалогенбензол.
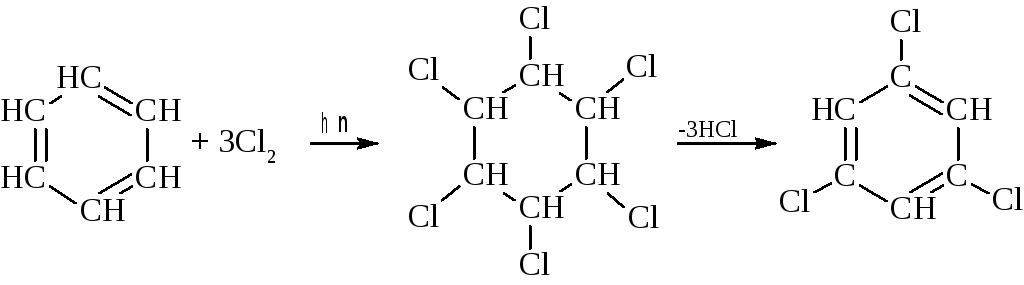
– подобно другим ненасыщенным углеводородам бензол озонируется с образованием сильного взрывчатого вещества – триозонида бензола.
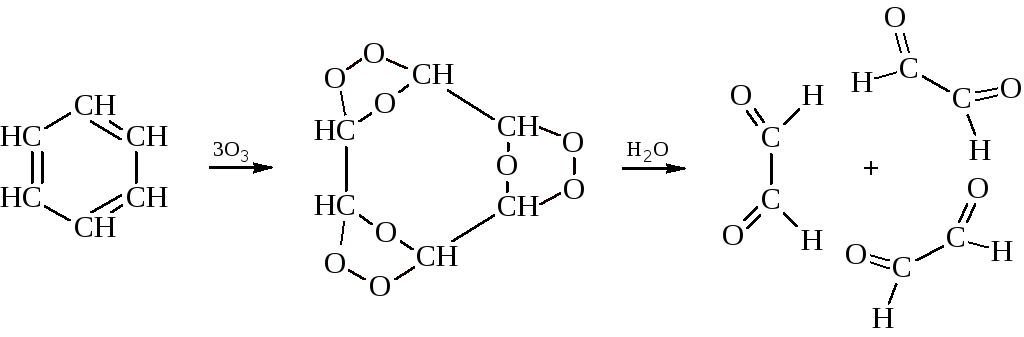
Под действием воды триозонид даёт три молекулы глиоксаля. Эта реакция используется для установления строения соединений бензольного ряда.
Все эти превращения характеризуют бензол как ненасыщенное соединение.
Реакции замещения в ароматическом ядре
Правила замещения в бензольном цикле
Если в бензоле электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и место вступления нового заместителя. Поскольку атакующая ядро группа прежде всего взаимодействует с отрицательно заряженной электронной системой сопряжения бензольного ядра, реакции замещения в ароматическом цикле должны протекать по ионному механизму с участие заряженных атакующих частиц.
Реакционная способность того или иного атома углерода в кольце определяется следующими факторами:
– положением и природой уже имеющихся заместителей;
– природой новой замещающей (атакующей) группы;
– условиями проведения реакции.
Первые два фактора наиболее значимы.
Заместители в бензольном кольце делятся на две группы
Заместители CH3, CH2R, CHR2, CR3, OH, OR, NH2, NHR, NR2, F, Cl, Br, I и другие называются заместителями первого рода. Они способны отдавать электроны – это электронодонорные заместители.
Заместители второго рода способны оттягивать на себя, принимать электроны. Это – электроноакцепторные заместители. К ним относятся SO3H, NO2, COOH, COOR, CHO, COR, CN, NH3+ и другие.
В свою очередь, атакующие (замещающие) группы могут быть электрофильными или нуклеофильными. Электрофильные реагенты в реакции служат акцепторами электронов. В частном случае – это катионы. Нуклеофильные реагенты в реакции являются донорами электронов. В частном случае – это анионы.
Если реагент действует на ядро с одним заместителем, то можно выделить несколько вариантов их взаимодействия:
– заместитель первого рода; реагент электрофильный.
В качестве примера рассмотрим реакцию нитрования толуола нитрующей смесью (смесь азотной и серной кислот).
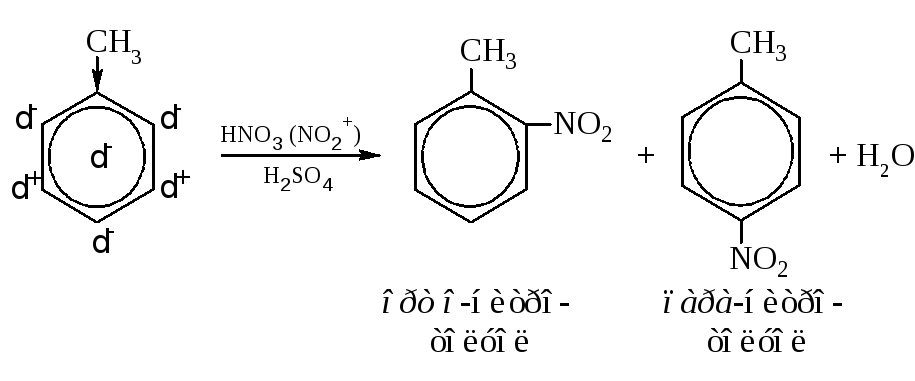
Метильная группа в толуоле является ориентантом первого рода. Это электронодонорная частица. Поэтому ядро в целом из-за смещения электронной плотности от метильной группы получает дробный отрицательный заряд. Ближайшие к заместителю атомы углерода цикла заряжаются также отрицательно. Последующие углероды цикла приобретают чередующиеся заряды (альтернирующий эффект). Реакция между азотной и серной кислотами нитрующей смеси дает несколько частиц, среди которых присутствует электрофильная частица NO2+ (на схеме показана над стрелкой в скобках), которая атакует отрицательно заряженные атомы цикла. Происходит замещение водородных атомов на нитрогруппу в орто- и пара-положениях относительно метильной группы. Поскольку ядро имеет отрицательный заряд, а атакующая частица электрофильна (заряжена положительно), реакция облегчается и может протекать в более мягких условиях по сравнению с нитрованием бензола.
– Заместитель второго рода; реагент электрофильный.
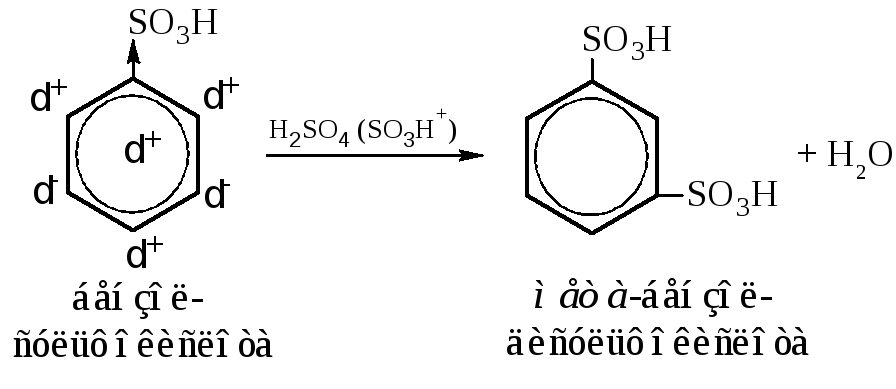
Сульфогруппа (ориентант второго рода, электроноакцепторный) благодаря смещению электронной плотности к себе заряжает ядро в целом и ближайшие углероды ядра положительно. Атакующая частица электрофильна. Ориентация в мета-положение. Заместитель затрудняет действие реагента. Сульфирование следует проводить концентрирован-ной серной кислотой при повышенной температуре.
– Заместитель второго рода; реагент нуклеофильный.

В соответствии с зарядами нуклеофильная частица OK– атакует орто- и пара-положения и заместитель облегчает действие реагента. Тем не менее, реакции нуклеофильного замещения приходится проводить в довольно жестких условиях. Это объясняется энергетической невыгодностью переходного состояния в реакции и тем, что π-электронное облако молекулы отталкивает атакующую нуклеофильную частицу.
– Заместитель первого рода; реагент нуклеофильный.
Заместитель затрудняет действие реагента. Ориентация в мета-положение. Такие реакции практически не реализуются.

Если в ядре имеется несколько различных заместителей, то преимущественное направляющее действие оказывает тот из них, который обладает наибольшим ориентирующим действием. Например, в реакциях электрофильного замещения по силе ориентационного действия заместители можно расположить в следующий ряд:
OH > NH2 > ОR > Cl > I > Br > CH3; Ориентирующая способность ориентантов второго рода убывает в следующей последовательности: NO2 > COOH > SO3H. В качестве примера приведена реакция хлорирования орто-крезола (1-гидрокси-2-метилбензола):
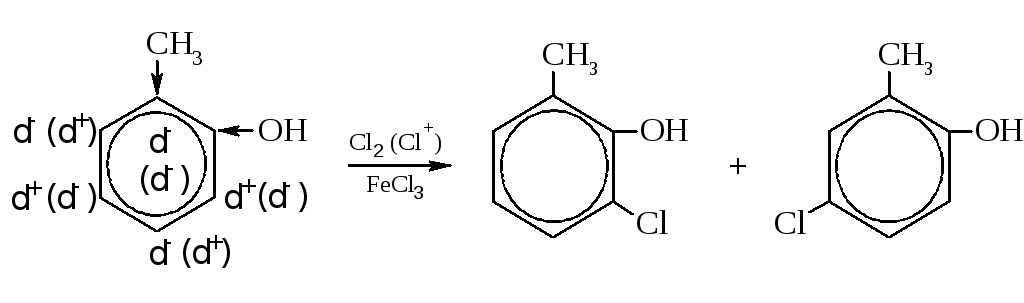
Оба заместителя – ориентанты первого рода, электроно-донорные. Судя по зарядам на атомах углерода (в скобках – от группы –ОН), ориентация не совпадает. Поскольку фенольный гидроксил является более сильным ориентантом, в основном получаются продукты, соответствующие ориентации этой группы. Оба заместителя облегчают протекание реакции. Реакция электрофильная благодаря взаимодействию катализатора с молекулярным хлором.
На практике правила замещения чаще всего выполняются не строго. При замещении получаются все возможные продукты. Но продуктов, которые должны получаться по правилам, всегда больше. Например, при нитровании толуола образуется 62 % орто-, 33,5 % пара- и 4,5 % мета-нитротолуолов.
Изменение внешней среды (температура, давление, катализатор, растворитель и т. д.) обычно слабо влияет на ориентацию.
Ряд реакций замещения показан при объяснении правил ориентации. Рассмотрим еще несколько реакций.
– При действии на бензол хлора или брома в присутствии катализаторов – переносчиков галоидов, например, FeCl3, AlCl3, SnCl4 и других происходит последовательное замещение атомов водорода при циклических углеродах на галоген.
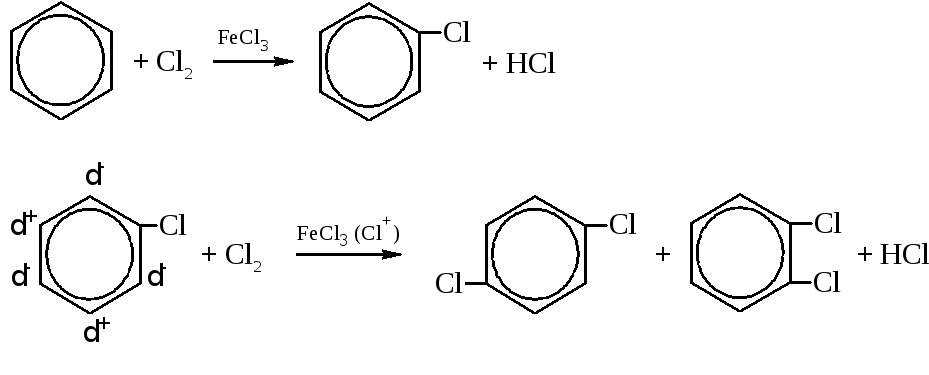
В последней электрофильной реакции хлор как ориентант первого рода направляет второй атом хлора в орто- и пара- положения (преимущественно – в пара-). Однако в отличие от других ориентантов первого рода он затрудняет реакцию из-за своих сильно выраженных электороноакцепторных свойств, заряжая ядро положительно. В момент атаки электрофильной частицы галоген исходного соединения возвращает часть электронной плотности ядру, создавая заряды на его углеродах, соответствующие действию ориентанта первого рода (динамический эффект ориентации).
– Галогенирование алкилзамещенных бензола на свету протекает по радикальному механизму, и замещение происходит у α-углеродного атома боковой цепи:

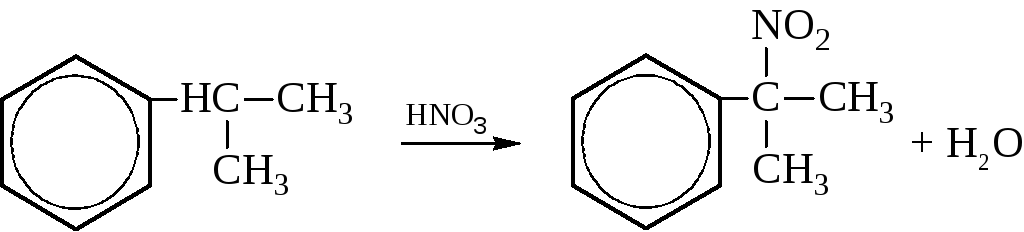
– При нитровании по Коновалову (разбавленный водный раствор азотной кислоты, ~140 °C), протекающему по радикальному механизму, также приводит к замещению в боковой цепи:
– Окисление бензола и его гомологов
Бензольное кольцо окисляется очень трудно. Однако в присутствии катализатора V2O5 при температуре 400 °C…500 °C бензол образует малеиновую кислоту:

Гомологи бензола при окислении дают ароматические кислоты. Причём боковая цепь даёт карбоксильную группу при ароматическом кольце, независимо от своей длины.
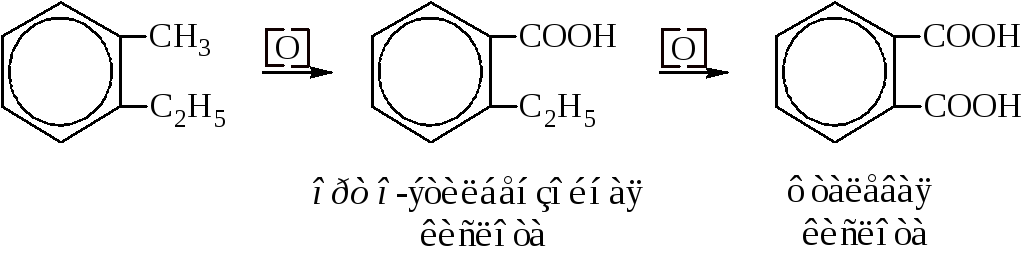
Подбором окислителей можно добиться последовательного окисления боковых цепей.
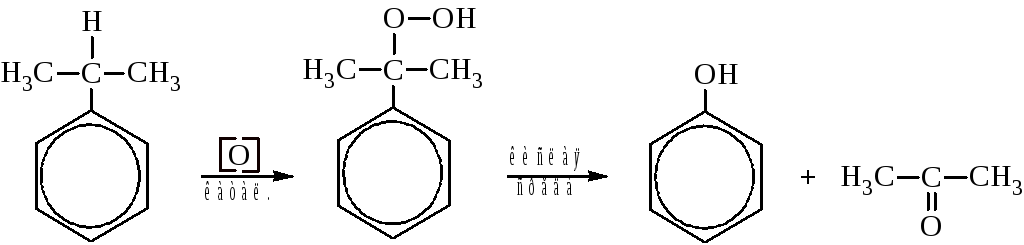
В присутствии катализаторов из алкилбензолов образуются гидроперекиси, разложением которых получают фенол и соответствующие кетоны.
Отдельные представители
Бензол – жидкость, tплав.= 5,4 °С, tкип= 80,1 °С, с водой образует азеотропную смесь, поэтому при перегонке легко обезвоживается. В промышленности имеет чрезвычайно широкое применение: как растворитель, для получения производных бензола и других соединений (хлорпроизводных, анилина, фенола, красителей, взрывчатых веществ, лечебных препаратов, капрона, нейлона, ацетона, полистирола и т.д.).
Толуол – жидкость, tплав.= –93 °С, tкип= 110,6 °С. Главное применение – производство взрывчатых веществ (тротил: тринитро-толуол), бензойного альдегида, хлористого бензила, которые служат сырьем для анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Используется как растворитель.
Ксилолы. Смесь ксилолов используется как растворитель и для повышения октанового числа моторных топлив (ОЧ ≥ 120). Большое количество пара-ксилола идет на производство синтетического волокона лавсан. Получают ксилолы, главным образом, риформингом узких нефтяных фракций с пределами выкипания близкими к температуре кипения ксилолов.
Этилбензол. Получают алкилированием бензола этиленом в присутствии AlCl3. Используется в основном для получения стирола (винилбензола).
Стирол. Ароматические углеводороды с двойными связями в боковой цепи в настоящее время используются очень широко. Стирол является простейшим представителем этого вида углеводородов. Это – жидкость с tкип = 146°С. Важнейший способ получения состоит в следующем:
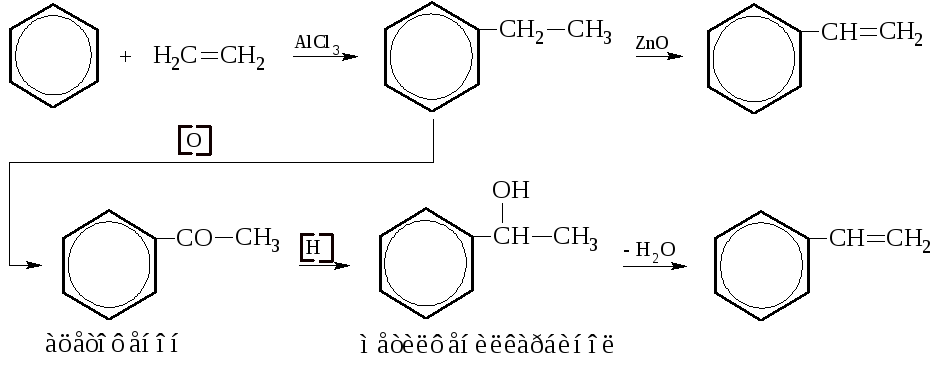
Под действием катализаторов стирол полимеризуется в твёрдую полупрозрачную массу – полистирол.
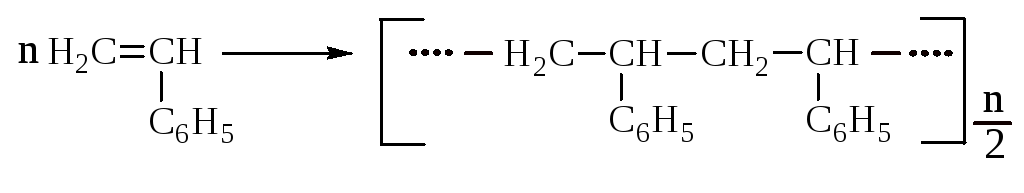
(n ≤ 5000)
Полистирол имеет высокое электросопротивление и влагостойкость. Полимеризацией стирола и дивинила получают синтетический каучук, пригодный для изготовления шинной резины.
Многоядерные ароматические углеводороды
Ароматические соединения с несколькими кольцами можно разделить на 2 группы: соединения с неконденсированными ядрами и соединения с конденсированными ядрами.
К первой группе относятся дифенил и трифенилметан.
Дифенил образуется при пиролизе бензола, содержится в каменноугольной смоле.
2C6H6 C6H5–C6H5 + H2
В лаборатории чаще всего получается синтезом по Вюрцу-Фиттигу.
2C6H5Br + 2Na C6H5–C6Н5 + 2NaBr
Дифенил – кристаллическое вещество с tплав.= 70 °С, tкип = 254 °С. Дифенил – типичное ароматическое соединение и в отношении химических свойств ведёт себя как бензол. В реакциях замещения бензольные кольца осуществляют взаимную ориентацию в пара-положение. Места заместителей обозначаются цифрами или приставками.
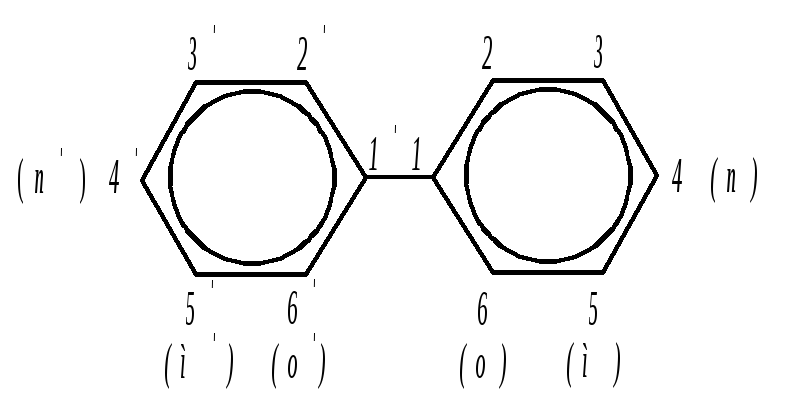
Вокруг простой связи, соединяющей кольца в дифениле, возможно внутреннее вращение с небольшой затратой энергии. Однако при введении заместителей в орто- и орто'-положения из-за пространственных затруднений вращение может прекратиться. При этом возникает два пространственных изомера, которые из-за их устойчивости можно выделить.
Наиболее важным производным дифенила является бензидин (п, n'-диаминодифенил). Его получают в технике бензидиновой перегруппировкой, открытой Зининым. Реакция заключается в изомеризации гидразобензола, получаемого восстановлением нитробензола.
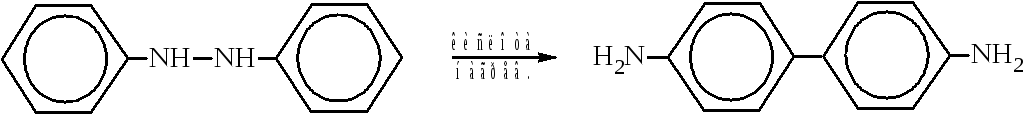
Бензидин в больших количествах используется в анилинокрасочной промышленности.
Трифенилметан и его производные могут быть получены, например, алкилированием бензола и его производных и другими методами.
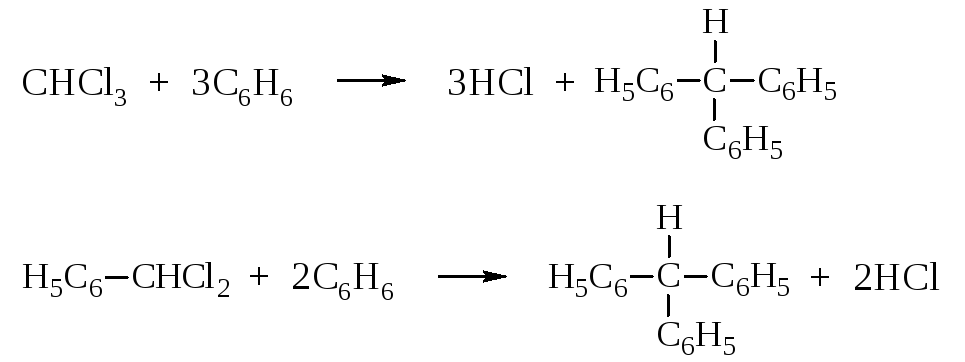
Трифенилметан и его производные обладают чрезвычайно подвижным водородным атомом или группами у центрального углерода. Объясняется это большой устойчивостью трифенилметильных радикалов или ионов благодаря стабилизирующему действию бензольных циклов.
Трифенилметан легко окисляется до трифенилкарбинола. Последний при действии HCl легко образует трифенилхлорметан. В свою очередь, это соединение восстанавливается до трифенилметана и гидролизуется до трифенилкарбинола.
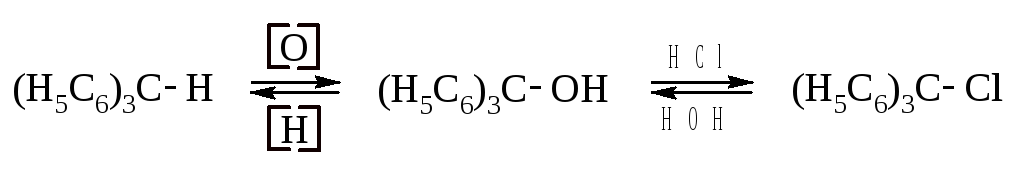
Водородный атом трифенилметана легко замещается также на металлы и галогены.
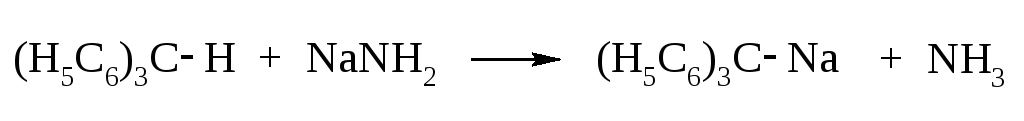
Многие производные трифенилметана с амино- или гидрокси-группами в бензольных ядрах являются красителями.
Первым промышленным красителем трифенилметанового ряда был фуксин. Его можно получить при окислении смеси толуидинов и анилина.
Фенол и фталевый ангидрид при нагревании с серной кислотой образуют фенолфталеин. Он используется в химии как индикатор и в медицине как слабительное (пурген).
К трифенилметановым относятся такие красители, как метиловый фиолетовый (чернила), кристаллический фиолетовый, анилиновый синий, аурин, эозин, малахитовый зеленый и целый ряд других.
Простейшим соединением, принадлежащим к группе многоядер-ных ароматических углеводородов с конденсированными ядрами, является нафталин.
Нафталин содержится в каменноугольной смоле (5 %), которая является почти единственным его источником.
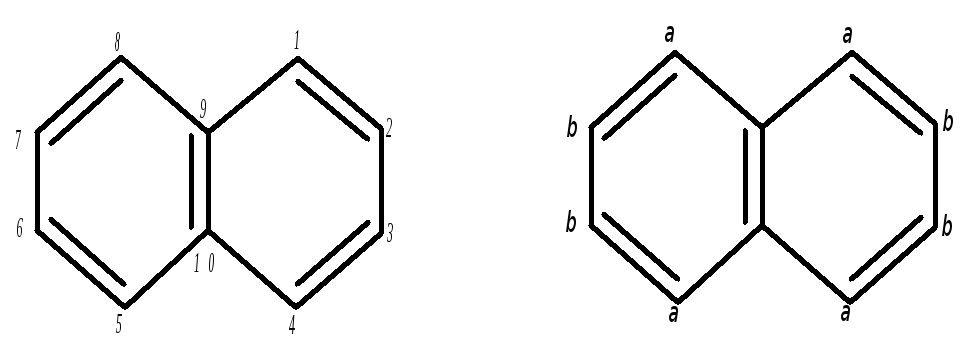
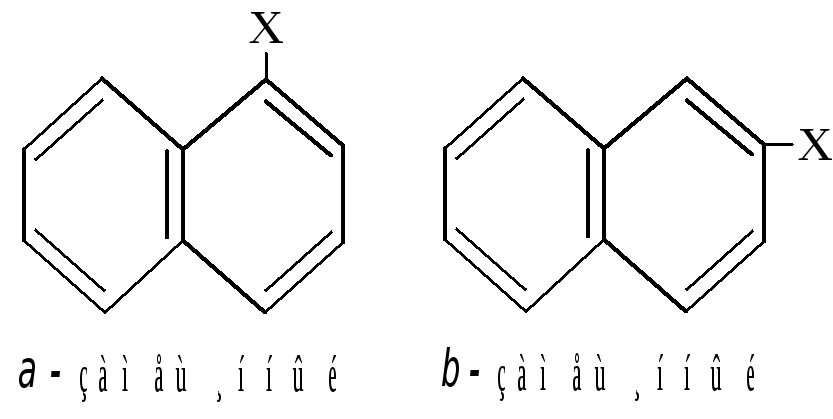
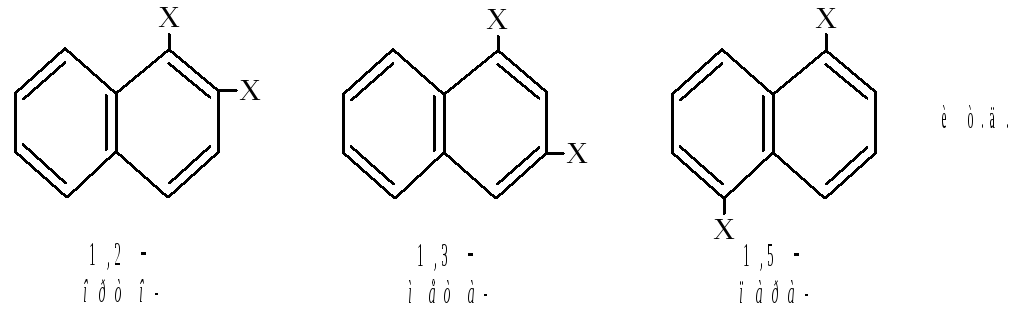
В соответствии с его структурной формулой может существовать два однозамещённых нафталина и десять дизамещённых.
Наличие в нафталине двух бензольных колец подтверждается следующими реакциями.
Окисление нафталина приводит к фталевой кислоте – это указывает на существование одного из бензольных ядер и орто-положение углеродных атомов второго цикла.
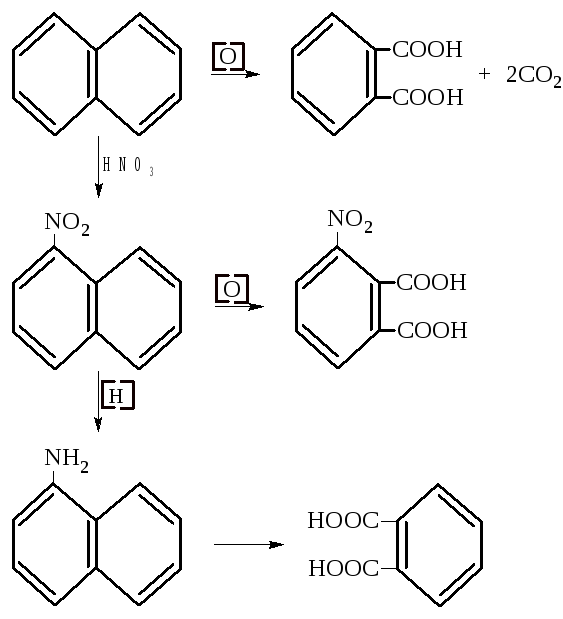
То же подтверждает окисление полученного нитрованием нафталина -нитронафталина. Восстановление -нитронафталина дает -нафтиламин. Аминогруппа активирует ядро, и окислению подвергается именно это аминосодержащее кольцо. Продуктом окисления опять-таки является фталевая кислота, что указывает на бензольный характер второго ядра.
Вполне понятно, что такой равномерности в распределении π-электронов как в бензоле, в нафталине нет. Поэтому нафталин менее ароматичен и более непределен, чем бензол.
Нафталин представляет собой кристаллическое вещество с tплав = 80 °C. Обладает большой летучестью (легко возгоняется).
Нафталин подобно бензолу способен вступать в реакции замещения и присоединения. Причём в этих реакциях он более активен. При замещении заместитель обычно становится в -положение.
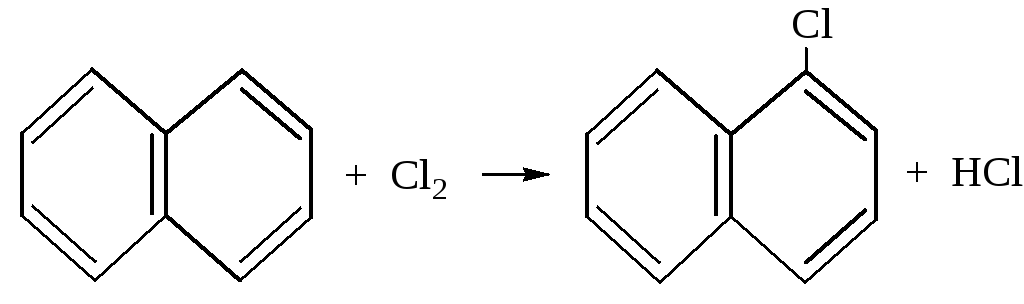
– При галогенировании нафталина получаются -галогеннафта-лины с небольшой примесью -галогенида.
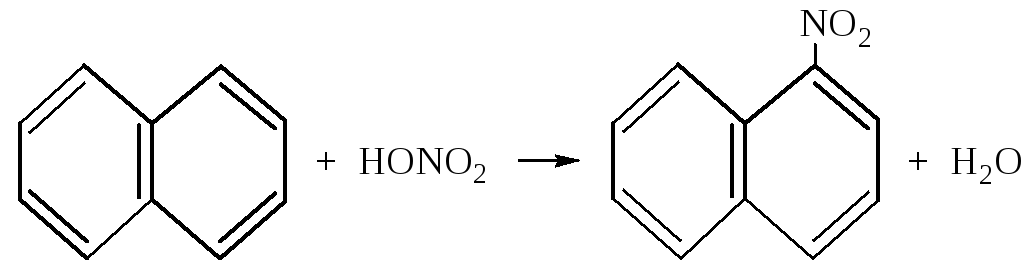
– При нитровании также в основном получается -нитронафталин.
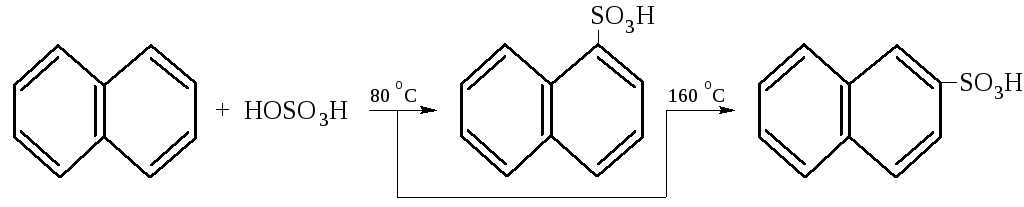
– Сульфирование при температуре 80 °C даёт -нафталинсульфо-кислоту, при температуре 160 °C – в основном -нафталинсульфо-кислоту, являющиеся исходнми продуктоми для синтеза многих красителей.
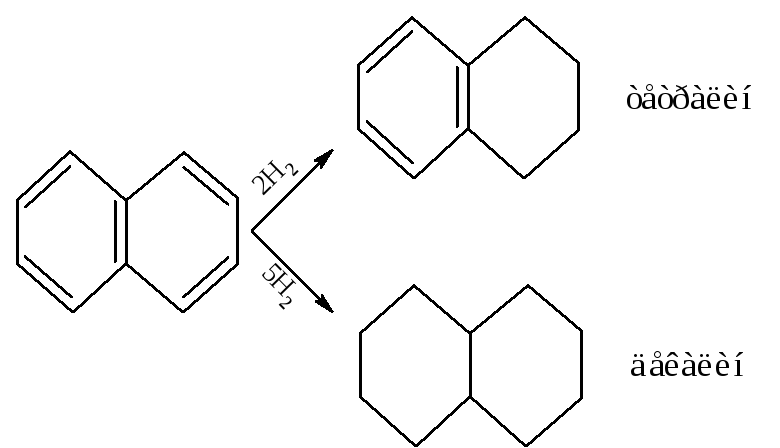
– Гидрируется нафталин легче бензола. При каталитическом гидрировании получаются тетралин и декалин, применяемые в технике как растворители.
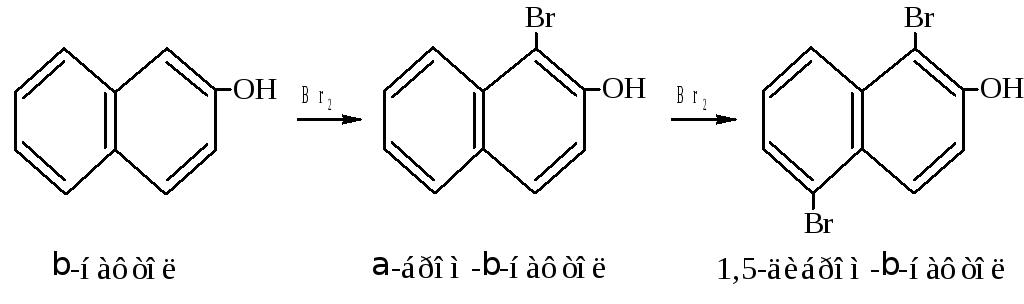
Реакции замещения в ядре нафтолов сначала идут в том же кольце, где находится гидроксил. Если галогенированию, нитрованию или сульфированию подвергается -нафтол, получаются пара-производные. Следующая замещающая группа встаёт в орто-положение.

При замещении в -нафтоле заместитель идёт в ближнее - положение. Второй заместитель направляется в другое ядро, к пятому -углероду, который находится как бы в пара-положении к гидрокси-группе.
Эфиры нафтолов имеют приятный запах и используются в парфюмерии. В основном же нафтолы идут на производство красителей.
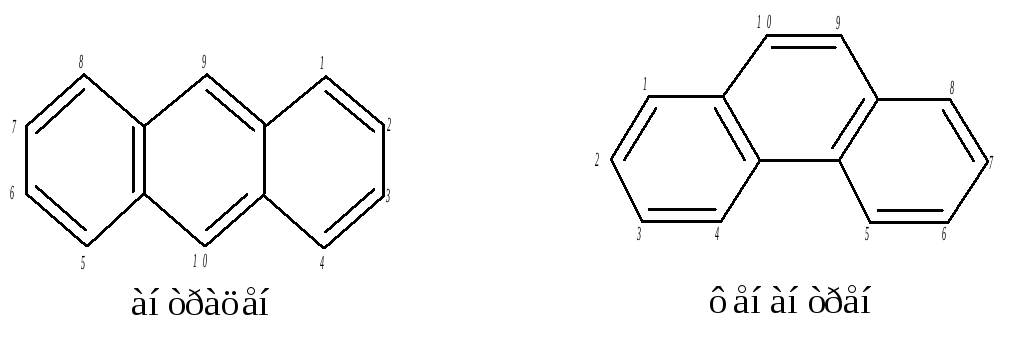
Добавлением ещё одного кольца из нафталина можно получить два изомерных углеводорода: антрацен и фенантрен.
В технике антрацен выделяют из каменноугольной смолы.
Антрацен – кристаллическое вещество с tплав.= 213 °С. Положения 1,4,5 и 8 – это -положения; 2,3,6,7 – b; 9,10 – мезо или .
Для антрацена характерна ещё большая непредельность, чем для нафталина. Наиболее активными являются положения 9 и 10, которые находятся под влиянием сразу двух колец. Присоединение водорода и брома идёт именно по этим положениям.
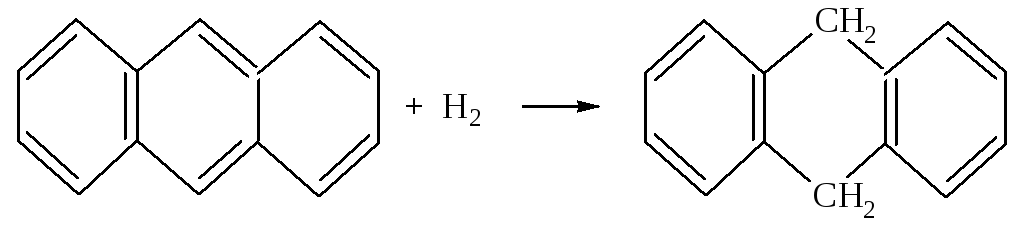
При действии окислителей антрацен даёт антрахинон.
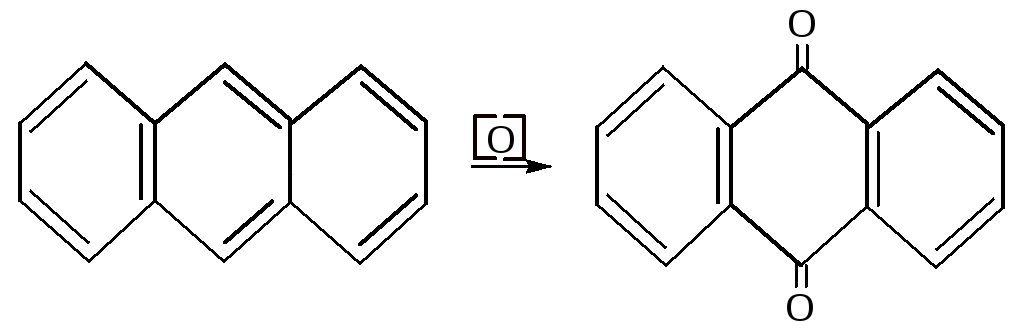
Антрацен и антрахинон идут на получение красителей.
Фенантрен также входит в состав каменноугольной смолы. Это кристаллическое вещество с tплав.= 99 °С. Фенантрен способен к реакциям присоединения в 9,10-положения.
Ароматические углеводороды с конденсированными ядрами могут иметь и большее количество колец: 4,5,6 и т.д. Они привлекают к себе внимание, потому что потенциально могут использоваться в анилинокрасочной и других областях промышленности. Кроме того, некоторые из них обладают канцерогенным действием и усиленно изучаются в связи с проблемами возникновения и профилактики онкозаболеваний.


 6H4
6H4
 6H5CH
6H5CH