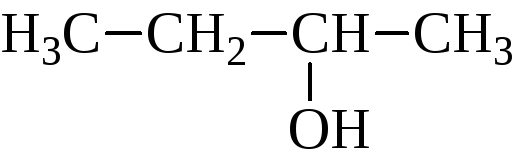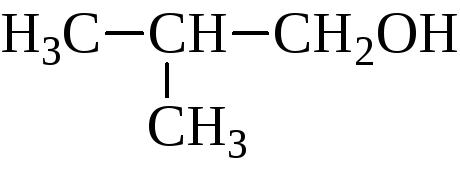- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
2 Гидроксисоединения
Соединения, получаемые при замене водородных атомов алифатических и алициклических углеводородов на гидроксильные группы (–OH), называются спиртами. Если гидроксильная группа непосредственно связана с ароматической системой – это фенолы. Число гидроксильных групп в молекуле спирта или фенола определяет их атомность.
2.1 Спирты
2.1.1 Одноатомные спирты
Спирты являются гидроксилпроизводными углеводородов. Они могут быть насыщенными и ненасыщенными.
2.1.1.1 Насыщенные одноатомные спирты
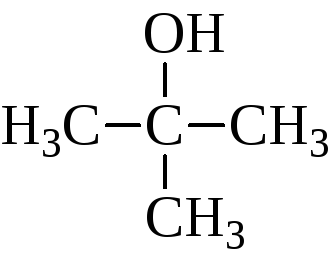
Изомерия спиртов зависит от строения углеродного скелета и от положения гидроксила. Например:
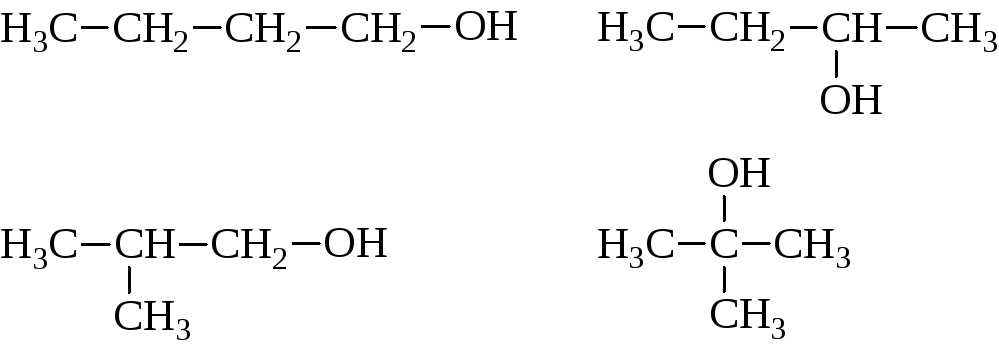
В зависимости от того, какой углерод, первичный, вторичный или третичный, несет гидроксил, различают первичные, вторичные и третичные спирты.
Номенклатура
Называют спирты обычно по радикалу, связанному с гидроксилом (радикально-функциональная номенклатура). По номенклатуре ИЮПАК название спирта образуется добавлением окончания –ол к названию алкана и указания номера углеродного атома основной цепи, несущего гидроксил; гидроксил должен примыкать к основной цепи. Кроме того, спирты можно называть как замещённые метилового спирта – карбинола:
|
|
По радикалу |
Производное карбинола |
ИЮПАК |
|
|
метиловый |
карбинол |
метанол |
|
|
этиловый или винный
|
метил- карбинол |
этанол |
|
|
пропиловый |
этил- карбинол
|
пропанол-1 |
|
|
изопропиловый |
диметил-карбинол |
пропанол-2 |
|
|
бутиловый |
пропил-карбинол |
бутанол-1 |
|
|
втор-бутиловый |
метилэтил-карбинол |
бутанол-2 |
|
|
изобутиловый |
изопропил- карбинол |
2-метил-пропанол-1 |
|
|
трет-бутиловый |
триметил-карбинол |
2-метил- пропанол-2 |
Способы получения
– Гидролиз галогеналкилов
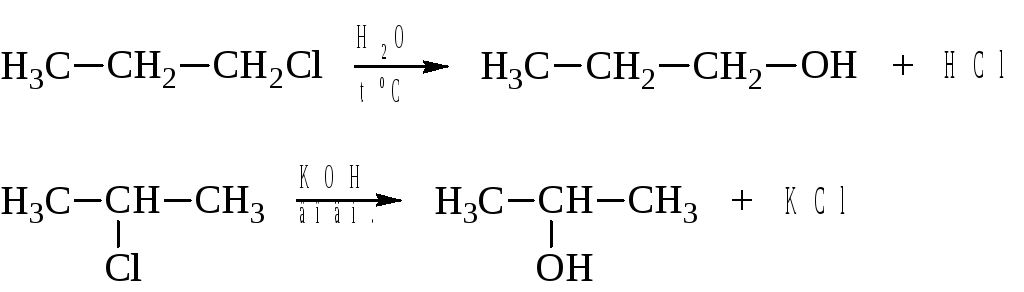
Эта реакция уже рассматривалась как одно из свойств галогеналкилов.
– Синтез с металлорганическими соединениями.
Реакция впервые была проведена А.М.Бутлеровым, А.М.Зайцевым и Е.Е.Вагнером с применением цинкорганических соединений. Однако наибольшее распространение получил синтез через магнийорганические соединения, разработанный Гриньяром. В гриньяровском синтезе на магнийгалогеналкил действуют альдегидами или кетонами. В этих соединениях электронная плотность смещена в сторону карбонильного кислорода:
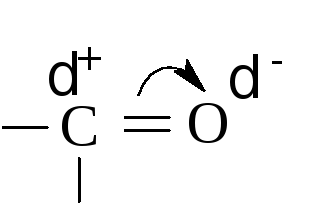
Углерод имеет дробный положительный, а кислород – дробный отрицательный заряд. В магнийгалогеналкиле, R-MgBr, отрицательно заряжен углеводородный радикал, который присоединяется к углероду карбонильной группы:
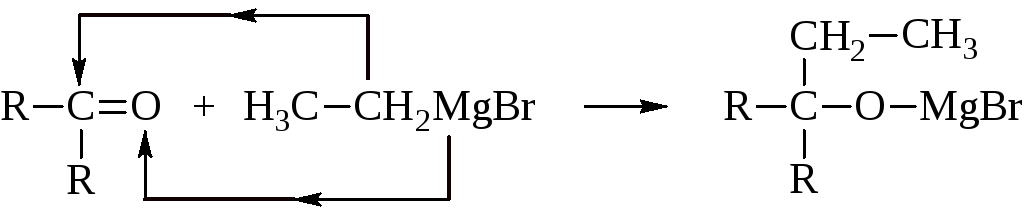
Полученное соединение легко гидролизуется с образованием спирта.
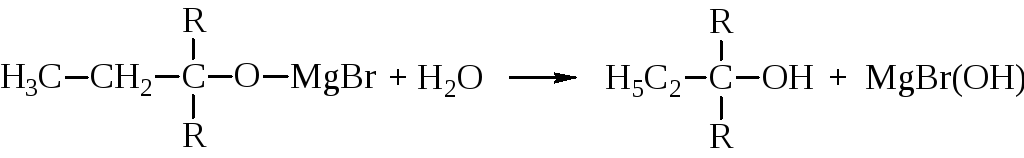
Как видно из этой схемы, синтезы с кетонами приводят к третичным спиртам.
В реакции с муравьиным альдегидом получаются первичные спирты.
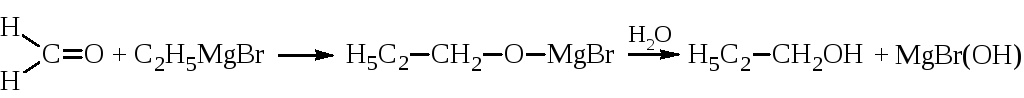
Со всеми другими альдегидами образуются вторичные спирты.
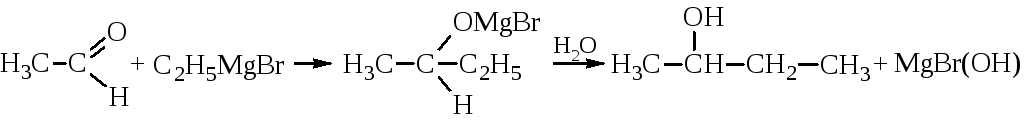
Реакция проводится в «абсолютном» эфире (абсолютно сухом, безводном). Гриньяровский синтез очень часто используется в лабораторной практике. Он однозначно даёт искомый спирт, который легко очищается.
– Гидратация олефинов
Уже упоминалось, что реакция идёт в присутствии серной кислоты в жидкой фазе и фосфорной кислоты на носителе в газовой фазе. В промышленности этим способом получают этиловый, изопропиловый и трет-бутиловый спирты.
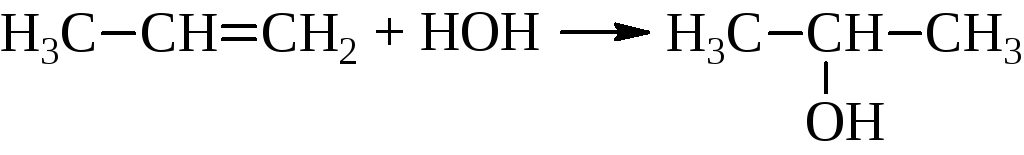
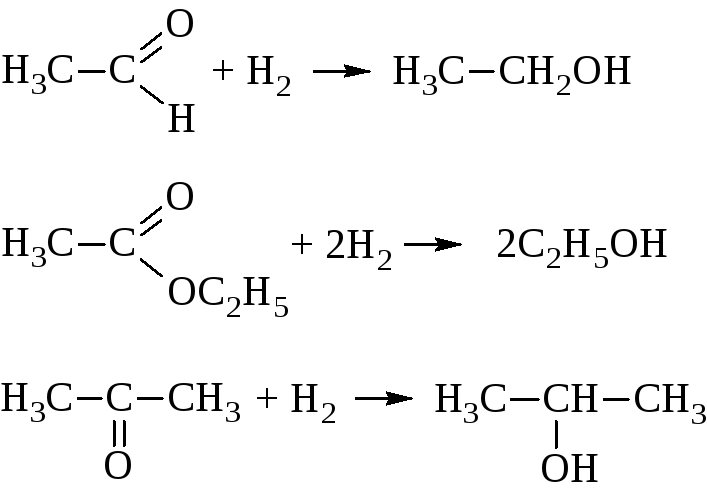
– Восстановление альдегидов, кетонов и сложных эфиров кислот в присутствии Pt, Pd, Ni, Co и других катализаторов.
При этом из альдегидов и сложных эфиров получаются первичные, а из кетонов – вторичные спирты.
– Брожение сахаров под действием дрожжей
Суммарное уравнение при брожении выглядит следующим образом:
![]()
Физические свойства
Спирты С1–С10 – жидкости, С11 и выше – твердые вещества. Спирты С1–С3 смешиваются с водой в любых соотношениях. По мере увеличения молекулярной массы растворимость спиртов падает.
Температуры кипения (°C):
CH3OH – 64,7,
C2H5OH – 78,5;
н-C3H7OH – 97,2;
изо-C3H7OH – 82,3;
н-C4H9OH – 117,7;
втор-C4H9OH – 100,0;
изо-C4H9OH – 108,4;
трет-C4H9OH – 89,0.
Первичные спирты среди изомеров кипят выше вторичных и выше третичных. В то же время, температуры кипения спиртов значительно выше температур кипения соответствующих углеводородов и галогеналканов: этан – минус 88,3 °C; бромистый этил – +38,0 °C; этанол – +78,5 °C. Такое аномальное повышение температур кипения спиртов обусловлено ассоциацией их молекул, подобно ассоциации молекул воды. В жидкости спирты присутствуют в виде ди-, три-, тетрамеров. Ассоциация вызвана образованием водородных связей, возникающих между водородными и кислородными атомами гидроксильных групп различных молекул спирта. В образовании водородной связи участвует неподелённая электронная пара кислорода:
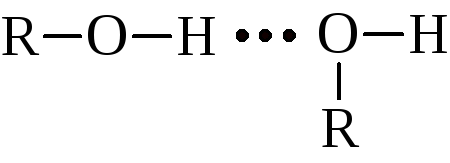
Водородная связь менее прочна по сравнению с обычными химические связями (табл. 5).
Таблица 5 – Энергии разрыва некоторых связей
|
Тип связи |
Энергии разрыва связей, кДж·моль1 |
|
|
345,6 |
|
|
413,0 |
|
|
460,2 |
|
|
~ 25 |
Чем менее гидроксил спиртов окружён алкильными группами, тем беспрепятственнее протекает ассоциация и тем выше кипит вещество. Отсюда – различие в температурах кипения первичных, вторичных и третичных спиртов.
Химические свойства
– При действии на спирты щелочных металлов происходит взаимодействие, подобное реакции натрия с водой, хотя и менее бурное. В этой реакции спирт проявляет кислотные свойства:
![]()
В результате реакции получаются алкоголяты. Называют их по радикалам: метилат, этилат, пропилат и т.д. натрия. Алкоголяты спиртов разлагаются водой:
![]()
Это свидетельствует о том, что вода проявляет более выраженные кислотные свойства, чем спирты.
– Гидроксильная группа спиртов способна замещаться на галоген при действии различных галогенирующих средств:
– галогеноводородных кислот:
СН3–СН2ОН + НСl → СН3–СН2Сl + Н2О
– галогенидов фосфора:

– тионилгалогенидов;
СН3–СН2–CH2–ОН+ SOCl2 → СН3–СН2– CH2Сl + SO2 + HCl
и других галогенирующих средств.
Наиболее активными галогенирующими средствами являются галогениды фосфора, наименее – галогеноводородные кислоты. Легче других галогенируются третичные спирты, труднее – первичные.
– Реакция этерификации
При действии на спирты минеральных и органических кислот образуются сложные эфиры. Реакция обратима.
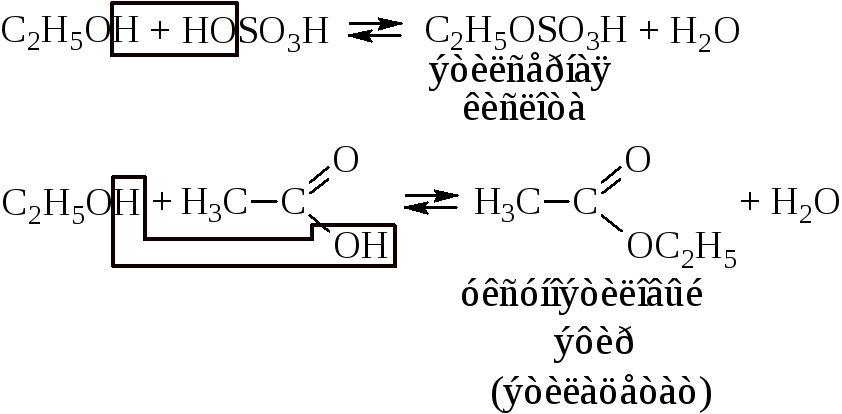
Н.А. Меншуткин показал, что скорость этерификации при одной кислоте первичных спиртов в ~2 раза больше, чем вторичных, и в ~20 раз больше, чем третичных.
– В присутствии водоотнимающих средств происходит внутри-молекулярное и межмолекулярное отщепление воды от спиртов.
Водоотнимающими веществами являются кислоты (H2SO4, H3PO4, щавелевая, бензолсульфокислота и другие), оксиды металлов (Al2O3, SiO2 и другие), соли (CuSO4, ZnCl2, SnCl4 и другие).
При межмолекулярной дегидратации образуются простые эфиры:
![]()
При более высокой температуре на этих же катализаторах идёт внутримолекулярная дегидратация с образованием алкенов:
![]()
Лёгкость дегидратации увеличивается в ряду: первичный → → вторичный → третичный спирт. Третичные спирты отщепляют воду уже при нагревании без катализатора или в присутствии йода.
Отщепление воды идет по правилу Зайцева.
– Дегидрирование и окисление
Спирты при температуре 100 °C…180 °C над Cu, Ni, Co, Pt, Pd подвергаются дегидрированию. Окисление может протекать в присутствии кислорода воздуха на медном катализаторе при температуре 300 °C…500 °C, а также под действием хромовой смеси, перманганата калия и других окислителей.
В обоих случаях при дегидрировании и окислении из первичных спиртов получаются альдегиды, из вторичных – кетоны. Третичные спирты окисляются очень трудно с разрывом углеродного скелета.
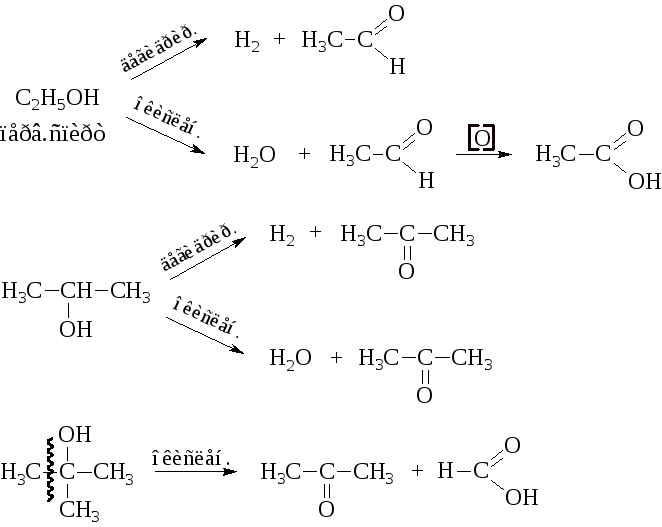
Образование различных продуктов при дегидрировании и окислении позволяет отличить первичные, вторичные и третичные спирты.
Отдельные представители
Метиловый спирт, CH3OH, кипит при температуре 64,7 °С. В промышле-ности основным способом его получения служит синтез из СО и Н2 на цинк-хромовом катализаторе ( ZnO+Cr2O3), tсинтеза= 400 °С и Р = 200…300 атм.
![]()
Раньше метанол получали сухой перегонкой древесины (отсюда и его тривиальное название «древесный спирт»).
Метанол имеет очень широкое применение. Он хороший растворитель и используется в лакокрасочной и нефтеперера-батывающей промышленности. В больших количествах из него получают формальдегид, метил- и диметиланилин, метиламины, многие красители, медицинские препараты и другие вещества. Метанол является сильным ядом.
Этиловый спирт кипит при температуре 78,3 °С. По объему производства этиловый спирт занимает ведущее место среди других органических продуктов. Этанол можно получать брожением сахаристых веществ, чаще всего глюкозы, которая содержится в виноградном соке. Сырьем может служить крахмал и целлюлоза, которые при гидролизе дают глюкозу. Источником крахмала служат хлебные злаки, рис, кукуруза, картофель – пищевые продукты, источником целлюлозы – древесина. Значительное развитие получил синтез этанола гидратацией этилена.
Большое количество этилового спирта идёт на получение дивинила – сырья для производства синтетического каучука, моторного топлива и добавок к нему, диэтилового эфира, хлороформа, этилена высокой чистоты, сложных эфиров, используемых как растворители лаков и как душистые вещества. Этанол – хороший растворитель и антисептик.
Пропиловый спирт выделяют из сивушного масла, побочного продукта при получении этанола брожением. Изопропиловый спирт получают гидратацией пропилена. Применяются эти спирты и их эфиры как растворители. Из изопропилового спирта дегидрированием или окислением получают ацетон.
Бутанол-1 в технике в основном получают брожением глюкозы. Он и его эфиры используются как растворители.
Изобутиловый спирт (2-метилпропанол-1) выделяют из сивушного масла. Идёт на получение изобутилена, изомасляного альдегида, используется как растворитель.
Третичный бутиловый спирт синтезируют гидратацией изобутилена. Это важное алкилирующее средство при введении в органическое соединение трет-бутильной группы.
Высшие спирты получают синтетически. Они используются в производстве моющих средств.