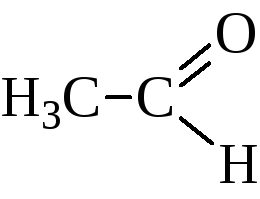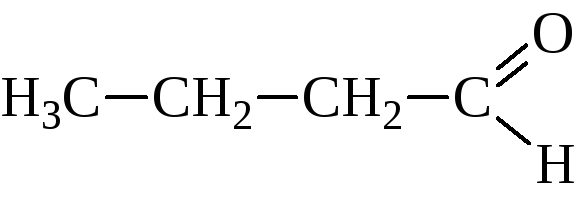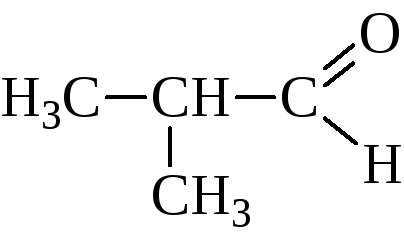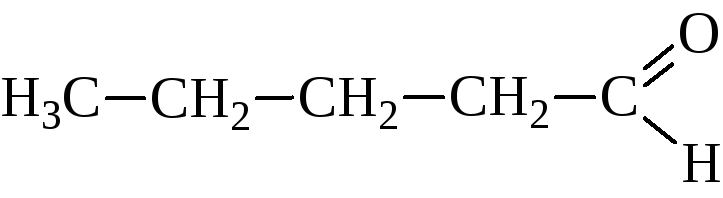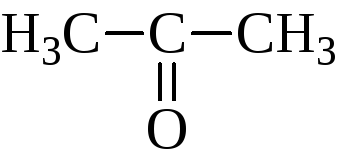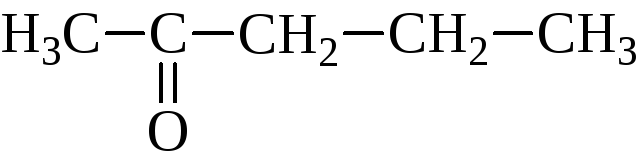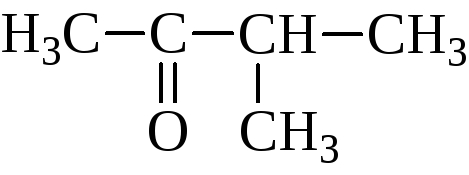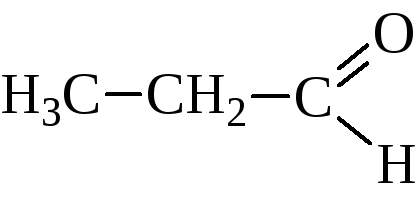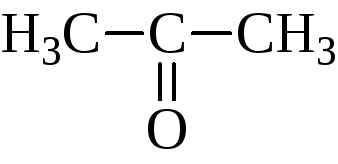- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
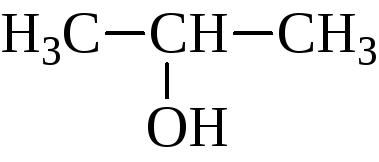
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
Органические окиси можно рассматривать как продукты внутримолекулярной дегидратации гликолей. Различают α, β, γ и т.д. окиси.
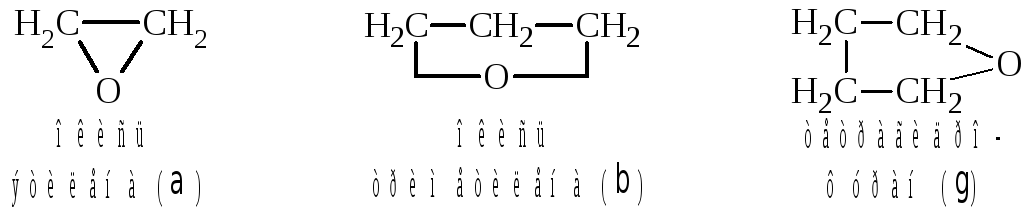
эпоксиэтан 1,3-эпоксипропан 1,4-эпоксибутан
Наибольшее практическое значение имеет окись этилена. В промышленных масштабах её получают из этилена через этиленхлоргидрин

или прямым окислением этилена кислородом воздуха при температуре ~ 250 °С на серебряном катализаторе.
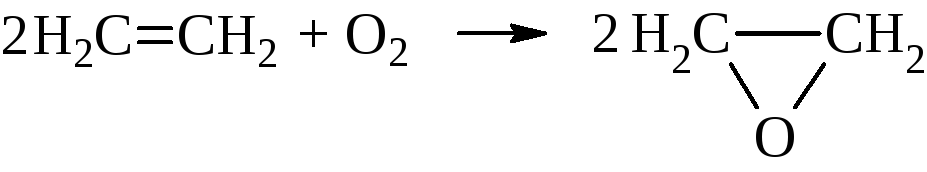
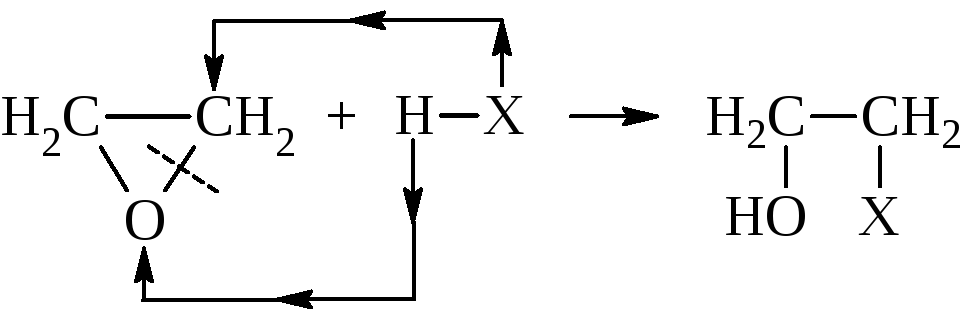
Окись этилена кипит при температуре 10,7 °С, с водой смешивается в любых отношениях. По химическим свойствам она мало похожа на простые эфиры. Это химически активное вещество, для которого характерно размыкание трёхчленного цикла. При этом активный атом водорода атакующего реагента неизменно идёт к кислороду, а остальная часть – к углероду окисного кольца.
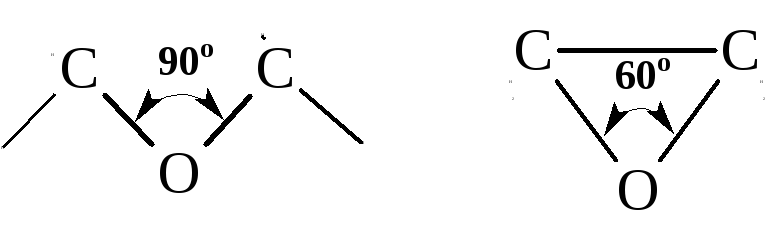
Неустойчивость окиси этилена обусловлена значительным отклонением величины угла С–О–С от нормальной, что приводит к сильному напряжению цикла.
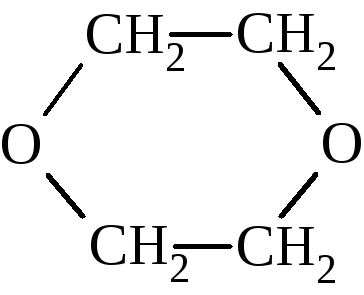
Диоксан же
 ,
,
имеющий нормальные валентные углы, по устойчивости не отличается от простых эфиров с открытой цепью. Окись этилена может присоединять воду с образованием этиленгликоля, аммиак с образованием этаноламина, амины, спирты и другие соединения с активным водородом.
На основе окиси этилена в промышленности органического синтеза получают в больших масштабах уксусную кислоту, этанол, диоксан (растворитель), этиленгликоль, эфиры этиленгликоля, этаноламин, акрилонитрил, моющие средства и целый ряд других продуктов.
Органические перекиси и гидроперекиси
Органические перекиси и гидроперекиси можно рассматривать как производные перекиси водорода, в которой соответственно один или оба водорода заменены на углеродные радикалы или ацильные группы
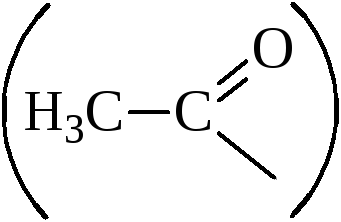
Гидроперекиси алкилов и ацилов имеют формулы R–О–О–H и
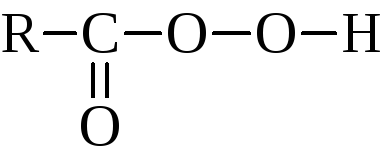
перекиси – соответственно R–О–О–R и
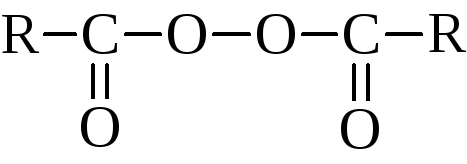 .
.
![]()

![]()
Перекиси и гидроперекиси алкилов можно получить действием спиртов на гидропероксид водорода. Устойчивость их значительно возрастает при переходе от первичных к третичным алкильным заместителям.
Гидроперекиси и перекиси первичных алкилов при перегреве взрываются.
При нагревании перекиси и гидроперекиси сравнительно легко разлагаются с образованием свободных радикалов.
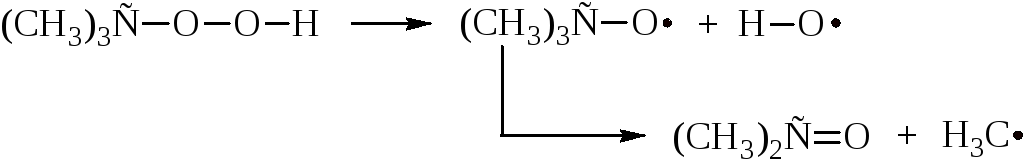
В промышленности перекиси и гидроперекиси используют как инициаторы реакций полимеризации и сильные окислители.
4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
4.1 Насыщенные карбонильные соединения
Как следует из реакций и способов получения, оксосоединения можно рассматривать как алканы, в которых два атома водорода при одном углероде замещены на двухвалентный атом кислорода. Функциональной группой оксосоединений является карбонильная группа
![]()
В зависимости от числа углеводородных радикалов, присоединенных к карбонильной группе, различают два вида оксосоединений:
альдегиды
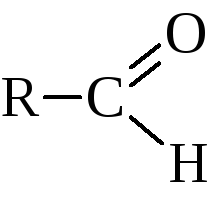
и кетоны
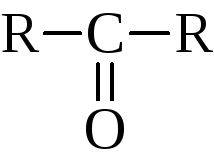 ,
,
в реакциях которых проявляется много общего, но имеются и различия.
Номенклатура и изомерия
Номенклатура этих двух групп соединений строится по-разному. Тривиальные названия альдегидов связывают их с тривиальными названиями кислот, в которые они переходят при окислении
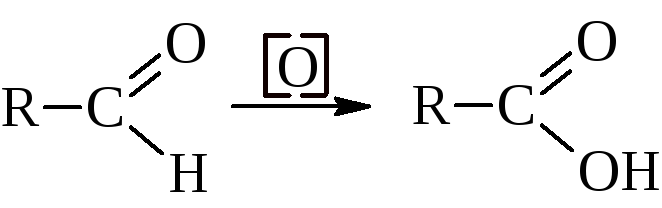
Из кетонов лишь немногие имеют тривиальные названия (например, ацетон). Для них широко используется радикально-функциональная номенклатура, в которой названия кетонов даются с использованием названий радикалов, связанных с карбонильной группой. По номенклатуре ИЮПАК названия альдегидов производятся от названия углеводорода с тем же числом атомов углерода путём добавления окончания –аль. Для кетонов эта номенклатура требует окончания –он. Цифрой обозначается положение функциональной группы в цепи кетона (табл. 6).
Таблица 6 – Названия некоторых карбонильных соединений
|
Соединение |
Названия по триви-альной и радикально-функциональной номенклатурам |
Названия по номенклатуре ИЮПАК |
|
|
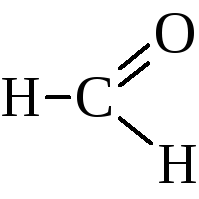
муравьиный альдегид; формальдегид |
метаналь |
|
|
уксусный альдегид; ацетальдегид |
этаналь |
|
|
пропионовый альдегид |
пропиональ |
|
|
масляный альдегид |
бутаналь |
|
|
изомасляный альдегид |
метилпропаналь |
|
|
валериановый альдегид |
пентаналь |
|
|
изовалериановый альдегид |
3-метилбутаналь |
|
|
ацетон; диметилкетон |
пропанон |
|
|
метилэтилкетон |
бутанон |
|
|
метилпропилкетон |
пентанон-2 |
|
|
метилизопропилкетон |
3-метилбутанон-2 |
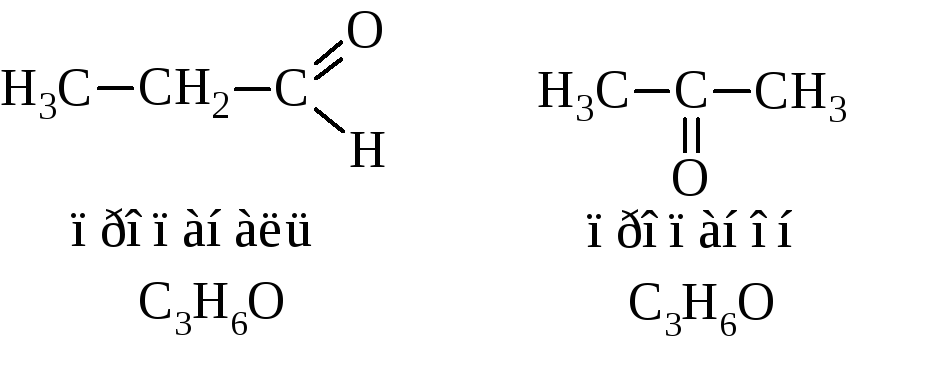
Изомерия альдегидов и кетонов полностью отражается номенклатурой и комментарий не требует. Альдегиды и кетоны с одинаковым числом атомов углерода являются изомерами. Например:
Способы получения
– Окисление или каталитическое дегидрирование первичных спиртов до альдегидов, вторичных – до кетонов. Реакции эти уже упоминались при рассмотрении химических свойств спиртов.

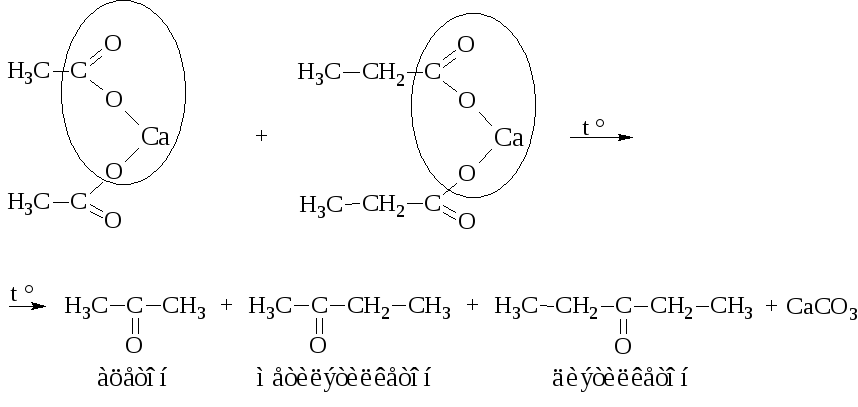
– Пиролиз кальциевых или бариевых солей карбоновых кислот, одна из которых – соль муравьиной кислоты, даёт альдегиды.
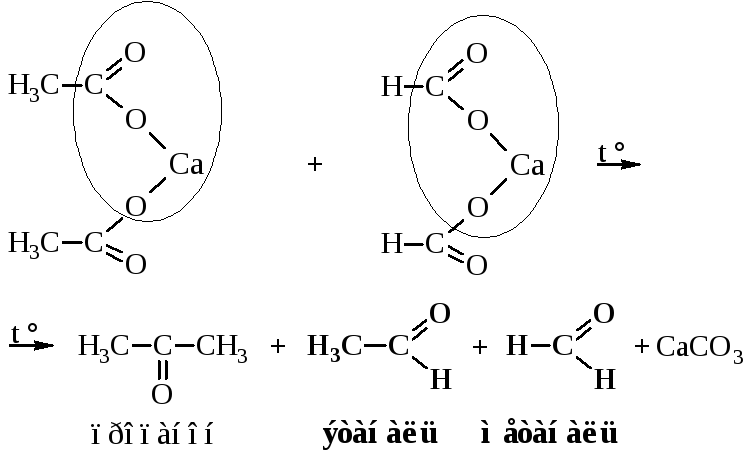
Во всех других случаях образуются кетоны.
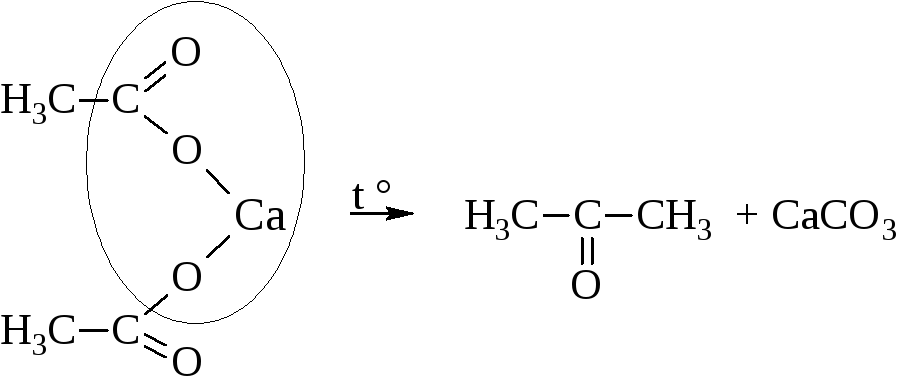
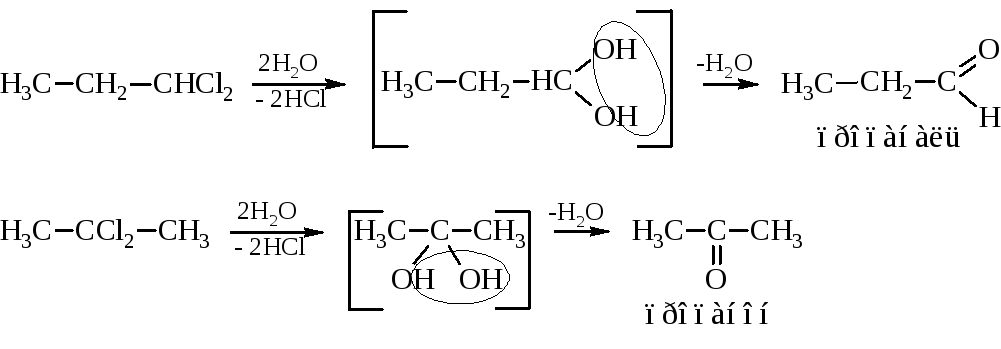
– Гидролиз геминальных (заместители у одного углерода) дигалогеналканов
– Гидратация ацетилена и его гомологов протекает в присутствии сульфата ртути (реакция Кучерова) или над гетерогенным катализатором. В соответствии с правилом Марковникова из ацетилена получается уксусный альдегид из его гомологов – кетоны (смотри свойства ацетиленовых углеводородов).

– Оксосинтез. Эта реакция синтеза альдегидов из алкенов и смеси оксида углерода (II) с водородом открыта в 1938 году Реппе и является основным промышленным методом синтеза альдегидов С3 и выше. Процесс проводят при температуре 100 °C…200 °C и 100…200 атмосфе-рах в присутствии кобальтового или никелевого катализатора.

Физические свойства
Муравьиный альдегид – газ. Остальные низшие альдегиды и кетоны – жидкости, плохо растворимые в воде. Альдегиды имеют удушливый запах. Кетоны пахнут обычно приятно. Температуры кипения оксосоединений растут с увеличением молекулярной массы. Кетоны кипят выше изомерных альдегидов. В противоположность спиртам альдегиды и кетоны – слабо ассоциированные жидкости. Поэтому они кипят значительно ниже соответствующих спиртов.
|
Структурная формула |
tкип, °C |
Структурная формула |
tкип, °C |
|
|
97,4 |
|
82,4 |
|
|
48,8 |
|
56,1 |
В то же время, карбонильные соединения кипят выше углеводородов с той же молекулярной массой. Плотность их ниже единицы.
Химические свойства
Альдегиды и кетоны – соединения весьма активные. Высокую реакционную способность сообщает им карбонильная группа. По своей природе двойная связь С=О в карбонильной группе сходна с двойной связью между атомами углерода. Она образуется из - и π-связей (как у алкенов). Однако кислород более электроотрицателен по сравнению с углеродом. Поэтому электронная плотность у кислорода выше, чем у углерода при двойной связи. Вследствие этого связь С=О сильно поляризуется и реакционная способность ее возрастает. Углеродный атом обладает электрофильными свойствами и способен присоединять нуклеофильные реагенты. Кислород имеет дробный отрицательный заряд и легко атакуется электрофильными реагентами.
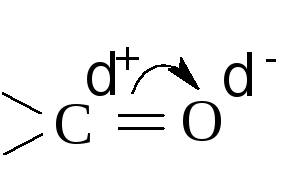
В то же время, карбонильная группа, связанная в альдегидах с одним алкильным радикалом, а в кетонах – с двумя, оказывает влияние на них, смещая электронную плотность с радикалов к положительно заряженному углероду карбонила.
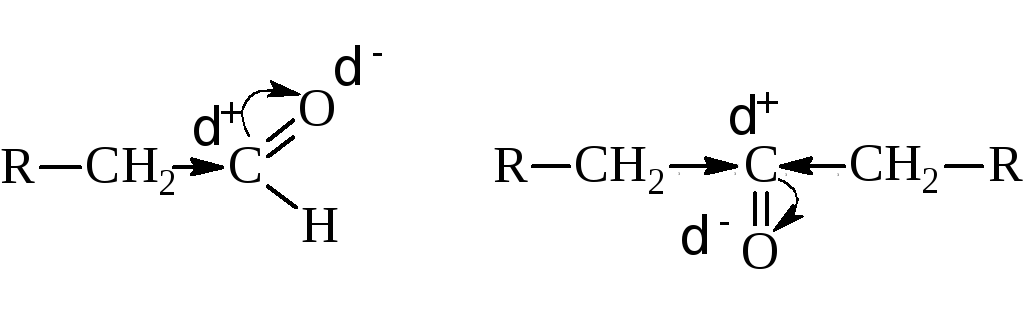
При этом степень поляризации связи С=О несколько понижается: у альдегидов в меньшей степени (за счет одного радикала), у кетонов – в большей (за счет двух радикалов), а подвижность водородов при -углеродах радикалов возрастает: у альдегидов в большей степени у кетонов – в меньшей.
Таким образом, для карбонильных соединений наиболее характерны два типа реакций: 1) реакции присоединения по карбонильной группе и 2) реакции, обусловленные высокой подвижностью водородных атомов при -углеродах радикалов по отношению к карбонилу. Причем в обоих типах реакций альдегиды активнее кетонов.
Реакции присоединения
– Восстановление. Присоединение водорода к оксосоединениям происходит в присутствии катализаторов гидрирования (Ni, Pt, Pd, Cu и другие). Альдегиды при этом дают первичные, а кетоны – вторичные спирты.
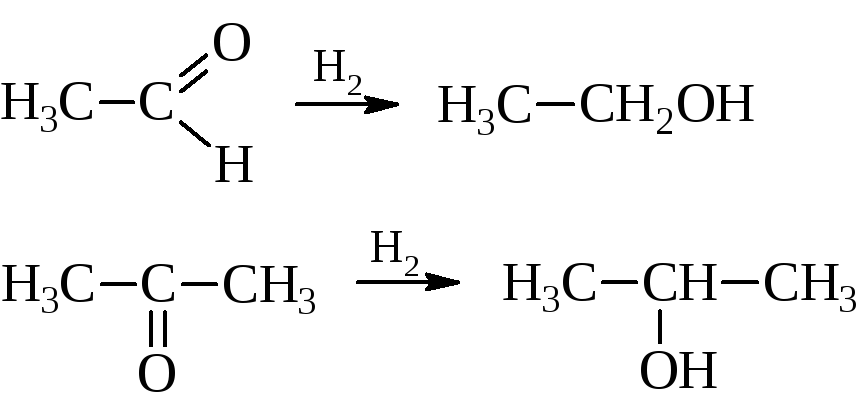
– Присоединение магнийорганических соединений. Эта типичная и важная реакция была рассмотрена в разделе спиртов.
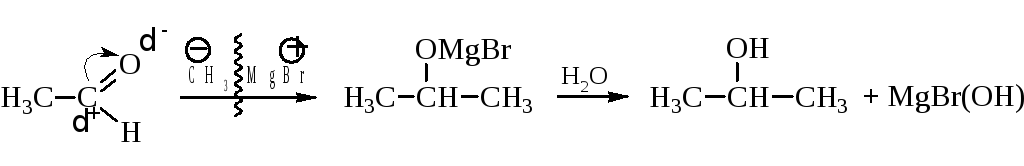
После гидролиза аддуктов из формальдегида получаются первичные спирты, из всех остальных альдегидов – вторичные, и из кетонов – третичные спирты.
– Присоединение синильной кислоты приводит к образованию α-оксинитрилов. Гидролизом из них получают α-гидроксикислоты.
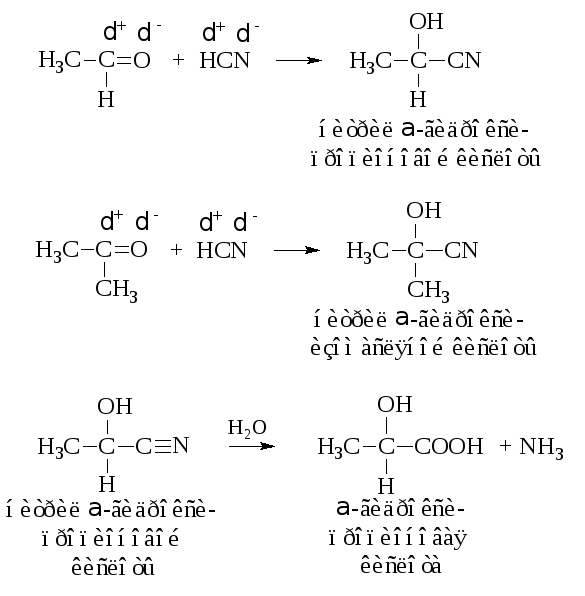
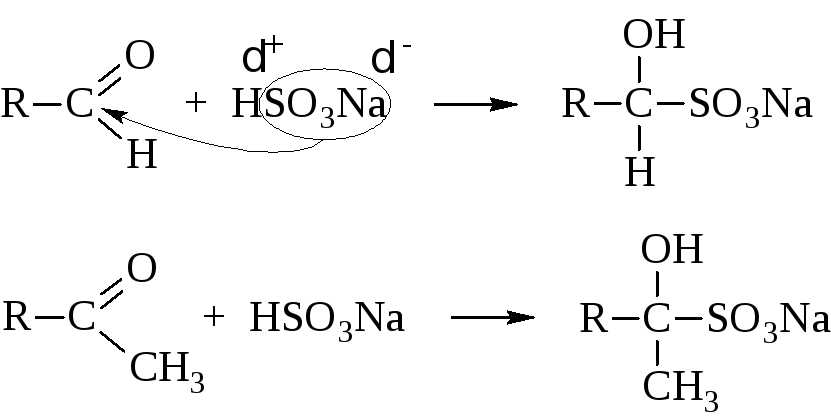
– Присоединение кислой соли бисульфита (гидросульфита) натрия даёт кристаллические вещества – бисульфитные производные альдегидов и кетонов. Из кетонов в реакцию вступают только метилкетоны R–CO–CH3.
При нагревании с раствором соды бисульфитные производные разлагаются с выделением свободного альдегида или кетона.
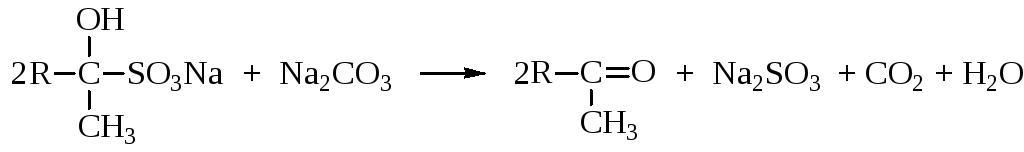
Реакция с бисульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки.
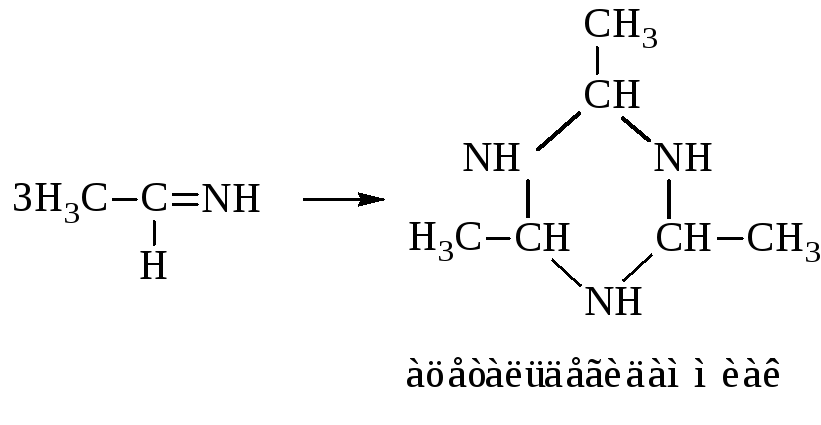
– Присоединение аммиака. Взаимодействие с аммиаком позволяет различить альдегиды и кетоны. Альдегиды образуют с аммиаком альдимины.

Альдимины легко циклизуются в альдегидаммиаки.
Кетоны реагируют с аммиаком очень медленно и сложно.
Совершенно своеобразна реакция формальдегида с аммиаком, приводящая к гексаметилентетрамину или уротропину.
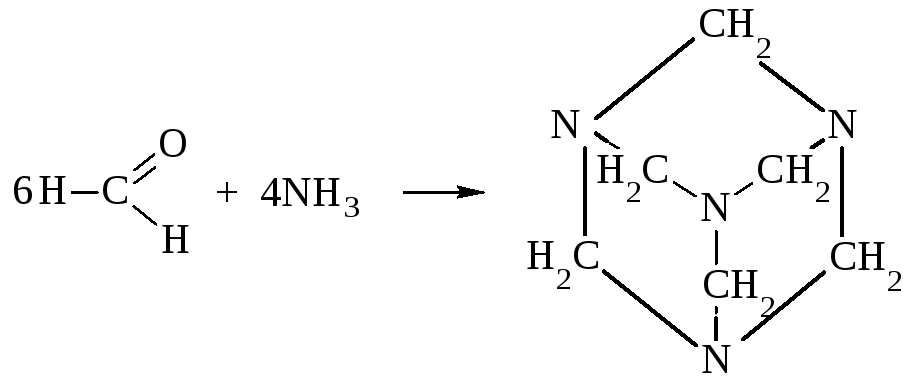
Уротропин и его комплекс с CaCl2 (кальцекс) применяется в медицине (мочегонное, противогриппозное средство). Нитрованием уротропина получают сильное взрывчатое вещество – гексоген.
– С гидроксиламином альдегиды и кетоны дают альдоксимы и кетоксимы (реакция идет по схеме, показанной выше для реакции с аммиаком). Суммарно:
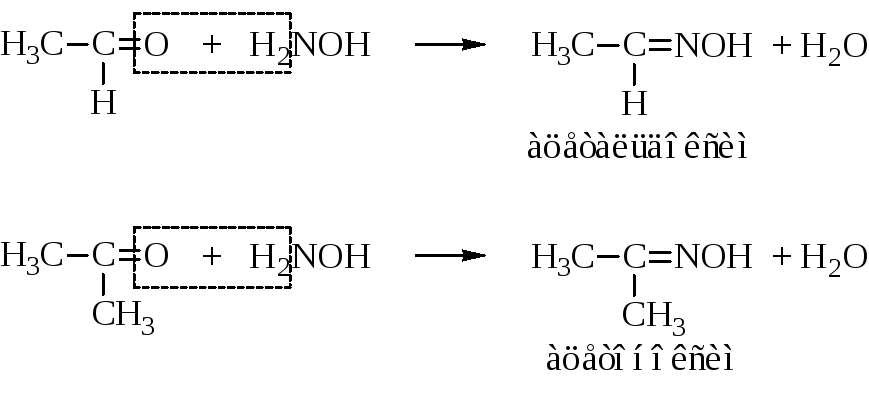
Под действием водоотнимающих средств (P2O5) альдоксимы (но не кетоксимы) переходят в нитрилы кислот. Это один из методов синтеза нитрилов.
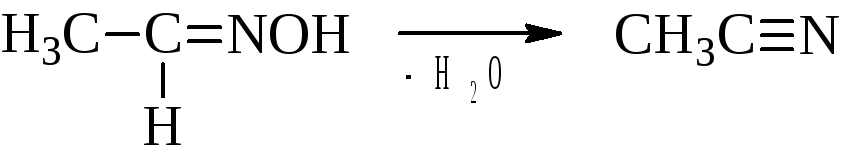
Реакция с солянокислым гидроксиламином является качественной реакцией на карбонильную группу и используется также для количественного определения альдегидов и кетонов.
– С гидразином в зависимости от соотношения реагентов реакция протекает по разному:
с одной молекулой оксосоединения образуются гидразоны
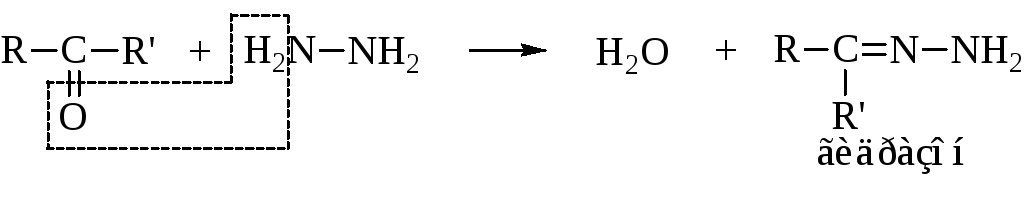
с двумя – азины (альдазины или кетазины)
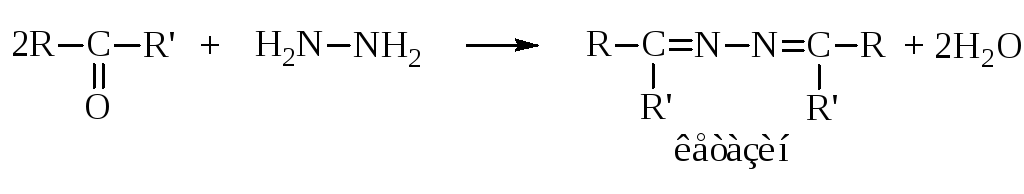
нагреванием гидразонов с твёрдым КОН получают насыщенные углеводороды.
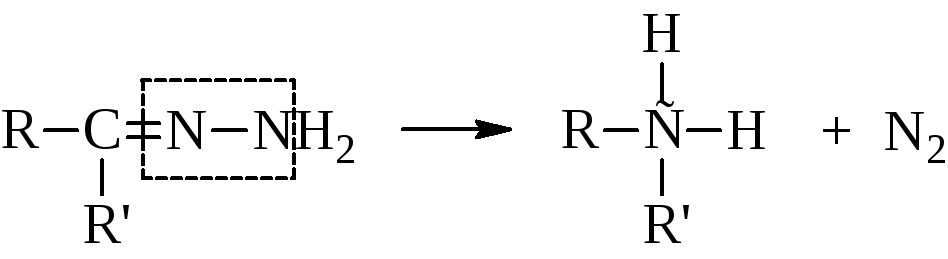
– Образование полуацеталей и ацеталей происходит при действии на альдегиды спиртов.
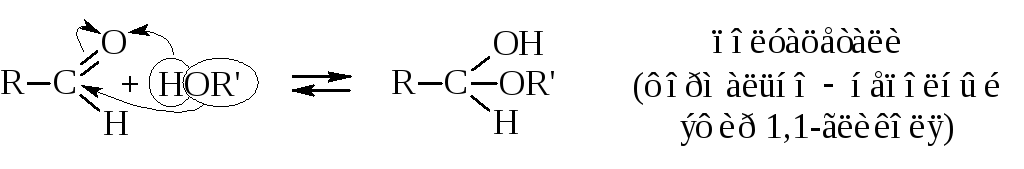
Полуацетальный гидроксил обладает повышенной реакционной способностью.
При добавлении к смеси капли серной кислоты образуются ацетали.
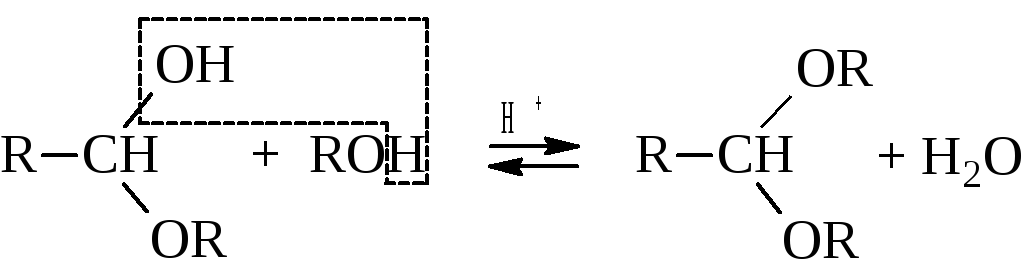
Образование ацеталей кетонов протекает более сложно.
Реакции получения ацеталей обратимы. При гидролизе ацеталей выделяются свободные альдегиды.
– Полимеризация. Эта реакция характерна только для альдегидов и протекает в кислой среде (следы H2SO4).
Так, уксусный альдегид при внесении в него капли H2SO4 вскипает (экзотермическая реакция) и полимеризуется в шестичленное гетероциклическое соединение, называемое паральдегидом.
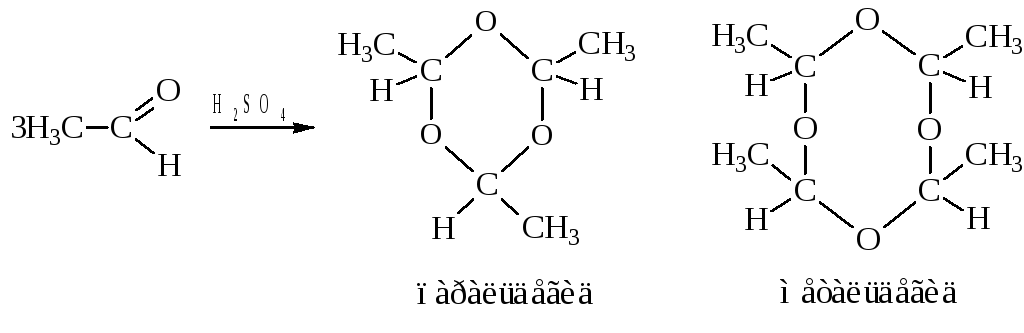
При температуре 0 °C происходит тетрамеризация и образуется твёрдый метальдегид, который используется как твёрдое горючее «твердый спирт». Оба полимера легко деполимеризуются.
Реакции, обусловленные высокой подвижностью атомов водорода при -углеродах по отношению к карбонильной группе
– Галогенирование
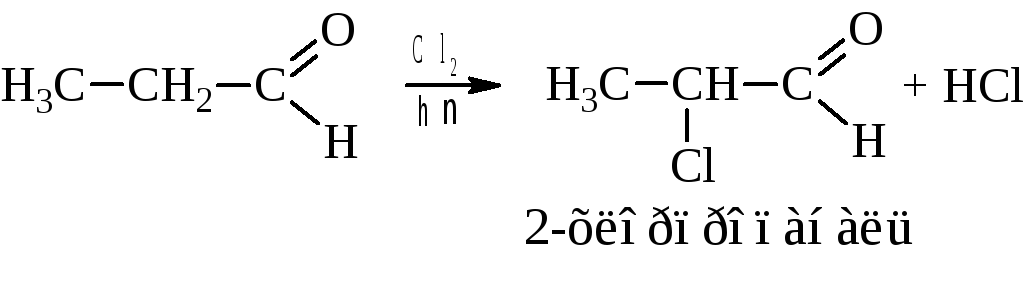
Замещение идет исключительно у -углерода.
– Реакции альдольной и кротоновой конденсации
В процессе конденсации одновременно реализуются оба типа реакций альдегидов и кетонов: одна из молекул карбонильного соединения диссоциирует по активированной связи СН -углерода и присоединяется по месту разрыва -связи карбонильной группы другой молекулы. Альдегиды конденсируются уже в слабоосновной среде (ацетат калия, К2СО3, K2SO3), кетоны реагируют труднее – в присутствии более сильных оснований, например, Ba(OH)2.
При конденсации уксусного альдегида образуется альдоль (альдегидоалкоголь), процесс называется альдольной конденсацией.
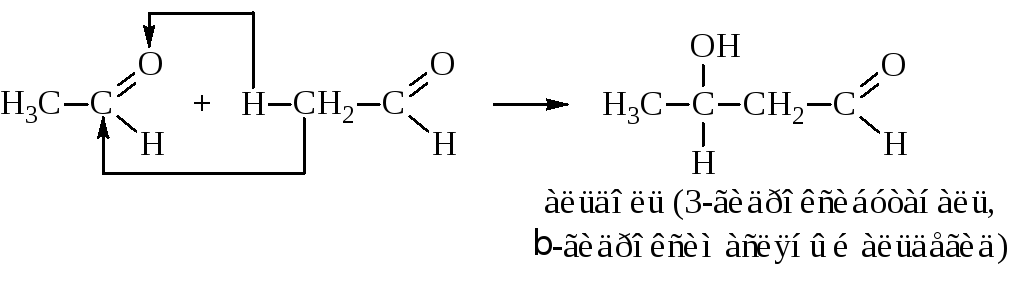
Альдольная конденсация кетонов протекает по такой же схеме:
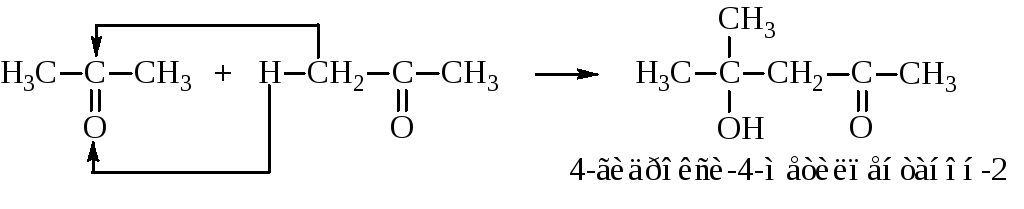
Может протекать также конденсация альдегидов с кетонами:
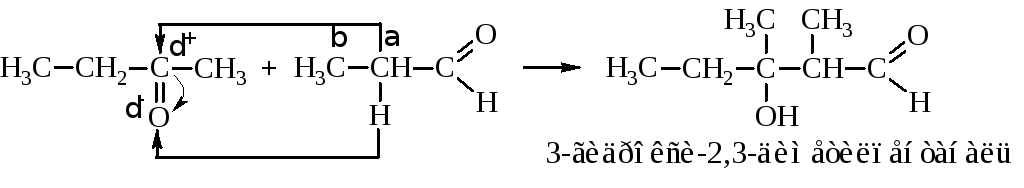
Альдоль при нагревании отщепляет воду с образованием непредельного оксосоединения. Причём водород опять уходит от α-углерода по отношению к карбонильной группе. Из альдоля ацетальдегида при этом получается кротоновый альдегид, а альдоля ацетона – окись мезитила.
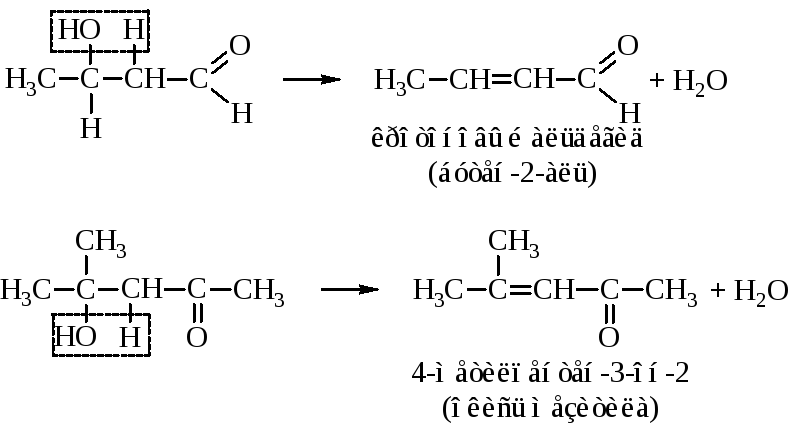
Процесс альдольной конденсации совместно с последующей реакцией дегидратацией альдоля называется кротоновой конденсацией.
Конденсации типа альдольной и кротоновой могут происходить не только между одинаковыми, но и различными молекулами альдегидов и кетонов, а также между альдегидами и кетонами.
Все эти реакции имеют огромное значение в органическом синтезе.
Реакции окисления
Окисление альдегидов протекает значительно легче, чем кетонов, в присутствии как сильных (H2Cr2O7, KMnO4), так и слабых окислителей. При этом образуются кислоты с тем же числом атомов углерода.
– Альдегиды, но не кетоны, вступают в реакцию «серебряного зеркала», которая является качественной пробой на присутствие альдегидной группы.
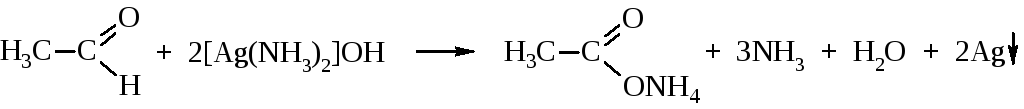
Реакция с фелинговой жидкостью также характерна только для альдегидов. Фелингова жидкость – это водно-щелочной раствор комплексной соли гидроксида меди и натрийкалиевой соли винной кислоты.
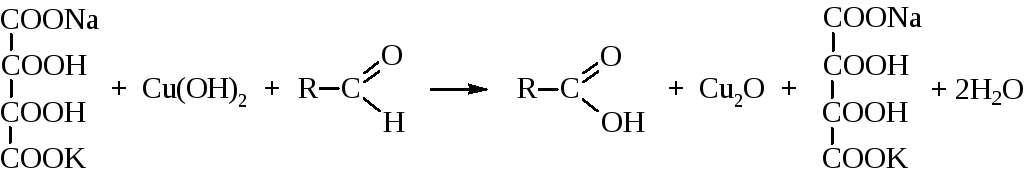
Красно-коричневая Cu2O выпадает в осадок.
– Кетоны окисляются в жёстких условиях с разрывом углеродной цепи по обе стороны от карбонильной группы с образованием смеси кислот и кетонов. По составу этой смеси можно судить о строении исходного кетона.
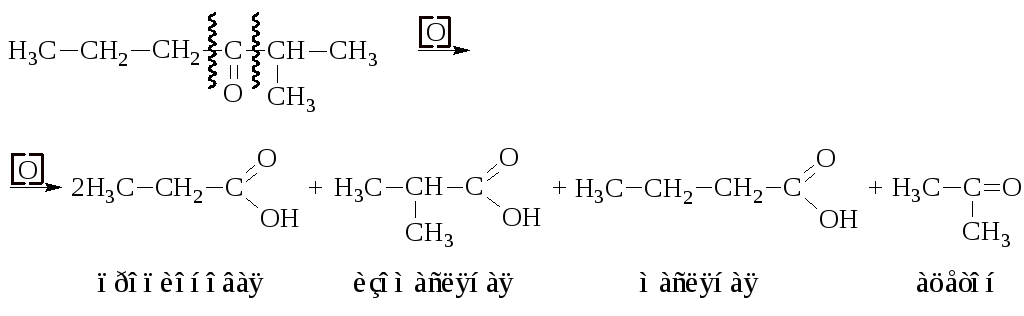
Получающиеся кетоны могут окислятся по такой же схеме далее.
Таким образом, наряду с общностью в химических свойствах альдегидов и кетонов при изучении их свойств обнаруживаются и существенные различия: альдегиды легко окисляются без изменения углеродного скелета, кетоны окисляются трудно с разрывом углеродной цепи; альдегиды полимеризуются в присутствии кислот, образуют альдегидаммиаки, ацетали. Кетоны не вступают в эти реакции.
Отдельные представители
Муравьиный альдегид (формальдегид). Это бесцветный газ с резким специфическим запахом, tкип° = –21 °C . Формальдегид в виде 40 %-ного водного раствора, содержащего 5 %…8 % метанола, получают в значительных количествах каталитическим окислением метанола. Это так называемый формалин. Формалин используется как дезинфицирующее средство.
Всё большее значение приобретает способ получения формальдегида неполным окислением метана или углеводородов крекинга нефтяных фракций.
Из-за отсутствия в молекуле формальдегида алкильной группы ему присущи некоторые специфические свойства.
– Реакция Канниццаро. В щелочной среде часть молекул формальдегида восстанавливается до метанола, другая часть за счёт кислорода воды окисляется до муравьиной кислоты.
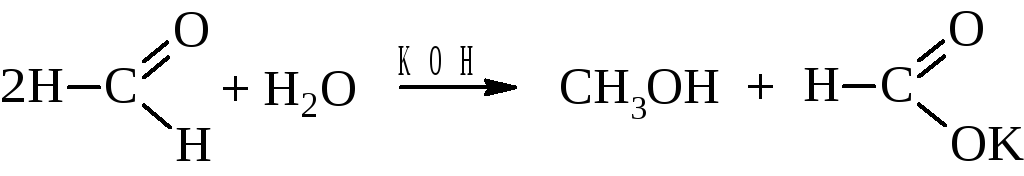
– Реакция с аммиаком, которая упоминалась ранее.
– Сухой газообразный формальдегид в присутствии катализаторов [Fe(CO)5] способен к полимеризации.
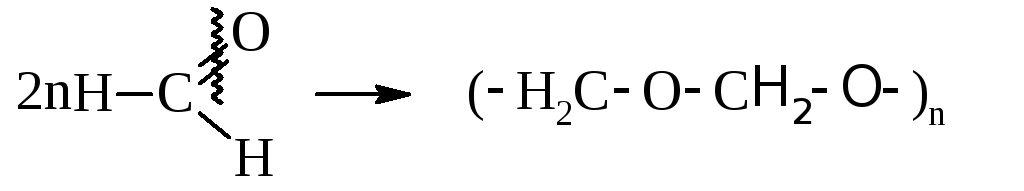
Полиформальдегид не растворим ни в одном растворителе и идёт на изготовление синтетического волокна и различных изделий.
– При конденсации с фенолом получаются фенолформ-альдегидные смолы, с мочевиной – карбамидные смолы, имеющие широкое применение.
Уксусный альдегид (ацетальдегид)
Кипит при температуре 21 °C. Ацетальдегид получают гидратацией ацетилена, дегидрированием этилового спирта, изомеризацией окиси этилена, каталитическим окислением углеводородов. Он служит важным полупродуктом в промышленных синтезах этанола, уксусной кислоты, кротонового и масляного альдегидов, пентаэритрита, альдоля, ацеталей и других веществ.
Ацетон
Температура кипения 56,1 °C. Ацетон является многотоннажным растворителем. В промышленности он получается совместно с фенолом через гидроперекись изопропилбензола. Он является также исходным продуктом для синтеза метакриловой кислоты и метилметакрилата (мономер для получения «органического стекла» и других полимеров), кетена, СН2=С=О, из которого получают уксусный ангидрид, и других продуктов.