
- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 1
- •Содержание
- •Часть 1
- •Часть 2
- •Предисловие
- •Введение
- •1 Углеводороды
- •1.2 Алкены (этиленовые углеводороды или олефины)
- •1.3 Диеновые углеводороды (алкадиены)
- •1.4 Алкины (ацетиленовые углеводороды)
- •1.5 Алициклические углеводороды
- •1.6 Ароматические углеводороды
- •2 Гидроксисоединения
- •2.1 Спирты
- •2.1.1 Одноатомные спирты
- •2.1.1.1 Насыщенные одноатомные спирты
- •2.1.1.2 Ненасыщенные одноатомные спирты
- •2.1.2 Многоатомные спирты
- •2.1.2.1 Гликоли
- •2.1.2.2 Глицерин
- •2.2 Фенолы и ароматические спирты
- •2.2.1 Фенолы
- •2.2.2 Ароматические спирты
- •3 Простые эфиры
- •3.1 Алифатические простые эфиры
- •3.2 Циклические простые эфиры или органические окиси (эпоксисоединения)
- •4 Карбонильные соединения (альдегиды и кетоны, оксосоединения )
- •4.1 Насыщенные карбонильные соединения
- •4.2 Ненасыщенные карбонильные соединения
- •4.3 Ароматические карбонильные соединения
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 1
2.1.1.2 Ненасыщенные одноатомные спирты
Ненасыщенные спирты могут быть этиленового, ацетиленового и других рядов ненасыщенных соединений. Следует иметь в виду, что алкены не могут нести гидроксил при углероде во втором валентном состоянии (sp2). Структуры

неустойчивы и изомеризуются в

Вот некоторые ненасыщенные спирты:
|
|
аллиловый спирт, винилкарбинол, пропенол |
|
|
метилвинилкарбинол, бутен-3-ол-2 |
|
|
пропаргиловый спирт, ацетиленилкарбинол, пропин-2-ол-1 |
Виниловый спирт, СН2=СН–ОН, в свободном состоянии не существует. Однако, известны его эфиры, например, винилацетат, получаемый из уксусной кислоты и ацетилена:
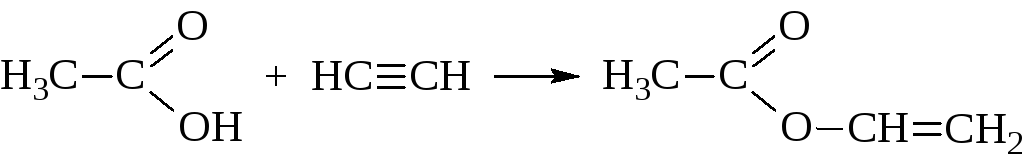
Винилацетат используется для получения поливинилацетата и поливинилового спирта, из которого готовят ценные полимеры.
Аллиловый спирт обладает свойствами как спиртов, так и олефинов. Получают его гидролизом хлористого аллила в 5 %-ном растворе щёлочи.
![]()
Используют в производстве глицерина.
Пропаргиловый спирт получают конденсацией ацетилена с формальдегидом:

Является промежуточным продуктом в синтезах аллилового спирта, глицерина, дивинила.
2.1.2 Многоатомные спирты
Спирты, содержащие несколько гидроксильных групп, называются многоатомными. Различают двух-, трех-, четырехатомные и т. д. спирты. Двухатомные спирты называют гликолями, трехатомные – глицеринами.
2.1.2.1 Гликоли
Гидроксильные группы в гликолях содержатся у различных атомов углерода. Гликоли с двумя гидроксилами у одного углеродного атома нестойки. Они отщепляют воду с образованием альдегидов или кетонов.
Изомерия гликолей определяется взаимным расположением гидроксильных групп и изомерией углеродного скелета. В зависимости от взаимного расположения групп OH– различают α-, β-, γ-, δ-, … гликоли. В зависимости от характера углеродных атомов, несущих гидроксилы, гликоли могут быть первично-вторичными, первично-третичными, двупервичными, двувторичными и т.д.
Названия гликолей могут даваться двумя способами. По номенклатуре ИЮПАК к названию основной углеродной цепи добавляют суффикс –диол и указывают номера углеродных атомов самой длинной углеродной цепи, несущих гидроксильные группы. Названия α-гликолей могут производиться от названия соответствующего этиленового углерода с добавлением слова гликоль. Классификация и названия гликолей даны ниже на примере бутандиолов:
-

α-гликоль
первично-вторичный
бутандиол-1,2;
1,2-бутиленгликоль
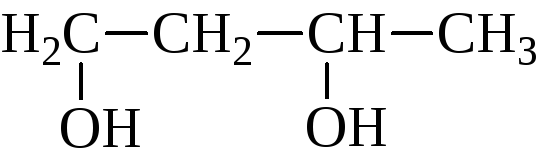
β-гликоль
первично-вторичный
бутандиол-1,3

γ-гликоль
дву-
первичный
бутандиол-1,4
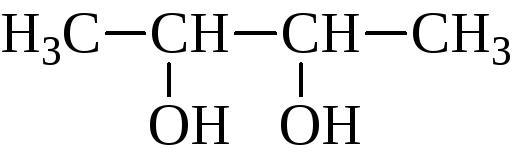
α-гликоль
дву-
вторичный
бутандиол-2,3

α-гликоль
первично-третичный
2-метилпропандиол-1,2
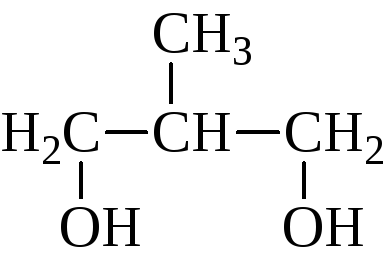
β-гликоль
дву-
первичный
2-метилпропандиол-1,3
Способы получения
В принципе, гликоли могут быть получены всеми обычными синтетическими методами получения спиртов.
Примером могут служить следующие реакции.
– Гидролиз дигалогенпроизводных насыщенных углеводо-родов и галогенгидринов:

– Гидратация α-окисей в кислой среде:

– Окисление олефинов перманганатом калия в разбавленном водном слабощелочном растворе (реакция Вагнера) или пероксидом водорода в присутствии катализаторов (CrO3):


Физические свойства
Низшие гликоли хорошо растворимы в воде. Плотность их выше, чем у одноатомных спиртов. Соответственно выше и температуры кипения из-за значительной ассоциации молекул: например, этиленгликоль кипит при температуре 197,2 °C; пропиленгликоль – при температуре 189 °C и бутандиол-1,4 – при температуре 230 °C.
Химические свойства
Все сказанное ранее о свойствах соответствующих одноатомных спиртов приложимо и к гликолям. При этом следует помнить, что в реакцию может вступать как один гидроксил, так и сразу оба.
– Окисление двупервичных гликолей дает альдегиды:

– При окислении α-гликолей йодной кислотой происходит разрыв связи между углеродными атомами, несущими гидроксилы, и образование соответствующих альдегидов или кетонов:

Метод имеет большое значение для установления строения α-гликолей.
– Результаты внутримолекулярного отщепления воды от гликолей в значительной мере зависят от типа гликоля.
Дегидратация α-гликолей протекает с образованием альдегидов или кетонов, γ-гликоли за счет атомов гидроксильных групп отщепляют воду с образованием гетероциклических соединений – тетрагидрофурана или его гомологов:

Первая реакция идёт через образование карбониевого иона с последующим перемещением атома водорода с его электронной парой:

При парофазной дегидратации над Al2O3 α-двутретичных гликолей, называемых пинаконами, получаются диеновые углеводороды:

– Межмолекулярная дегидратация приводит к образованию гидроксиэфиров или циклических простых эфиров:

Температура кипения диэтиленгликоля 245,5 °C. Его используют как растворитель для заполнения тормозных гидравлических систем, при отделке и крашении тканей.
Среди циклических простых эфиров наибольшее распространение как растворитель получил диоксан. Он получен впервые А.Е. Фаворским нагреванием этиленгликоля с серной кислотой:

Этиленгликоль – это вязкая бесцветная жидкость, сладковатая на вкус, tкип = 197,2 °C. В промышленных масштабах получается из этилена по трем схемам.

В смеси с водой этиленгликоль сильно понижает температуру её замерзания. Например, 60 %-ный водный раствор гликоля замерзает при температуре – 49 °C и с успехом применяется как антифриз. Большая гигроскопичность этиленгликоля используется для приготовления печатных красок. Большое количество этиленгликоля идёт на получение пленкообразующих материалов, лаков, красок, синтетических волокон (например, лавсана – полиэтилентерефталата), диоксана, диэтиленгликоля и других продуктов.

