
- •Часть I. Элементы кристаллографии лекция №1. Фазовое равновесие.
- •Лекция №2 Основы закономерности строения кристаллов.
- •Лекция №3 Геометрия пространственной решётки
- •Лекция №4 Важнейшие кристаллографические формулы
- •Лекция №5 Симметрия кристаллов. Системы трансляции.
- •3C4, 4c3, 6c2, 9p, 1z.
- •Лекция №6- Основные понятия кристаллохимии.
- •Лекция № 7. Термодинамика фазовых превращений
- •Лекция №8 Механизм процесса кристаллизации
- •Часть II. Теория сплавов. Диаграммы состояния лекция №9 Основные типы взаимодействия в твердом состоянии
- •Лекция №10 Промежуточные фазы в сплавах
- •Лекция №11 Правило фаз
- •Общие замечания по построению диаграммы состояния.
- •Лекция 12 Диаграммы состояния1-го и 2-го родов
- •Лекция №13 Диаграммы состояния 3-го и 4-го родов
- •Лекция №14 Обзор диаграмм состояния двойных систем
- •Лекция №15 Системы с тремя компонентами.
- •Часть III. Элементы фрактального анализа лекция 16 Фрактальный анализ микроструктур
- •Приборостроения и информатики
- •Курс лекций
Лекция № 7. Термодинамика фазовых превращений
Фазовые превращения. Строение сплавов. Диаграмма состояния.
Любое вещество, как известно, может находиться в трех агрегатных состояниях: жидком, твердом, газообразным(переход из одного в другое называется фазовый переход) Четвертым агрегатным состоянием часто называют плазму(газ заряженных частиц-ионов и электронов) Однако это утверждение не точно, т.к. между плазмой и газом нет фазового перехода. Реамуация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится. это можно представить в виде так называемой диаграммы состояния (см. рисунок).

Линии на диаграмме состояния соответствуют условиям, при которых находятся в равновесии жидкая и твердая, жидкая и газообразная, твердая и газообразные вазы. Следовательно, каждая точка, принадлежащая одной из линий, соответствует условиям фазового перехода из одного состояния в другое, или, что тоже самое, условием равновесия между жидкой и твердой, жидкой и газообразной, твердой и газообразной фазами. Точка пересечения линий, обведенная на рисунке пунктирным кружочком, соответствует условиям равновесия всех трех фаз.
Чем же объясняется существование при одних температурах жидкого, а при других твердого или газообразного состояния?
В природе все самопроизвольно протекающие превращения обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладающей меньшим запасом энергии. Поясним примером. тяжелый шарик из положения 1(см. рисунок) стремится попасть в более устойчивое положение2 т.к. потенциальная энергия в положении 2 меньше чем в положении 1.

Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц(атомы, молекулы), характеризуется термодинамической функцией, свободной энергией.(Свободная энергия F=U-TS, где U внутренняя энергия, T- температура, S- энтропия). Можно сказать, что тем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше (подобно шарику скатывающемуся в положение 2, если на пути нет препятствия.
С уменьшением внешних условий, например температуры, свободная энергия изменяется пор сложному закону, но по-разному для жидкого и твердого состояния системы.
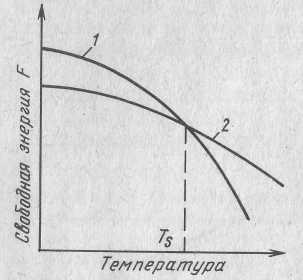
Выше температуры Ts меньшей свободной энергией обладает вещество в жидком состоянии, ниже вещества в твердом состоянии. Следовательно выше Ts вещество будет жидкое а ниже Ts твердое кристаллическое. Ts называют температурой кристаллизации.
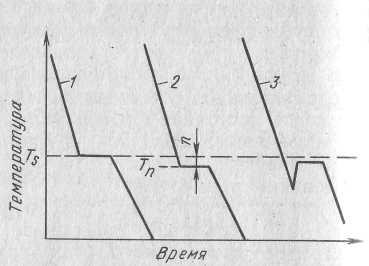
Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры. При достижении Ts на кривой температура-время появляется горизонтальная площадка, т.к. отвод тепла компенсируется выделяемой при кристаллизации скрытой теплотой кристаллизации. По окончании кристаллизации температура вновь начинает плавно снижаться. Однако это теоритическая кривая. Реальная кривая охлаждения изображена рядом. Жидкость непрерывно охлаждается до Tп лежащей ниже теоретической. при охлаждении ниже Ts создаются энергетические условия, необходимые для протекания кристаллизации. Температура Tп называется температурой переохлаждения. Чем больше скорость охлаждения, тем больше величина переохлаждения. Можно так сильно переохладить жидкий металл, что он не будет иметь кристаллической структуры.
что же происходит при температуре соответствующей Ts ?
Ещё Д.К. Чернов в 1878 году указал , что процесс кристаллизации состоит из двух этапов:
1)зарождение мельчайших кристаллов, называемых центрами кристаллизации;
2) рост кристаллов из этих центров.
