
- •Часть I. Элементы кристаллографии лекция №1. Фазовое равновесие.
- •Лекция №2 Основы закономерности строения кристаллов.
- •Лекция №3 Геометрия пространственной решётки
- •Лекция №4 Важнейшие кристаллографические формулы
- •Лекция №5 Симметрия кристаллов. Системы трансляции.
- •3C4, 4c3, 6c2, 9p, 1z.
- •Лекция №6- Основные понятия кристаллохимии.
- •Лекция № 7. Термодинамика фазовых превращений
- •Лекция №8 Механизм процесса кристаллизации
- •Часть II. Теория сплавов. Диаграммы состояния лекция №9 Основные типы взаимодействия в твердом состоянии
- •Лекция №10 Промежуточные фазы в сплавах
- •Лекция №11 Правило фаз
- •Общие замечания по построению диаграммы состояния.
- •Лекция 12 Диаграммы состояния1-го и 2-го родов
- •Лекция №13 Диаграммы состояния 3-го и 4-го родов
- •Лекция №14 Обзор диаграмм состояния двойных систем
- •Лекция №15 Системы с тремя компонентами.
- •Часть III. Элементы фрактального анализа лекция 16 Фрактальный анализ микроструктур
- •Приборостроения и информатики
- •Курс лекций
Лекция №14 Обзор диаграмм состояния двойных систем
Диаграммы состояния для сплавов, испытывающих полиморфные превращения.
Если хотя бы один компонент, составляющий сплав, испытывает полиморфные превращения, в твердом сплаве также будут происходить превращения, что отражается на диаграмме состояния.

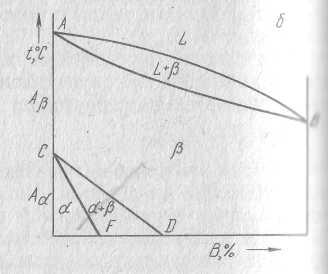
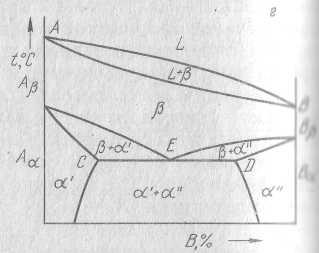
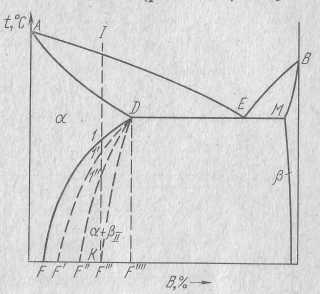
На рисунке справа компонент В имеет одну модификацию, а компонент А – две модификации, причем компонент В изоморфен по отношению к высокотемпературной модификации. На двух рисунках слева оба компонента имеют по две модификации на рисунках сверху, причем Аα и Вα также, как и Аβ и Вβ изоморфны. На нижнем рисунке изоморфны только Аβ и Вβ, Аα и Вα образуют твердые растворы с ограниченной растворимостью.
В начале этого раздела я говорила, что все диаграммы состояния, которые мы изучаем, построены в условиях бесконечно медленного охлаждения. Только в таких условиях можно получить диаграмму, которую можно назвать равновесной (равновесие на практике означает, что каждая точка на диаграмме характеризует состояние сплава, отвечающее минимальному значению свободной энергии F). Однако вы все понимаете, что охлаждать что-либо с бесконечно малой скоростью в действительности невозможно. Реально все наши диаграммы отвечают условиям очень медленного охлаждения, например, вместе с печью. Это означает, конечно, что на самом деле наши диаграммы не совсем равновесные, и реальные линии на диаграммах состояния проходят чуть ниже или чуть выше (в случае нагрева), чем истинные границы фазовых областей.
Что же будет с диаграммой, если скорость охлаждения (или нагрева) велика. Например, если происходит охлаждение жидкого расплава в литейной форме.
Непрерывная кристаллизация жидкого расплава.
В этом случае меняется не только температура превращения, но очень часто и условия превращения, так как не успевают пройти диффузионные процессы, которые необходимы для осуществления превращений по типу равновесных. Давайте вспомним еще раз, как идет равновесная кристаллизация.
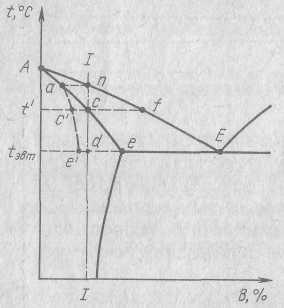
В этом случае состав жидкости непрерывно меняется по линии ликвидус, а кристаллов – по линии солидус. Состав жидкости при этом удаляется от среднего, а кристаллов приближается к среднему (исходному) составу. К моменту окончания процесса все они имеют состав исходного сплава. Очевидно, что и изменение состава жидкости, и изменение состава кристаллов происходит в результате диффузии. А для этого требуется время. В реальных условиях процессы диффузии в твердой фазе запаздывают. У сплава I состав выделяющихся кристаллов должен меняться в соответствии с линией солидус (Аcd), но из-за отставания процессов диффузии он меняется по линии Аc`d`. В результате, когда должна закончиться кристаллизация (температура t1), еще остается какое-то количество жидкости (участок с-с`). Когда мы достигнем эвтектической температуры (а ведь наш сплав без эвтектики), то и тогда может еще остаться жидкость (отрезок е`e``), которое затвердеет и даст эвтектику. Таким образом, реальная структура литого сплава будет сильно отличаться от равновесной, она будет содержать эвтектику, которой в ней быть не должно. Кристаллы твердого же раствора будут неоднородны – в них больше, чем нужно, компонента А, и, кроме того, в первых порциях компонента А больше, чем в последующих. Следует отметить, что вся жидкость может затвердеть еще до того, как будет достигнута температура эвтектики. Тогда в структуре эвтектики не будет, но все равно, состав кристаллов α-твердого раствора будет неоднородным.
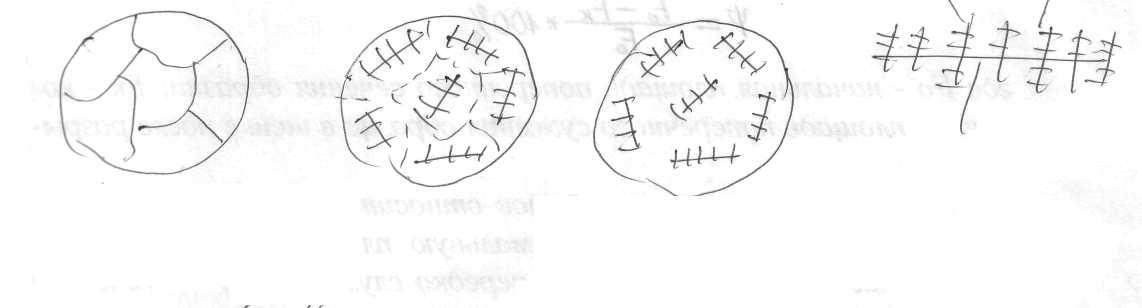
Как правило, границы зерен (кристаллитов) не выявляются на шлифе.
Дендритную ликвацию можно устранить, но для этого нужно создать условия для диффузии. Как правило, для этого используется длительный нагрев. Концентрации компонентов при этом во всех кристаллах выравниваются, после длительного отжига можно снова увидеть структуру равновесного твердого раствора.
Неравновесная кристаллизация из твердого раствора.
Пусть мы очень медленно охлаждаем сплав до точки «0». В результате у нас до температуры, соответствующей точке 0 получаются равновесные структуры. После точки «0» начнем охлаждать быстро (допустим, бросим отливку в воду). В результате, кристаллы β начнут выделяться из твердого раствора α при более низкой температуре, и не в точке 1, как положено по равновесной диаграмме. Чем больше будет скорость охлаждения, тем позже начнут выделяться кристаллы β. Можно добиться такого состояния, когда кристаллы β просто не будут успевать выделяться из твердого раствора α. Этот факт отражен на схеме смещением линии предельной растворимости компонента В вправо. В результате мы опять же получим неравновесную структуру – α-твердый раствор будет содержать больше компонента В, чем положено по диаграмме состояния, т. е. он будет пересыщенным. Такая система будет обладать большим запасом свободной энергии, чем равновесная структура. Это явление широко используется при разработке процессов термической обработки сплавов.
