
- •Часть I. Элементы кристаллографии лекция №1. Фазовое равновесие.
- •Лекция №2 Основы закономерности строения кристаллов.
- •Лекция №3 Геометрия пространственной решётки
- •Лекция №4 Важнейшие кристаллографические формулы
- •Лекция №5 Симметрия кристаллов. Системы трансляции.
- •3C4, 4c3, 6c2, 9p, 1z.
- •Лекция №6- Основные понятия кристаллохимии.
- •Лекция № 7. Термодинамика фазовых превращений
- •Лекция №8 Механизм процесса кристаллизации
- •Часть II. Теория сплавов. Диаграммы состояния лекция №9 Основные типы взаимодействия в твердом состоянии
- •Лекция №10 Промежуточные фазы в сплавах
- •Лекция №11 Правило фаз
- •Общие замечания по построению диаграммы состояния.
- •Лекция 12 Диаграммы состояния1-го и 2-го родов
- •Лекция №13 Диаграммы состояния 3-го и 4-го родов
- •Лекция №14 Обзор диаграмм состояния двойных систем
- •Лекция №15 Системы с тремя компонентами.
- •Часть III. Элементы фрактального анализа лекция 16 Фрактальный анализ микроструктур
- •Приборостроения и информатики
- •Курс лекций
Лекция №13 Диаграммы состояния 3-го и 4-го родов
Диаграмма 3-го рода с эвтектикой
Оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
Компоненты: А, В
Фазы. L, α, β
В сплавах такого рода возможно существование жидкой фазы, твердого
раствора компонента В в А (α- фаза) и твёрдого раствора компонента А в В
(β - фаза). В этих сплавах возможно нонвариантное равновесие, т.е., существование одновременно трёх фаз: L, α и β. В зависимости от того какие реакции протекают в условиях существования трёх фаз, могут быть два вида диаграмм: с эвтектикой и перитектикой.
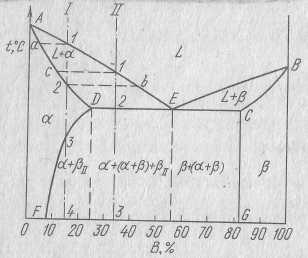
В этой системе не образуются фазы, представляющие собой чистые компоненты. Следовательно, около вертикалей А и В, соответствующих чистым компонентам, находятся области существования твёрдых растворов α и β. Предельная растворимость компонента В в А определяется линией ЕF, а предельная растворимость А в В- линией СG. Сплавы, находящиеся между этими двумя линиями, находятся за пределом растворимости и являются двухфазными, состоящими из α+β. Окончание кристаллизации происходит по эвтектической реакции: L→α+β. Линия АДВ является линией ликвидус,
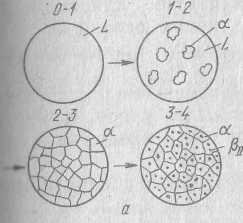
линия АЕСВ- линией солидус. Опираясь на правила фаз и отрезков, проследим за кристаллизацией нескольких сплавов. Начнём со сплава Ι. Очевидно, что кристаллизация этого сплава пойдёт точно так же, как и сплавов, рассмотренных в предыдущем разделе. Структура их после охлаждения будет точно такой же, а именно зёрна твёрдого раствора α. А вот кристаллизация сплава Ι пойдёт по- другому. В точке 1 начнётся процесс выделения из жидкости твёрдого раствора α, концентрация которого будет изменяться по кривой a-2, а состав жидкости по кривой 1-b. В точке 2 кристаллизация закончится, а последние полученные кристаллы будут иметь концентрацию исходного сплава. Эти кристаллы не изменяются до точки 3. В этой точке кристаллы α-твёрдого раствора являются пересыщенными и ниже неё из α-твёрдого раствора будут выделяться кристаллы β-твёрдого раствора.
Состав α-твёрдого раствора будет изменяться по кривой 3-F, вследствие выделения кристаллов β концентрации G. Количество кристаллов β при охлаждении увеличивается. Оно характеризуется длиной отрезка F-4(от линии Ι до линии 3-F).
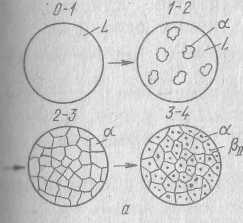

Чтобы подчеркнуть, что данные кристаллы β –э то не те, которые выделяются из жидкости, можно поставить индекс ˝ΙΙ˝. Вид кривой охлаждения для этого сплава и структуры сплава на разных этапах кристаллизации представлены на рисунке ( см.выше). Кристаллы βΙΙ-выделившиеся из твёрдой фазы под вторичными ( в отличие от первичных βΙ). Процесс выделения вторичных кристаллов над вторичной кристаллизацией. Давайте теперь посмотрим на любой сплав, лежащий в области ВСG. Линия СG, в отличие от линии ЕF вертикальна, поэтому растворимость компонента А в В не зависит от температуры, и вторичной кристаллизации в этих сплавах не будет.
Р.S. Точка Е показывает максимальную растворимость компонента В в компоненте А при наиболее благоприятной температуре.
Рассмотрим теперь кристаллизацию сплава ΙΙ. Начинается она так же, как и у сплава Ι, но из жидкости выделяются кристаллы α. Однако, в отличие от сплава Ι, при достижении температуры, которая соответствует горизонтали ЕДС, происходит эвтектическая реакция. При этой температуре в равновесии находятся три фазы - жидкость состава D, α-кристаллы состава Е и β-кристаллы состава С. Реакцию происходящую при этой температуре, можно записать так: LD→αЕ + βС (индекс подчёркивает состав жидкости и кристаллов).
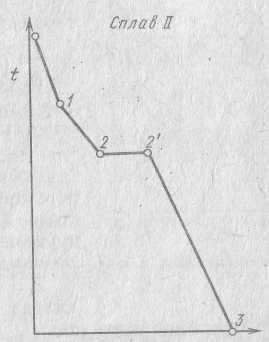
Внимание:
под микроскопом можно увидеть только вторичные кристаллы βΙΙ, выделившиеся из кристаллов α при кристаллизации из жидкой фазы. Из кристаллов α, образовавшихся в результате эвтектической реакции они тоже выделяются, но различить их в составе эвтектики невозможно;
так как кристаллы βΙΙ выделяются из эвтектических кристаллов α на всём интервале температур от эвтектической до комнатной, температура меняется плавно и перегиба на кривой охлаждения после горизонтальной площадки не будет;
несмотря на многообразие структурных составляющих(первичные кристаллы α, эвтектика (α+β), вторичные кристаллы βΙΙ), охлаждённый сплав содержит всего только две фазы: кристаллы α и кристаллы β. Поэтому, если применить правило фаз ниже линии ЕДС, можно определить количество α-и β-кристаллов.
Диаграмма 3-го рода с перитектикой
При эвтектическом превращении жидкость кристаллизуется с образованием двух твёрдых фаз. Однако, возможен и другой тип нонвариантного превращения, когда жидкость реагирует с ранее выпавшими кристаллами и образуется новый вид кристаллов по реакции: α+β→α.
Реакции подобного типа называются перитектическими.

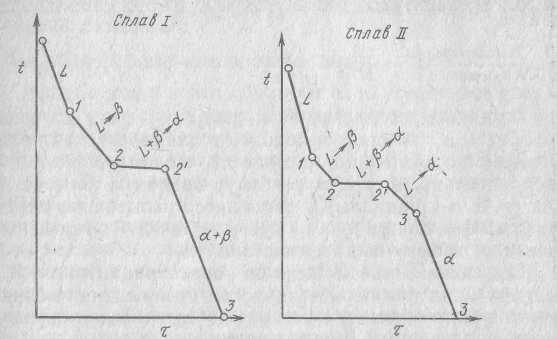
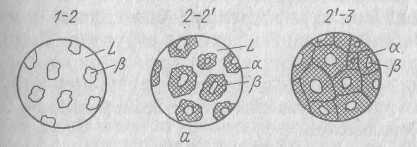
Диаграмма с перитектическим превращением показана на рисунке. На диаграмме имеются три однородные области: жидкость (L) и ограниченные твёрдые растворы α и β.
Линия АСВ является линией ликвидуса, линия APDB- линией солидуса.
Кристаллизация сплава Ι начинается в точке 1, когда из жидкости выпадают кристаллы β-раствора состава т “b”.
Затем, по мере снижения температуры? жидкость меняет свою концентрацию по линии ликвидус от точки 1 до точки С, а кристаллы β- по линии солидус от точки b до точки D. По достижении перитектической горизонтали СРД состав жидкости будет отвечать точке С, а состав кристаллов- точке Д. Эти две фазы реагируют и дают третью фазу α, концентрация которой определяется точкой Р-третьей точкой на горизонтали. Перитектическая реакция изображается следующим образом: LС+βD→αP , т.к, точки D и Р показывают предельную концентрацию твёрдых растворов β и α (для простоты линии предельной растворимости даны вертикальными). Количественное соотношение фаз при перитектической реакции, необходимое для образования α-фазы, определяем по правилу отрезков соотношением:
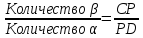
В нашем сплаве количество участвующих в перитектической реакции кристаллов β и жидкости определяются соотношением:
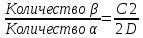
то есть в данном сплаве имеется переизбыток β- фазы.
Поэтому в структуре будут продукты перитектической реакции (α) и оставшиеся кристаллы β-фазы. Чем ближе т.2 лежит к точке Р, тем меньше будет избыточных кристаллов β. Для сплава состава т. Р в структуре будут только кристаллы α-фазы. На рисунке показана кривая охлаждения сплава Ι и отдельные моменты кристаллизации сплава. Для сплава Ι перитектической реакцией заканчивается процесс кристаллизации.
Кристаллизация сплава ΙΙ- в отличие от сплава Ι состоит в том, что при перитектической температуре имеется избыток жидкой фазы. Поэтому, после окончания перитектического превращения оставшаяся жидкость кристаллизуется в интервале между точками 2-3 в α-фазу. При этом концентрация жидкости меняется по кривой состава, и концентрации образующихся α-кристаллов по кривой Р-3 (см.рисунок).
Диаграммы состояния для сплавов, образующих химические соединения
Химические соединения, как известно, характеризуются определённым соотношением компонентов, что отражается на диаграмме вертикальной линией. Если компоненты А и В образует химическое соединение АnBm, то
на (n+m) его атомов приходится n атомов А и m атомов В. Определённому атомному соотношению соответствует и определённое соотношение по массе. Химическое соединение иногда можно нагреть без разложения до расплавления, иногда же при нагреве оно разлагается. В связи с эти может быть два вида диаграмм. Кроме того, возможно образование нескольких химических соединений между двумя компонентами. Это тоже отражается на диаграмме состояния.
Вертикальная линия, соответствующая химическому соединению, пересекает ось концентраций в точке, соответствующей соотношению компонентов в химическом соединении.
Диаграмма 4-го рода с устойчивым химическим соединением.
Предположим, что оба компонента образуют одно устойчивое соединение АnВm, причём и это соединение, и чистые компоненты не образуют в твёрдом состоянии растворов.
Компонентами системы являются вещества А и В, а твёрдыми фазами А, АnВm и В. Из четырёх возможных в той системе фаз могут сосуществовать три: L, А, АnВm или L, В, АnВm. Химическое соединение плавится при постоянной температуре, что вполне соответствует правилу фаз. Химическое соединение можно рассматривать как однокомпонентную систему, тогда с=к+1-f=1+1-2=0. Его же можно рассматривать как двухкомпонентную систему (А и В компоненты), тогда, так как изменение концентрации у химического соединения невозможно, единица в уравнении правила фаз будет занята под концентрацию и с=к-f+0=2-2+0=0 (фазами являются химическое соединение и жидкость)
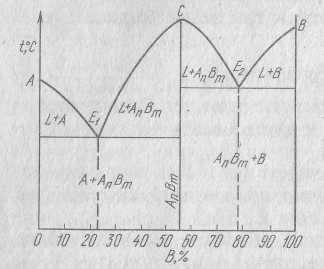
На линияхЕ1-C и Е2-C выделяются первичные кристаллы химического соединения. Следовательно, заэвтектические сплавы в отношении эвтектики Е1 и доэвтектические в отношении эвтектики Е2 в твёрдом состоянии состоят из первичных кристаллов АnВm и эвтектик Е1 и Е2.
Кристаллизация сплавов на этой диаграмме происходит совершенно аналогично кристаллизации сплавов, образующих механическую смесь кристаллов чистых компонентов. Отличие состоит только в том, что кроме выделения чистых кристаллов компонентов А и В, происходит еще образование кристаллов химического соединения. Таким образом, диаграмма с химическим соединением представляет собой как бы приставленные одна к другой две простые диаграммы. Можно разделить такую диаграмму на две части по вертикали, соответствующей химическому соединению, и изучать каждую часть диаграммы отдельно.
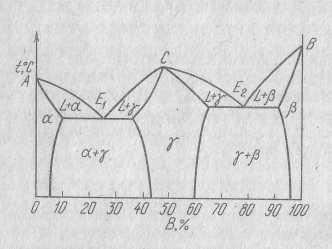
Если же компоненты в твердом состоянии образуют твердые растворы, а также растворы на базе химического соединения, то на диаграмме состояния мы видим сдвоенную диаграмму сплавов – смесей из твердых растворов. На рисунке γ-твердый раствор на базе химического соединения АnBm.
Диаграмма 4-го рода с неустойчивым химическим соединением.
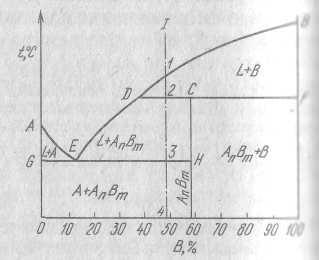
В этом случае соединение АnBm при нагреве до температуры, соответствующей линии DF разлагается на жидкость и один из компонентов, т. е. не расплавляется полностью. На линии DCF находятся в равновесии три фазы: жидкость концентрации D, кристаллы компонента В и кристаллы химического соединения. При нагреве соединение АnBm распадается на жидкость концентрации D и компонент В, при охлаждении происходит обратная реакция:
LD + B → АnBm
Реакция подобна перитектической, но в результате образуется не новый твердый раствор, а химическое соединение. Процесс кристаллизации сплава I пойдет следующим образом: в точке 1 начнется кристаллизация, выпадут кристаллы компонента В, и концентрация жидкости изменится до точки D (по кривой 1 – D). В точке 2 при постоянной температуре образуется химическое соединение АnBm. По окончании реакции в избытке остается жидкость, которая кристаллизуется с выделением АnBm до тех пор, пока состав жидкости не будет соответствовать точке Е. Тогда оставшаяся жидкость кристаллизуется в эвтектику. Следовательно, на кривой охлаждения будет две площадки: нижняя, соответствующая кристаллизации эвтектики и верхняя, соответствующая образованию химического соединения.
