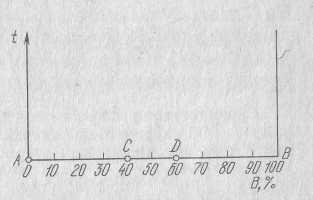- •Часть I. Элементы кристаллографии лекция №1. Фазовое равновесие.
- •Лекция №2 Основы закономерности строения кристаллов.
- •Лекция №3 Геометрия пространственной решётки
- •Лекция №4 Важнейшие кристаллографические формулы
- •Лекция №5 Симметрия кристаллов. Системы трансляции.
- •3C4, 4c3, 6c2, 9p, 1z.
- •Лекция №6- Основные понятия кристаллохимии.
- •Лекция № 7. Термодинамика фазовых превращений
- •Лекция №8 Механизм процесса кристаллизации
- •Часть II. Теория сплавов. Диаграммы состояния лекция №9 Основные типы взаимодействия в твердом состоянии
- •Лекция №10 Промежуточные фазы в сплавах
- •Лекция №11 Правило фаз
- •Общие замечания по построению диаграммы состояния.
- •Лекция 12 Диаграммы состояния1-го и 2-го родов
- •Лекция №13 Диаграммы состояния 3-го и 4-го родов
- •Лекция №14 Обзор диаграмм состояния двойных систем
- •Лекция №15 Системы с тремя компонентами.
- •Часть III. Элементы фрактального анализа лекция 16 Фрактальный анализ микроструктур
- •Приборостроения и информатики
- •Курс лекций
Общие замечания по построению диаграммы состояния.
Итак, диаграмма состояния показывает состояние системы (в нашем случае сплава) при различных температурах.
|
|
|
Если система однокомпонентная, то диаграмма состояния будет иметь одно измерение (шкалу температур) и соответствующие точки на ней, показывающие температуры фазовых переходов (рисунок слева). Если в системе два компонента, то второе измерения покажет концентрацию сплава (рисунок справа). Принято температуру откладывать на оси ординат, а концентрацию – на оси абсцисс. Следует учесть, что общая концентрация обоих компонентов равна 100%.
При этом удобно раздваивать температурную ось, помещая ее в начале и конце шкалы концентраций:
Если буквами А и В обозначить наши компоненты, то на моем рисунке в точке “0” будет 0% компонента В, а в точке “100” будет 100% компонента B.
Что касается компонента А, то его будет 0% в точке “100” и 100% в точке “0”. Промежуточные точки, например точка “D”, соответствует сплаву, который на 70% состоит из компонента В и на 30% из компонента А. Следовательно, крайние ординаты на диаграмме соответствует чистым компонентам, а ординаты между ними – сплавам.
Диаграммы состояния сплавов с тремя компонентами имеет пространственный вид (две оси концентрации, одна температурная). Системы с большим числом компонентов изображают упрощенно, т.к. они имеют больше трех независимых переменных.
Итак, каждая точка на диаграмме показывает состояния сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры данного сплава. Изменение фазового состояния сплава отмечается на этой вертикале точками (или точкой). Линии, соединяющие точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний. Поэтому вид диаграммы состояний от того, как реагируют друг с другом компоненты в жидком и твердом состоянии: образуют они твердые растворы, химические соединения или не взаимодействуют друг с другом.
Методы построения диаграмм состояния различны: их строят как теоретическим, путем так и экспериментальным.
Для теоретических расчетов может быть использована зависимость свободной энергии от температуры. Однако такие зависимости есть не всегда. Кроме того, нужно учитывать также зависимость свободной энергии от концентрации. Поэтому, чаще для построения диаграмм состояния используется какой-либо экспериментальный метод, например, метод термического анализа.
Лекция 12 Диаграммы состояния1-го и 2-го родов
Диаграммы стояния для сплавов, образующих механические смеси из чистых компонентов (1 рода ).
Компоненты: вещества А и В (k =2)
Фазы:
жидкость L,
кристаллы
А и кристаллы В
(максимальное значение f
=3).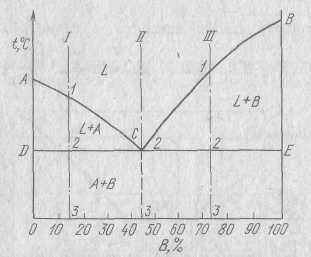
Общий вид диаграммы представлен на рисунке. Линяя АСВ отделяет однородную область от областей АСD и ВСЕ, где в равновесии находятся и жидкая и твердя фазы. Эта линия называется линией ликвидуса (ligeud). Эта линяя соответствует температурам при которых начинается кристаллизация. Линяя DCE называется линией солидус (solid – твердый) и означает конец кристаллизации. На линии АС при охлаждении начинают выделяться кристаллы А, а на линии СВ – кристаллы В. В точка С одновременно выделяются кристаллы А и В. Возьмем какой- либо сплав, например обозначенный цифрой 1. Построим для этого сплава кривую охлаждения.
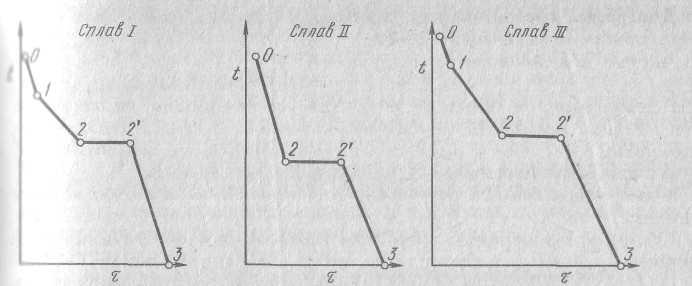
На
этой кривой участок 0–1 соответствует
охлаждению жидкого сплава, участок 1-2
выделению кристаллов компонента А,
участок 2-2’ – совместному выделению
кристаллов А и В, а участок 2’-3 –
охлаждению твердого тела. Что же
представляет собой структура сплава
на всех этапах кристаллизации?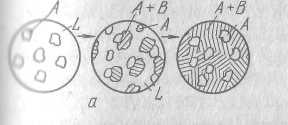
Эти структуры изображены на рисунке. Правый рисунок представляет собой структуру уже закристаллизовавшегося сплава. Видны первичные выделения кристаллов А и механическая смесь кристаллов А+В, которые ристаллизовались одновременно.
Механическая смесь двух (или более) видов кристаллов, одновременно кристаллизовавшихся из жидкости, называется эвтектикой.
Кривая охлаждения сплава 2, имеющего, как говорят, эвтектическую концентрацию, отличается от кривой сплава 1, на ней отсутствует участок
1-2. Это особенность присуща всем сплавам эвтектического состава. Структура такого сплава после затвердевания будет состоять только из смеси кристаллов А+В. Структурно свободных кристаллов А или В в этом сплаве не будет ни при каких температурах.
Кривая охлаждения сплава 3 похожа на кривую 1. Отличие состоит в том, что температура, соответствующая точке 1 выше, чем у первого сплава. Структура этого сплава состоит из кристаллов компонента В, которые выделяются на участке 1-2, и эвтектики, которая кристаллизуется на участке 2-2’. Далее на участке 2’-3 затвердевший материал остывает.
На диаграммах состояния обычно указывают области существования различных фаз. Ниже линии DCE находятся две -фазы кристаллы А и В. А если говорить не о фазовом а о структурном составе? Структурное состояние всех эвтектических сплавов (левее сплава 2) можно обозначить как А+(А=В), а эвтектического как В+(А+В), хотя и в том и в другом случае в сплавах две формы: А и В.
Правило отрезков.
В
процессе кристаллизации изменяются
концентрации фаз (например, изменяется
состав жидкости при выпадении из нее
кристаллов компонента А или В). В любой
точке диаграммы состояния, когда в
сплаве одновременно существуют две
фазы, можно определить количество обоих
фаз и их концентрацию. Для этого служит
так называемое правило
рычага, или
правило
отрезков.
Рассмотрим ту же самую диаграмму
состояния, которую мы уже знаем.Возьмем
сплав произвольного состава. Пусть это
будет сплав К при температуре t1(также
произвольной). Фазовый состав этого
сплава при температуре t1
показывает точка а, химический точка r
на оси концентрации 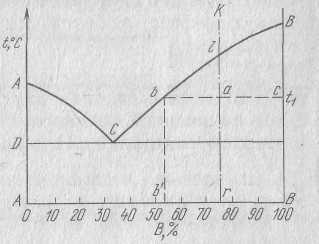
(этот сплав состоит на 75% из компонента В и на 25% из компонента А). А вот с фазовым составом надо определиться, этот состав дает нам горизонтальная линяя, проведенная через всю область СВЕ при температуре t1. эта линяя показывает что при температуре t1 сплав будет состоять из кристаллов компонента В (ее конец упирается в вертикаль В-В, которая. Соответствует чистому компоненту В) и жидкости, состав которой определяется проекцией точки в на ось концентраций. Обозначим эту проекцию через в’ . Что же мы видим? Мы видим, что состав жидкости уменьшается, те при температуре t1 он отличается от того, который определяет точка r. Почему же так получается? А потому, что из сплава уже вышло некоторое количество кристаллов компонента В. На моем рисунке жидкость примерно на 60% состоит из компонента В, и на 40% -из компонента А. Если взять более низкую температуру, то мы увидим, что в жидкости будет еще меньше компонента В, так будет продолжаться до тех пор, пока мы не опустимся до температуры кристаллизации эвтектики (DCE). При этой температуре мы получим жидкость, отвечающую по составу точке С’( у меня это примерно 45% компонента В и 55% компонента А). При этой температуре, как мы с вами знаем, мы тоже можем иметь в равновесии жидкость и кристаллы твердой фазы (компонент В) но жидкость должна обязательно иметь эвтектический состав. Итак, концентрация жидкости определяется линией ВС. Исходя из сказанного, можно сформулировать первое положение правила отрезков:
Чтобы определить концентрацию компонентов в фазах, через точку характеризующую состав сплава при данной температуре, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область; проекции точек пересечения на ось концентраций показывает соответствующую фазу.
Количество этих фаз также можно определить, для этого служит второе положение правила отрезков. Я не буду выводить его - вывод достаточно прост и есть в любом учебнике. Мы же заметим следующее : если точка а определяет состояние сплава, точка в состав жидкой фазы, а точка с состав твердой фазы, то отрезок ав определяет все количество сплава, отрезок ас – количество жидкости и отрезок вс – количество кристаллов. Если все количество сплава принять за единицу, то масса кристаллов в точке а равна отношению ав/вс, а количество жидкости равно……….
Отношение количеств твердой и жидкой фаз определяется отношением………………

Сформулируем теперь второе положение правила отрезков:
Для того чтобы определить количественное соотношение фаз, через данную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими состав фаз, обратно пропорциональны количеству этих фаз.
Правило отрезков применимо только в двух фазных областях.
Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (2род).
Оба компонента неограниченно растворимы в жидком и твердом состояниях, и не образуют химических соединений.
Компоненты: А и В.
Фазы: жидкость (L), твердый раствор (α).
Если два компонента неограниченно растворимы в жидком и твердом состоянии, возможно существования только двух фаз – жидкого раствора L и твердого раствора α. Так как трех фаз быть не может, кристаллизации при постоянной температуре тоже не будет, то есть горизонтальных линий не будет также.
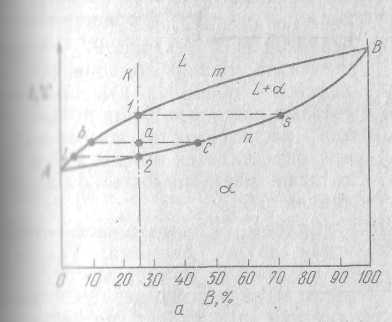
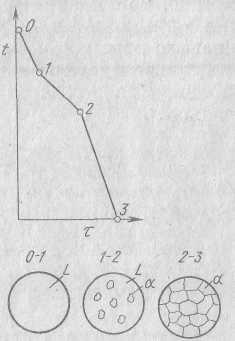
Так, в точке а сплав К состоит из жидкой и твердой фазы. Состав жидкой фазы определяется проекцией точки в’, лежащей на линии ликвидус, а состав твердой фазы – проекцией точки с, лежащей на линии солидус. Количество жидкой и твердой фаз определяются из следующих соотношений: количество жидкой фазы ас/вс, количество твердой фазы ва/вс. Обратим внимание на то, что во всем интервале кристаллизации (от 1 до2) из жидкого сплава, имеющего исходную концентрацию К, выделяются кристаллы, в которых тугоплавкого компонента больше, чем в исходном сплаве. Состав первых кристаллов определяется точкой s. Заканчивается кристаллизация в точке 2, когда последняя капля жидкости имеющая состав в затвердеет.
Отрезок, показывающий количество твердой фазы, равнялся нулю в точке 1, когда только началась кристаллизация, и равняется количеству всего сплава в точке 2, когда кристаллизация закончилась. Состав жидкости изменяется по кривой 1-e, а состав кристаллов по кривой s-2, и в момент окончания кристаллизации состав кристаллов такой же, как и состав исходной жидкости.