
- •Методические указания
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 2. Биогенные s- и p- элементы, биологическая роль, применение в медицине.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 3. Биогенные d- элементы; биологическая роль, применение в медицине
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 4. Растворы. Электрофотоколориметрический метод определения концентрации растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 5. Растворы. Перманганатометрия как метод объемного количественного анализа. Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 6. Комплексообразование в биологических системах.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 7. Коллигативные свойства растворов. Теоретические вопросы.
- •Информационный блок
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 8. Осмос и осмотическое давление.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 9. Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей.
- •Значение pH различных биологических жидкостей и тканей тела человека
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 10. Буферные системы, классификация и механизм действия.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Набор заданий для контроля самоподготовки
- •Тема 11. Тепловые эффекты химических реакций. Химическая термодинамика.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 12. Кинетика биохимических реакций. Химическое равновесие.
- •Теоретические вопросы
- •Набор заданий для контроля самоподготовки
- •Тема 13. Сорбция биологически-активных веществ на границе раздела фаз.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 14. Дисперсные системы. Получение, очистка и свойства коллоидных растворов.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Тема 15. Лиофобные золи и их свойства. Коагуляция. Коллоидная защита.
- •Теоретические вопросы.
- •Решение обучающих задач.
- •Мицеллярная формула
- •Набор заданий для контроля самоподготовки
- •Тема 16. Свойства растворов биополимеров. Изоэлектрическая точка белка.
- •Теоретические вопросы.
- •Набор заданий для контроля самоподготовки
- •Лабораторный практикум s- и р-элементы.
- •Комплексные соединения.
- •Определение концентрации растворов.
- •Химическая термодинамика.
- •Коллоидные растворы
- •Свойства растворов вмс.
- •Список основной литературы
- •Дополнительная литература.
Набор заданий для контроля самоподготовки
Задание 1.
Определите, к какому классу координационных соединений относятся следующие вещества. Укажите заряд координационной сферы.
[Al(H2O)6]Cl3 , K4[Fe(CN)6] , [Co(NH3)6]Cl3 .
Задание 2.
Определите степень окисления центрального атома и координационное число в комплексных соединениях:
[Co(NH3)5Cl](OH)2 , [Cr(H2O)4Сl2]
Задание 3.
Назовите координационное соединение: [Cr(H2O)6]Cl . Укажите:
1. Внутреннюю и внешнюю сферу комплекса, их заряд
2. Комплексный ион
3. Центральный атом и его степень окисления
4. Лиганды, их заряд и дентатность
Тема 7. Коллигативные свойства растворов. Теоретические вопросы.
Растворы. Роль растворов в жизнедеятельности организма.
Растворимость газов в жидкостях. Закон Генри. Газовая эмболия.
Коллигативные свойства растворов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
Гемолиз и плазмолиз. Гипо-, гипер-, и изотонические растворы и их применение в медицине.
Закон Рауля. Эбулиоскопия и криоскопия.
Коллигативные свойства растворов электролитов. Изотонический коэффициент.
Биологическое значение коллигативных свойств растворов.
Информационный блок
Значения криоскопических и эбуллиоскопических постоянных некоторых растворителей:
|
|
KКР, кг∙К∙моль-1 |
КЭ, кг∙К∙моль-1 |
|
Вода |
1,86 |
0,51 |
|
Бензол |
5,1 |
2,57 |
|
Этиловый спирт |
1,99 |
1,16 |
|
Диэтиловый эфир |
1,73 |
2,02 |
Решение обучающих задач.
Задача 1.
Рассчитать температуру кипения раствора, который содержит 12 г мочевины в 500 мл Н2О
(КЭ воды = 0,52).
Эталон решения:
Для определения повышения температуры кипения раствора неэлектролита используем уравнение (второй закон Рауля):

где Сm – моляльная концентрация, моль/кг;
KЭ, – эбуллиоскопическая константа воды
Определяем моляльную концентрацию раствора мочевины:

Рассчитываем повышение температуры кипения:

4. Определяем температуру кипения раствора:
Ткип (раствор) = Ткип (Н2О) + Ткип
Ткип (раствор) = 100 + 0,2 = 100,2ºС
Задача 2.
Рассчитайте осмотическое давление раствора глюкозы с массовой долей 1 % при температуре 37°С (плотность раствора 1,05 г/мл). Является ли этот раствор изотоническим по отношению к крови?
Эталон решения:
1. Закон Вант-Гоффа для разбавленных растворов неэлектролитов может быть записан в виде:

С – молярная концентрация, моль/л;
R – универсальная газовая постоянная, R = 8,31 кПа∙л∙моль-1∙К-1;
Т – абсолютная температура, К., Т = tºС + 273
2. Определяем молярную концентрацию раствора глюкозы по формуле:
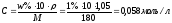
3. Определяем осмотическое давление раствора:

4. Осмотическое давление раствора меньше осмотического давления плазмы крови. Раствор является гипотоническим.
Задача 3.
Изотонический раствор хлорида натрия используются в качестве кровезаменителей и растворов для внутривенных инъекций. В 500 мл такого раствора содержится 4,45 г хлорида натрия. Определить молярную концентрацию раствора. Какое осмотическое давление он создаёт?
Эталон решения:
1. Определяем молярную концентрацию раствора:

2. Определяем изотонический коэффициент хлорида натрия:
NаСl
↔ Na+
+ Cl-

3. Рассчитываем осмотическое давление раствора:
 ,
,

3. Раствор является изотоническим
