
Лекция 1.Мед.химия
.pdfЛекция: «БИОГЕННЫЕ ЭЛЕМЕНТЫ»
Ассистент Бойцова В.Е.
ПЛАН ЛЕКЦИИ:
1.Содержание химических элементов в земной коре.
2.Биогенные элементы. Элементы-органогены.
3.Классификация биогенных элементов.
4.Общая характеристика s-элементов.
5.Общая характеристика p-элементов.
6.Общая характеристика d-элементов.
7.«Металлы жизни». Их влияние на функцию ферментов и гормонов.
8.Взаимозаменяемость биогенных элементов. «Синергизм» и «антагонизм».
9.Заболевания, связанные с нарушением химического гомеостаза.
10.Экологические проблемы и их влияние на организм.
11.Качественные реакции на биогенные элементы и методика их выполнения.
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы, вместе с алюминием, железом, кальцием, натрием, калием, магнием, водородом и титаном, составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 % (рис.1). В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химические составы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
1
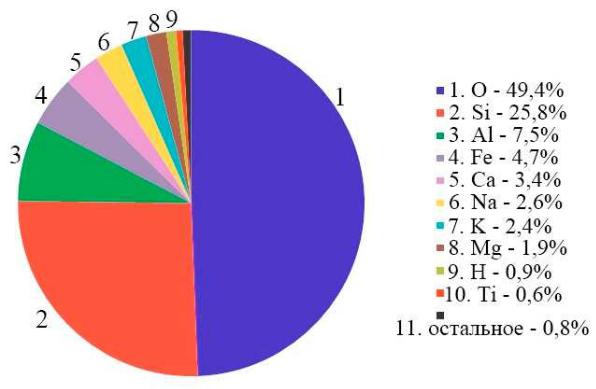
Рис.1. Распространённость химических элементов в земной коре
Оболочка Земли, в границах которой живут организмы, называется биосферой. Важнейшие исследования биосферы осуществил первый президент академии наук Украины В.И.Вернадский (1863-1945). Изучая геохимические превращения в земной коре, В.И.Вернадский установил, что изменения, происходящие в ее верхних слоях, определенным образом влияют на химический состав живых организмов. Исследования химического состава земной коры, почвы, морской воды, растений, животных, человека показали, что в живых организмах, в том числе и в человеческом, содержатся почти все элементы, которые есть в земной коре и морской воде. В.И.Вернадский считал, что живые организмы и земная кора составляют одну систему. Дальнейшее изучение биогеохимия получила в трудах академика А. П. Виноградова.
В процессе эволюции от неорганических веществ к биоорганическим основой использования тех или иных химических элементов при создании биосистем является естественный отбор. В результате такого отбора основу всех живых систем составляют только шесть элементов: углерод, водород,
кислород, азот, фосфор, сера, получивших название органогенов. Их содержание в организме достигает 97,4%.
С точки зрения химии естественный отбор элементов-органогенов можно объяснить их способностью образовывать химические связи: с одной стороны, достаточно прочные, то есть, энергоемкие, а с другой, достаточно лабильные, которые легко могли бы поддаваться гемолизу, гетеролизу, циклическому перераспределению.
Органогеном номер один, несомненно, является углерод. Его атомы образуют прочные ковалентные связи между собой или с атомами других элементов. Эти связи могут быть ординарными или кратными, благодаря таким
2
связям углерод способен образовывать сопряженные или кумулированные системы в виде открытых или закрытых цепей, циклов. В отличие от углерода, элементы-органогены водород и кислород лабильные связи не образуют, но их наличие в органической, в том числе, в биоорганической молекуле определяет ее способность взаимодействовать с биорастворителем-водой. Кроме того, водород и кислород являются носителями окислительно-восстановительных свойств живых систем, они обеспечивают единство окислительновосстановительных процессов. Остальные три органогена - азот, фосфор и сера, а также некоторые другие элементы – железо, магний, составляющие активные центры ферментов, как и углерод, способны образовывать лабильные связи. Положительным свойством органогенов является также и то, что они, как правило, образуют легко растворимые в воде соединения и поэтому концентрируются в организме.
Существует несколько классификаций химических элементов, содержащихся в организме человека. Так, В.И.Вернадский в зависимости от среднего содержания в живых организмах разделил элементы на три группы:
1.Макроэлементы. Это элементы, содержание которых в организме выше 10 -² % . К ним относятся углерод, водород, кислород, азот, фосфор, сера, кальций, магний, натрий и хлор.
2.Микроэлементы. Это элементы, содержание которых в организме находится в пределах от 10-² до 10¯¹² %.К ним относятся йод, медь, мышьяк, фтор, бром, стронций, барий, кобальт.
3.Ультрамикроэлементы. Это элементы, содержание которых в организме ниже 10-¹²%. К ним относятся ртуть, золото, уран, радий и др.
В.В.Ковальский, исходя из степени значимости химических элементов для жизнедеятельности человека, подразделил их на три группы:
Незаменимые элементы. Они постоянно находятся в организме человека, входят в состав его неорганических и органических соединений. Это
H, O, Ca, N, K, P, Na, S, Mg, Cl, C, I, Mn, Cu, Co, Zn, Fe, Mo, V. Дефицит содержания этих элементов приводит к нарушению нормальной жизнедеятельности организма.
Примесные элементы. Эти элементы постоянно находятся в организме человека, но их биологическая роль еще не всегда выяснена или мало изучена.
Это Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, As, Ba, Ge, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, Ce, Se.
Микропримесные элементы. Они найдены в организме человека, но ни о количественном содержании, ни о биологической роли их нет. Это Sc, Tl, In,
La, Sm, Pr, W, Re, Tb и др. |
|
Химические элементы, необходимые для |
построения и |
жизнедеятельности клеток и организмов, называют биогенными.
Физиологическая роль биоэлементов определяется их физикохимическими свойствами, которые, в свою очередь, обусловлены положением элемента в периодической системе Д.И.Менделеева.
3
Элементы в периодической таблице делятся на s-, p и d-элементы. К блоку s-элементов относятся 13 элементов, находящихся в I и II группах главных подгруппах. Электронные структуры у этих элементов заполнены таким образом, что валентные электроны ( один или два) расположены нам внешнем s-подуровне, а предпоследний энергетический слой состоит из устойчивой восьми электронной оболочки ( исключение составляют водород и гелий, у которых всего один электронный слой). s-Элементы , содержащие один валентный электрон относятся к группе IА, а s-элементы, которые имеют два валентных электрона, составляют IIА группу. Степень окисления этих элементов равна номеру группы. Из-за сходного строения электронной оболочки, s-элементы каждой группы обладают сходными свойствами.
Для характеристики свойств элементов пользуются такими физическими единицами, как атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность. При увеличении радиуса в группах сверху вниз связь валентного электрона с ядром ослабевает и уменьшается энергия ионизации. Атомы щелочных и щелочно-земельных элементов легко отдают свой валентный электрон, что характеризует их как сильные восстановители. Значение величин электроотрицательностей определяет форму существования элемента в живых системах. Так, s-элементы I группы характеризуются соответственно очень низкими значениями электроотрицательности, поэтому в живых организмах они находятся в виде катионов. Так, ион Na+- основной
+ +
катион внеклеточных жидкостей, а ионы K и Mg ² -внутриклеточные катионы. Кальций и магний содержатся в костной и зубной тканях в виде катионов малорастворимых солей. Общая характеристика s-элементов представлена в таблице 1.
|
|
|
|
|
|
|
|
Таблица 1. |
|
|
|
|
Общая характеристика s-элементов |
|
|
|
|||
Группа |
Элемент |
Радиус атома, нм |
Радиус иона, нм |
Энергия ионизации |
Электроотрицатель ность |
Восстановит |
ельные свойства |
|
Химич. активность |
IА |
От Li до |
155 |
70 |
520 |
1,0 |
Увеличивают |
|
Увеличив |
|
|
Fr |
↓ |
↓ |
↑ |
↑ |
ся |
↓ |
|
аются ↓ |
|
|
280 |
180 |
386 |
0,7 |
|
|
|
|
IIА |
От Be до |
100 |
30 |
900 |
1,5 |
Увеличивают |
|
Увеличив |
|
|
Ra |
↓ |
↓ |
↑ |
↑ |
ся |
↓ |
|
аются |
|
|
240 |
144 |
510 |
0,9 |
|
|
|
↓ |
|
Н |
5 |
10-3 |
1310 |
2,1 |
|
|
|
|
|
Не |
122 |
― |
2370 |
― |
|
― |
|
― |
К р-элементам относятся 30 элементов III-VIIА – групп периодической системы. р-Элементы расположены во втором и третьем малых периодах, а также в четвертом – шестом больших периодах. Элементы IIIАгруппы имеют
4
один электрон на р-орбитали. В IVА- VIIА-группах наблюдается заполнение р- подуровня до 6 электронов. В периодах при увеличении заряда ядра атомные и ионные радиусы р-элементов уменьшаются, энергия ионизации и сродство к электрону возрастает, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах с возрастанием порядкового номера элемента радиусы атомов и однотипных ионов¸ как правило, увеличиваются, неметаллические свойства ослабевают, а металлические - усиливаются.
На свойства р-элементов и их соединений влияют как появление новых подуровней на внешнем электронном уровне, так и заполнение подуровней внутренних электронных слоев. Свойства р-элементов второго периода - В, С, N, О, F― резко отличаются от свойств элементов других периодов. Так, начиная от р-элементов третьего периода, появляется свободный d-подуровень, на который могут переходить электроны с s- и р-подуровней при возбуждении атомов. р-Элементы II периода – азот, кислород и фтор –
Проявляют ярко выраженную способность участвовать в образовании водородных связей. Элементы третьего и следующих периодов это свойство теряют.
К d-элементам относятся 32 элемента периодической системы IVVII больших периодов. В III В - группе у атомов появляется первый электрон на d- орбитали, в последующих В-группах d-подуровень заполняется до 10 электронов.
В периодах с возрастанием заряда ядра увеличение радиуса атомов происходит довольно медленно, непропорционально числу электронов, заполняющих оболочку атомом. Такое «непропорциональное» изменение радиусов объясняется лантаноидным сжатием, а также проникновением nsэлектронов на d-электронный слой (действует принцип наименьшей энергии). Атомные радиусы переходных элементов значительно меньше радиусов s- и р- металлов того же периода. Особенности химических свойств d-элементов позволяют рассматривать их как единую группу. К этим особенностям относятся следующие:
1. Все d-элементы отличаются от s-элементов меньшей восстановительной способностью и большей химической инертностью.
2.Для большинства d-элементов характерно проявление двух и больше степеней окисления, почти одинаковых по термодинамической стойкости в обычных условиях, т.е. характерно большое разнообразие окислительновосстановительных реакций.
3.Соединения многих d-элементов в высших степенях окисления проявляют кислотные, а в низших - слабоосновные свойства.
4.Наиболее характерной особенностью d-металлов является способность образовывать разнообразные комплексные соединения, многие из которых устойчивы в водных растворах.
С увеличением порядкового номера элемента устойчивость его высшей степени окисления в периоде уменьшается, а в группе возрастает. Снижение устойчивости высшей степени окисления в периоде обусловлено эффектом d-
5
сжатия.
Впобочных подгруппах сверху вниз уменьшаются металлические и восстановительные свойства элементов. В растворах d-элементы в высшей степени окисления представлены анионами, обычно кислородсодержащими. При этом соединения в высшей степени окисления проявляют кислотные и окислительные свойства. d-Элементы, имеющие невысокие значения электроотрицательности, склонны существовать в биосистемах в виде катионов
ипроявляют основные свойства. Амфотерные свойства характерны для соединений в промежуточных степенях окисления.
d-Элементы относятся к микроэлементам. Среди них незаменимые в основном элементы IVпериода; Mn, Fe, Zn, Cu, Co. Установлена физиологическая роль и некоторых других d-элементов этого периода: Ti, Cr, V. В организмах микроэлементы могут находиться как в связанном состоянии, так и в виде свободных ионных форм. Установлено, что кремний, алюминий, медь и титан в тканях головного мозга находятся в виде комплексов с белками, тогда как марганец – в ионном виде.
Десять металлов (Mn, Fe, Zn, Cu, Co, Мо, Са, К, Na, Mg) жизненно необходимых для живого организма, получили название «металлы жизни». Так, установлено, что в организме человека массой 70 кг содержание «металлов жизни» составляет (в граммах): кальция – 1700, калия – 250, натрия – 70, магния – 42, железа – 5, цинка – 3, меди – 0,2, марганца, молибдена и кобальта, вместе взятых, – менее 0,1. В теле взрослого человека содержится около 3 кг минеральных солей, причем 5/6 этого количества (2,5 кг) приходится на долю костных тканей.
Для характеристики свойств элементов пользуются такими физическими единицами, как атомные и ионные радиусы, энергия ионизации, сродство к электрону, электроотрицательность.
Вбиологических системах атомы элементов, имеющие близкие значения атомных и ионных радиусов, энергию ионизации, сродство к электрону, электроотрицательность, способны заменять друг друга. Важным в этом отношении является также склонность к образованию химических связей с атомами одного и того же элемента. такое замещение может сопровождаться как усилением (синергизм), так и угнетением (антагонизм) физиологической активности элемента. Например, сходство лития с натрием обуславливает их взаимозаменяемость, которая, как правило, сопровождается синергизмом. Рубидий и цезий по своим физико-химическим характеристикам более близки к калию, в организме они также могу заменять друг друга. Кальций по своим свойствам близок к стронцию и барию. Эти ионы могут заменять кальций в
костях, при этом наблюдается |
как синергизм, так и антагонизм. |
|||
Взаимозаменяемыми являются |
+ |
и |
+ |
Сера и силен сходны по своим |
Mg² |
Be² . |
|||
физико-химическим свойствам и в биосистемах выступают как синергисты. Среди галогенов фтор значительно отличается от других по электроотрицательности и почти не участвует в замещении атомов хлора, брома, йода, тогда как три последних галогена близки по свойствам и могут заменять друг друга в организме.
6
Органы человека по-разному концентрируют в себе различные химические элементы, т. е. микро- и макроэлементы неравномерно распределяются между разными органами и тканями. Большинство микроэлементов накапливаются в печени, костной и мышечной тканях. Эти ткани являются основным депо (запасником) для многих микроэлементов.
Элементы могут проявлять специфическое сродство по отношению к некоторым органам и содержатся в них в высоких концентрациях. Хорошо известно, что цинк концентрируется в поджелудочной железе, йод – в щитовидной, фтор – в эмали зубов, алюминий, мышьяк, ванадий накапливаются в волосах и ногтях, кадмий, ртуть, молибден – в почках, олово –
втканях кишечника, стронций – в предстательной железе, костной ткани, барий
– в пигментной сетчатке глаза, бром, марганец, хром – в гипофизе и т. д. Водород и кислород – макроэлементы. Они входят в состав воды, которой в организме взрослого человека в среднем содержится около 65 %. Вода неравномерно распределена по органам, тканям и биологическим жидкостям человека. Так, в желудочном соке, слюне, плазме крови, лимфе вода составляет от 99,5 до 90 %. В моче, сером веществе головного мозга, печени, коже, спинном мозге, мышцах, легких, сердце – 70 – 80 %. Меньше всего – 40 % воды содержится в скелете.
Макроэлементы – углерод, водород, кислород, азот, сера, фосфор – входят
всостав белков, нуклеиновых кислот и других биологически активных соединений организма. Углерод, водород и кислород входят также в состав углеводов, содержание которых в тканях животных и человека невелико – примерно 2 %. Эти элементы входят в состав липидов (жиров). Кроме того, в состав фосфолипидов входит фосфор в виде фосфатных групп. В наибольшей степени липиды концентрируются в головном мозге (12 %), а затем в печени (5 %), молоке (2 – 3 %) и сыворотке крови (0,6 %). Однако основная часть фосфора – 600 г – содержится в костной ткани. Это составляет 85 % от массы всего фосфора, находящегося в организме человека. Концентрируется фосфор и
втвердых тканях зубов, в состав которых он входит вместе с кальцием, хлором, фтором в виде гидроксил-, хлор-, фторапатитов общей формулы Ca5(PO4)3X, где X = OH, Cl, F соответственно.
Кальций преимущественно концентрируется в костной ткани, а также и в зубной ткани. Натрий и хлор в основном содержатся во внеклеточных жидкостях, а калий и магний – во внутриклеточных. В виде фторидов натрий и калий входят в состав костной и зубной ткани. Магний в виде фосфата Mg3(PO4)2 содержится в твердых тканях зуба.
Некоторые макроэлементы (магний, кальций) и большинство микроэлементов содержатся в организме в виде комплексов с биолигандами –
аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т. д. Так, ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Co2+ – в витамин B12, Mg2+ – в хлорофилл. Известны многочисленные биокомплексы и других элементов (Cu, Zn, Mo и др.), играющие важную биологическую роль в организме.
7

Выявлены заболевания, связанные с недостатком или избытком элементов в организме человека. Так, при рахите происходит нарушение фосфорнокальциевого обмена, что приводит к снижению содержания кальция. При нефрите из-за нарушения электролитного обмена уменьшается содержание кальция, натрия, хлора и повышается содержание магния, калия в организме. Дефицит меди служит одной из причин раковых заболеваний. В некоторых случаях поражение лёгких раком у людей пожилого возраста врачи связывают с возрастным снижением содержания меди в организме. Однако избыток меди в организме приводит к нарушению психики и параличу некоторых органов (болезнь Вильсона). Человеку причиняют вред лишь относительно большие количества соединений меди.
Такие закономерности обусловлены тем, что в организме человека поддерживается баланс оптимальных концентраций биогенных элементов – химический гомеостаз. Нарушение этого баланса может приводить к различным заболеваниям.
В настоящее время твердо установлено, что недостаток определенных химических элементов в почве приводит, соответственно, к пониженному уровню этих элементов в организме людей, проживающих в данной местности, и к тем или иным заболеваниям. Заболевания, связанные с аномальным содержанием некоторых элементов в почве и воде определенных географических местностей (биогеохимических провинциях), называются эндемическими. Так, в Украине Карпаты и Крым являются геохимическими провинциями с пониженным содержанием йода, Кировоградская область – с повышенным содержанием урана.
Информация о содержании того или другого химического элемента в организме человека важна как для диагностики заболевания, так и для направления его лечения. Дефицит химических элементов в организме человека характеризуется определенными симптомами (табл. 2).
Таблица 2.
Характерные симптомы дефицита химических элементов в организме человека
Дефицит Типичный симптом элемента
Ca Замедление роста скелета Mg Мускульные судороги
Fe Анемия, нарушение иммунной системы
Zn Повреждение кожи, замедление роста, замедление сексуального созревания
Cu Слабость артерий, нарушение деятельности печени, вторичная анемия
Mn Бесплодность, ухудшение роста скелета
Mo Замедление клеточного роста, склонность к кариесу Co Злокачественная анемия
Ni Учащение депрессий, дерматиты Cr Симптомы диабета
8
Si |
Нарушение роста скелета |
F |
Кариес зубов |
I |
Нарушение работы щитовидной железы, замедление метаболизма |
Se |
Мускульная (в частности, сердечная) слабость |
Бурное техническое развитие цивилизации привело не только к созданию современных технологий, но и появлению экологических проблем. Окружающая среда загрязняется двумя путями: естественным или антропогенным, т.е. вследствие жизнедеятельности человека.
Естественные катастрофы – землетрясения, извержения вулканов и т.п. – сильно загрязняют окружающую среду. Но природа за много лет приспособилась к большинству естественных загрязнений и научилась их обезвреживать.
За годы технического прогресса участились техногенные катастрофы. Например, 26 апреля 1986 года произошла наибольшая ядерная авария. Радиоактивные вещества из реактора попали в атмосферу и образовали радиоактивное облако, размеры которого составляли 30 км в ширину и 100 км в
длину. Последствия этой |
катастрофы Украина ощущает даже по прошествии |
|
24 лет. |
|
|
Значительные количества SО2, NО, СО, СО2 накапливаются |
в атмосфере |
|
вследствие промышленной |
деятельности человека и вместе |
с воздухом, |
которым мы дышим, попадают в наш организм, что отрицательно сказывается на здоровье. В последние годы содержание СО2 в атмосфере резко увеличилось, что, по данным ученых, привело к повышению температуры на планете за последние 100 лет на 1 градус. В 1997 году в Киото на Международной конференции развитые страны мира подписали соглашение, по которому был установлен лимит на выбросы в атмосферу промышленных газов.
В практике санитарно-гигиенических, биохимических, клинических и контрольно-аналитических лабораторий для изучения качества питьевых и сточных вод, пищевых продуктов, воздуха, почвы методы качественного анализа занимают ведущее место. В клинических и биохимических лабораториях эти методы используют при изучении химического состава отдельных органов и тканей, обмене веществ в организме человека и животных в норме и при патологии. Химический анализ крови, мочи, желудочного сока и других биологических жидкостей облегчает диагностику заболевания и дает возможность наблюдать за течением заболевания в динамике.
В фармацевтической практике методы количественного и качественного анализа дают возможность установить чистоту препарата, то есть его пригодность для лечебных целей, контролировать процесс изготовления лекарств, как в условиях аптеки, так и заводского производства.
Поэтому овладение основами аналитических методов анализа является необходимым условием подготовки высококвалифицированных специалистов в медицине.
9
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БИОГЕННЫЕ ЭЛЕМЕНТЫ И МЕТОДИКА ИХ ВЫПОЛНЕНИЯ
Качественные реакции на катионы
1. Катион К+
Действие натрия гексанитрокобальтата (ІІІ) Na3[Co(NO2)6]
Na3[Co(NO2)6] в нейтральном или уксуснокислом растворе дает с ионами калия желтый кристаллический осадок калия-натрия гексанитрокобальтата (ІІІ):
2KCl + Na3[Co(NO2)6] = K2Na[Co(NO2)6]↓ + 2NaCl
в ионном виде:
2K+ + Na+ + [Co(NO2)6]3– = K2Na[Co(NO2)6]↓
Выполнение:
В пробирку поместить 3-4 капли раствора соли калия прибавить 2-3 капли раствора реактива. Если осадок не выпадает, дать смеси постоять. В щелочной среде реакцию проводить нельзя, так как разлагается сам реактив. Реакция чувствительна, ею пользуются для осаждения иона К+ из сыворотки крови при перманганатометрическом определении калия в крови.
2. Катион Са2+
Действие аммония оксалата (NH4)2C2O4
Этот реактив с солями кальция дает белый мелкокристаллический осадок оксалата кальция CaC2O4:
CaCl2 + (NH4)2C2O4 = CaC2O4↓ + 2NH4Cl
в ионном виде:
Ca2+ + C2O42– = CaC2O4↓
Выполнение:
К 5-6 каплям раствора соли кальция прибавить 5-6 капель реактива. Наблюдать выпадение осадка. Осадок CaC2O4 не растворим в уксусной кислоте, но легко растворяется в минеральных кислотах (испытать и написать уравнения). Рассмотренная реакция применяется для осаждения ионов Са2+ при определении кальция в моче и крови перманганатометрическим методом.
3. Катион Mg2+
Действие раствора натрия гидрофосфата Na2HPO4
Na2HPO4 в присутствии NH3·H2O и NH4Cl осаждает из растворов солей магния белый кристаллический осадок магния аммония фосфата:
MgCl2 + Na2HPO4 + NH3·H2O = MgNH4PO4↓ + 2NaCl + H2O
в ионном виде:
Mg2+ + HPO42– + NH3·H2O = MgNH4PO4↓ + H2O
Выполнение:
К 1-2 каплям раствора магния хлорида прибавить по 2 капли раствора NH4Cl; 2М раствора аммиака и 1 каплю раствора Na2HPO4. Реакция образования MgNH4PO4 применяется в биохимическом анализе для определения магния в крови.
10
